DC-CIK联合化疗治疗中晚期食管鳞癌的临床疗效评价*
2015-03-16张曙光
赵 媛,宁 实,杨 光,张曙光△
(1.中国医科大学附属第一医院胸外科,沈阳 110001;2.武警辽宁省总队第二支队,沈阳 110034)
·论 著·
DC-CIK联合化疗治疗中晚期食管鳞癌的临床疗效评价*
赵 媛1,宁 实2,杨 光1,张曙光1△
(1.中国医科大学附属第一医院胸外科,沈阳 110001;2.武警辽宁省总队第二支队,沈阳 110034)
目的 研究树突状细胞(DC)-细胞因子诱导的杀伤细胞(CIK)联合多西紫杉醇+顺铂化疗(DC方案)治疗中晚期食管鳞癌患者的临床疗效。方法 选取100例中晚期食管鳞癌患者,将其随机分为治疗组与对照组,每组50例。两组患者均给予DC化疗,治疗组在化疗的基础上给予DC-CIK免疫细胞治疗,观察两组治疗后的近期疗效、不良反应与治疗前后外周血清肿瘤标志物的浓度及免疫功能。结果 治疗后治疗组近期及远期临床疗效均优于对照组(P<0.05);治疗后两组外周血清角蛋白片段(cyfra211)、鳞状细胞癌相关抗原(SCC)、癌胚抗原(CEA)、糖类抗原(CA125)较治疗前有所降低(P<0.05)。治疗组外周血清CD3、CD8、CD56/CD3、CD16/CD3、IgG、IgM、IgA较治疗前有所升高(P<0.05),CD4/CD8较治疗前降低(P<0.05)、CD4较治疗前无明显改变(P>0.05)。对照组外周血清CD3、CD8、CD4、CD4/CD8、CD56/CD3、CD16/CD3较治疗前无明显改变(P>0.05),对照组IgG、IgM、IgA较治疗前降低(P<0.05)。治疗后治疗组外周血清cyfra211、SCC、CEA、CA125浓度均低于对照组(P<0.05)。治疗后治疗组外周血清CD3、CD8、CD56/CD3、CD16/CD3、IgG、IgM、IgA明显高于对照组(P<0.05),CD4/CD8明显低于对照组(P<0.05),CD4较对照组差异无统计学意义(P>0.05)。治疗组治疗中出现发热、寒战;两组患者治疗后均出现不同程度消化道反应、骨髓抑制,且治疗组发生率低于对照组(P<0.05)。结论 DC-CIK联合化疗能提高中晚期食管鳞癌的临床疗效且不良反应较小。
中晚期食管鳞癌; DC-CIK; 临床疗效; 肿瘤标记物; 免疫功能
我国是食管癌发生率和病死率最高的国家,全球超过一半的食管癌患者在我国,食管癌在我国各类恶性肿瘤中发病率、病死率居第4位,因食管癌早期症状不明显,85%的患者确诊时已经进入中晚期,2年生存率不超过15%[1]。以往手术是食管癌的首选治疗方法,但随着化疗药物的不断发展,同步化疗与手术的疗效相近,已经成为食管癌的首选治疗方案,食管癌的同步化疗标准方案为顺铂+5-氟尿嘧啶(PF方案),但患者耐受性非常差,近年来紫杉醇+顺铂(DC方案)成为了食管癌治疗的主流方案,而多西紫杉醇是新一代半合成紫杉醇的衍生物,不良反应相对较少,抗肿瘤活性较强[2]。过继免疫治疗对于中晚期恶性肿瘤患者是一种安全、可行的治疗方法,采用体外培养的树突状细胞(DC)联合细胞因子诱导的杀伤细胞(CIK)作为肿瘤免疫治疗的方案已经受到了广大医务工作者的重视,采用DC-CIK治疗中晚期食管癌取得了较好的临床疗效且患者耐受性良好[3]。但目前关于DC-CIK联合传统化疗药物治疗中晚期食管鳞癌的研究报道较少,其临床疗效不清。本研究对中晚期食管鳞癌患者采用DC-CIK联合传统化疗药物(DC方案),检测患者治疗前后外周血清的肿瘤标志物及免疫指标并观察患者的近期及远期临床疗效,现报道如下。
1 资料与方法
1.1 一般资料 收集中国医科大学胸科及其生物治疗科2010年2月至2014年2月(随访时间为1年)经胃镜病理证实组织学类型为中晚期食管鳞癌的患者100例(无手术机会)。患者年龄34~75岁,体质量指数23~26 kg/m2,随机分为两组,两组患者在性别、年龄、病理分期(TNM分期)、血清肿瘤标志物浓度、免疫学指标等方面差异均无统计学意义(P>0.05)。排除标准:(1)Karnofsky评分在70分以下,预计生存时间小于3个月;(2)患者治疗前血、尿、便常规、凝血、肝肾功能等化验检查结果出现严重异常;(3)合并严重心脑血管疾病、糖尿病、甲亢等代谢系统及内分泌系统疾病患者;(4)胸部CT检查结果提示胸腔内存在大量积液;(5)治疗前1个月内有外伤史及大手术史;(6)出现中枢神经系统的广泛性转移;(7)影像学(CT、MRI、彩超)检查结果显示出现重要血管及其周围神经的侵蚀且因血管侵蚀而出现咯血;(8)自体免疫性疾病、细胞因子过敏、移植后长期服用免疫抑制剂者。纳入研究患者均取得患者本人或其法定代理人知情同意。本研究方案获得本院医学伦理委员会批准。
1.2 方法
1.2.1 研究对象的分组与处理 采取随机数字表法随机分为治疗组和对照组,每组50例,治疗组男32例,女18例,平均(55.87±6.32)岁;对照组男30例,女20例,平均(56.52±5.54)岁。两组患者入院后第1天治疗前即开始抽血测定肿瘤标志物、外周血细胞免疫及体液免疫指标。两组均予以DC方案化疗6周期[2],第1天静脉滴注多西紫杉醇135 mg/m2;第2~4天静脉滴注顺铂 30 mg/m2。21 d为1个周期,连续化疗2周期后评价疗效。化疗期间常规给予抗过敏、止吐、保肝等对症处理,用药过程中监测血压、脉搏、呼吸,化疗过程中均给予充足的营养供给,必要时给予肠外营养。治疗组同步予以生物治疗6疗程(每次化疗与生物治疗间隔14 d)。两组6周期化疗结束后7 d测定肿瘤标志物、外周血细胞免疫及体液免疫指标。记录两组患者治疗过程中出现的不良反应。
1.2.2 DC-CIK的制备及回输方案[3]经过细胞制备:经血液成分分离机采集的单个核细胞,诱导DC等过程完成细胞制备。细胞回输:第1、2次回输时间分别为化疗结束后7 d的上午、下午;第3、4次回输时间分别为化疗结束后14 d的上午、下午;21 d为1个周期;第1周期治疗前及6周期治疗结束后相关指标检测对比。
1.2.3 肿瘤标志物测定 抽取静脉血3 mL,注入玻璃试管内,常温下静置10 min,以3 000 r/min离心10 min,分离血清立即放于-70 ℃的超低温冰箱内保存待测,采用微粒子酶免疫分析法检测角蛋白片段(cyfra211)、癌胚抗原(CEA)、糖类抗原125(CA125)血清学浓度,鳞状上皮细胞癌抗原(SCC)采用酶联免疫吸附试剂法检测,所有肿瘤标志物检测均需严格按照试剂盒说明进行。
1.2.4 CD3、CD4、CD8、CD4/CD8、CD56/CD3、CD16/CD3检测 治疗结束后8 d抽取患者静脉血,用淋巴细胞分离液密度梯度离心法分离外周血中有核细胞,外周血中有核细胞染色标记30 min,溶血10 min,以3 000 r/min离心10 min,弃去上清液,PBS冲洗2次,随后上机检测,并采用Cellquest软件进行样本检测,所取标本均在7 d内测定。
1.2.5 IgG、IgM、IgA检测 治疗前及治疗后8 d抽取静脉血5 mL,注入玻璃试管中,静置10 min,以3 000 r/min离心10 min,分离血清在-70 ℃超低温冰箱内保存待测,用免疫散射比浊法检测免疫球蛋白(IgG、IgM、IgA),操作过程严格按照试剂盒说明进行,所取标本均在7 d内测定。
1.2.6 近期临床疗效评价标准 根据实体肿瘤的近期临床疗效评价标准可以分为:完全缓解(CR)、部分缓解(PR)、病变稳定(SD)、病变进展(PD),CR+PR是客观有效率(ORR);CR+PR+SD是疾病控制率(DCR),连续化疗2周期后,行影像学(CT或MRI)对病灶进行测量,以评价疗效[4]。
1.2.7 远期临床疗效评价标准与定期随访 治疗结束后继续做好电话随访(2 次/月),记录患者无进展生存期(PFS)。
2 结 果
2.1 两组患者治疗前临床资料比较 治疗组和对照组食管癌患者治疗前临床资料差异无统计学意义(P>0.05),具有可比性,见表1。
2.2 两组食管癌患者治疗后近期及远期临床疗效比较 治疗组CR、PR、ORR、DCR均高于对照组(P<0.05),SD、PD均低于对照组(P<0.05),见表2。治疗组和对照组PFS分别为(9.54±0.87)、(8.22±0.71)个月,差异有统计学意义(P<0.05)。
2.3 不良反应的临床观察 两组治疗中均未发现严重过敏反应;对照组治疗后主要不良反应为腹泻(20例,40%)、恶心伴呕吐(24例,48%)、骨髓抑制(37例,74%);治疗组主要不良反应为发热(32例,64%)、高热伴寒战(10例,20%)、皮疹(5例,10%)。治疗组化疗后主要不良反应为腹泻(11例,22%)、恶心伴呕吐(20例,40%)、骨髓抑制(26例,52%)。治疗组腹泻、恶心伴呕吐、骨髓抑制等不良反应均低于对照组(P<0.05)。
2.4 两组食管癌患者治疗后血清肿瘤标志物浓度比较 两组食管癌患者治疗后外周血清cyfra211、SCC、CEA、CA125浓度均较治疗前降低(P<0.05);治疗后治疗组外周血清cyfra211、SCC、CEA、CA125浓度低于对照组(P<0.05),见表3。
2.5 两组食管癌患者治疗后细胞免疫及体液免疫指标比较 治疗组外周血清CD3、CD8、CD56/CD3、CD16/CD3、IgG、IgM、IgA较治疗前有所升高(P<0.05),CD4/CD8较治疗前降低(P<0.05)、CD4较治疗前无明显改变(P>0.05);对照组外周血清CD3、CD8、CD4、CD4/CD8、CD56/CD3、CD16/CD3较治疗前无明显改变(P>0.05),对照组IgG、IgM、IgA较治疗前降低(P<0.05);治疗后治疗组外周血清CD3、CD8、CD56/CD3、CD16/CD3、IgG、IgM、IgA明显高于对照组(P<0.05),CD4/CD8明显低于对照组(P<0.05),CD4较对照组差异无统计学意义(P>0.05),见表4~5。
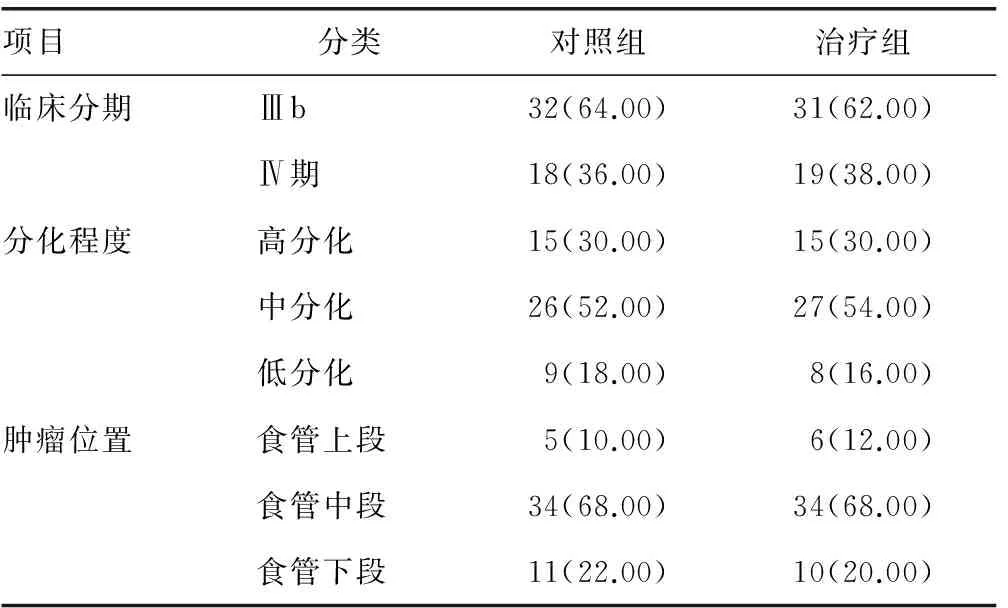
表1 两组患者治疗前临床资料比较[n(%)]

表2 两组患者近期临床疗效比较[n(%)]
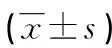
表3 两组患者治疗前后外周血清肿瘤标志物浓度的比较
注:与本组治疗前比较,#P<0.05;与对照组治疗后比较,△P<0.05。
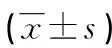
表4 两组患者治疗前后细胞免疫功能比较
注:与本组治疗前比较,#P<0.05;与对照组治疗后比较,△P<0.05。
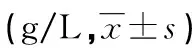
表5 两组患者治疗前后体液免疫功能比较
注:与本组治疗前比较,#P<0.05;与对照组治疗后比较,△P<0.05。
3 讨 论
食管癌是我国常见的恶性肿瘤,病死率高,传统方法首选手术治疗,但很多患者发现时已经没有了手术机会,远处转移是治疗失败的主要原因,以往针对一些非手术适应证食管癌患者,同期放化疗被认为是标准的综合治疗方案,且同期放化疗的临床疗效与手术治疗接近,但是该方案不良反应较大,患者耐受性差[5]。肿瘤的治疗途径包括全身治疗和局部治疗两大类。全身治疗主要为放疗、化疗、药物靶向治疗、基因靶向治疗、免疫细胞治疗等,局部治疗目前有放射性粒子组织内放疗、局部灌注化疗、射频消融术等,这些方法均有其自身优点和缺点。将这些方法有效地联合起来,充分发挥各自优势,是食管鳞癌治疗的关键,目前针对传统化疗联合DC-CIK免疫细胞治疗中晚期食管癌的相关研究较少。
细胞免疫是T淋巴细胞参与的一种重要免疫反应,T细胞包括CD3、CD4、CD8等亚群,恶性肿瘤患者往往免疫功能受到严重的抑制,放化疗、手术创伤均能加重免疫抑制,表现为外周血中白细胞、淋巴细胞绝对值明显减少,流式细胞仪检查发现CD3、CD4、CD8等亚群明显降低,而这几个亚群均参与机体特异性细胞免疫反应[6]。而本研究结果显示,对照组化疗后外周血清CD3、CD8、CD4、CD4/CD8、CD56/CD3、CD16/CD3较治疗前无明显改变(P>0.05),而IgG、IgM、IgA较治疗前降低(P<0.05),可能与化疗药物抑制肿瘤细胞,与化疗过程中加强营养有关。过继性细胞免疫治疗主要是通过注射患者自体的经过体外活化、扩增的免疫活性细胞,激发或调动机体的免疫系统,增强抗肿瘤免疫性进而杀死肿瘤细胞或抑制肿瘤细胞生长,包括DC与CIK等。DC是目前已知的抗原提呈能力最强的细胞,成熟的DC可以有效诱导抗原特异性T细胞增殖和活化,激活自然杀伤细胞(NK)和自然杀伤T细胞(NKT),而CIK能在多种细胞因子的刺激下具备了T淋巴细胞强大的抗原活性和NK细胞的广谱杀肿瘤细胞的双重特点,是肿瘤过继治疗的首选免疫细胞[7-8]。B细胞是机体内参与体液免疫的一种重要淋巴细胞,其水平高低与血清抗体水平密切相关,IgG、IgM是人体内重要的免疫球蛋白,在体液免疫过程中发挥重要作用[9]。本研究治疗组外周血清CD3、CD8、CD56/CD3、CD16/CD3、IgG、IgM、IgA较治疗前有所升高(P<0.05),CD4/CD8较治疗前降低(P<0.05)、CD4较治疗前无明显改变(P>0.05),与汪治宇等[3]结果相同。CEA是一种胚胎性致癌抗原,在各种肿瘤患者的血清中均可升高,食管癌细胞就能直接分泌CEA[10]。CA125是Bast等用乱草浆液性乳突囊腺癌细胞系免疫BALB/c小鼠经与骨髓瘤细胞杂交得到的单克隆抗体,对于生殖系统的肿瘤CA125具有一定的诊断意义[11]。但有研究发现,肺癌患者血清CA125水平也可增高,并与其病理学分类(细胞类型)、TNM分期、疗效及预后密切相关[12]。SCC是一种肿瘤相关抗原,它与临床晚期的鳞状细胞癌具有很大的相关性,常用于肿瘤的检测与预后的判定[13],本研究结果显示,治疗后两组患者外周血清CEA、CA125、cyfra211、SCC浓度均较治疗前降低(P<0.05),且治疗组外周血清CEA、CA125、cyfra211、SCC浓度低于对照组(P<0.05)。此外治疗后治疗组CR、PR、ORR、DCR、PFS均高于对照组(P<0.05),SD、PD均低于对照组(P<0.05)。治疗组在治疗中出现发热、寒战,给予相应处理后症状消失,治疗过程中两组患者治疗过程中均出现腹泻、恶心伴呕吐、骨髓抑制,治疗组不良反应发生率低于对照组(P<0.05)。以上说明DC-CIK联合传统化疗药物能很好地调节、提高患者机体免疫功能,提高临床疗效,且不良反应较少。
DC-CIK联合传统化疗治疗过程中的注意事项及临床经验总结如下:(1)需要严格把握治疗适用人群。本研究入选的病例均为增强CT或MRI平扫,结果显示肿瘤无侵蚀纵隔重要血管及其神经,因侵蚀较严重时,化疗造成肿瘤组织坏死易出现大出血。(2)治疗过程中应让患者保持充足的营养供给,提高机体免疫力[14]。(3)治疗前后可以皮下注射白细胞介素-2(IL-2)。有研究报道,化疗联合IL-2在小鼠模型实验中能很好地抑制肿瘤细胞生长[15]。
综上所述,DC-CIK联合传统化疗药物的治疗方案能很好地治疗中晚期食管鳞癌患者,纠正患者体内的免疫失衡,激活抗肿瘤免疫,提高患者的近期与远期疗效,同时减轻化疗不良反应。但是针对有手术机会的食管鳞癌患者,DC-CIK联合化疗在术前的应用能否抑制肿瘤细胞转移、缩小瘤体、减少肿瘤细胞侵蚀还需要研究者在今后的临床实践中去进一步研究论证。
[1]Compagnin C,Mognato M,Celotti L.Cell proliferation and cell cycle alterations in oesophageal p53-mutated cancer cells treated with cisplatin in combination with photodynamic therapy[J].Cell Prolif,2010,43(3):262-274.
[2]陈斯泽,陈雪梅,丁颖,等.DC方案与PF方案化疗与同步放疗治疗中晚期食管鳞癌[J].南方医科大学学报,2011,31(4):727-729.
[3]汪治宇,刘荣凤,王聪敏.CIK细胞治疗中晚期食管癌的疗效观察及护理[J].药物与临床,2012,9(18):38-40.
[4]杨晓利,王峰,何炜,等.贝伐单抗联合培美曲塞加顺铂一线治疗Ⅳ期非小细胞肺癌的临床观察[J].西安交通大学学报:医学版,2013,34(4):554-556.
[5]Mariette C,Piessen G,Triboulet JP.Therapeutic strategies in oesophageal carcinoma:role of surgery and other modalities[J].Lancet Oncol,2007,8(6):545-553.
[6]鲍健,孙媛媛,葛磊,等.化疗联合 CIK 输注对晚期NSCLC患者T细胞亚群及生存的影响[J].安徽医药,2014,19(12):2356-2359.
[7]Linn YC,Lau SK,Liu BH,et al.Characterization of recognition and functional heterogeneity exhibited by cytokin-induced killer cell subsets against acute myeloid leukaemia target cell[J].Immunology,2009,126(3):423-435.
[8]Sabado RL,Bhardwaj N.Directing dendritic cell immunotherapy towards successful cancer treatment[J].Immunotherapy,2010,2(1):37-56.
[9]李晓辉,李军民,冯秋霞,等.围手术期肠内营养支持对食管癌患者术后免疫功能的影响[J].中国医学创新,2011,8(8):57-59.
[10]贾静,马洪杰,张健鹏.五项血清肿瘤标记物联合检测在肺癌诊断中的应用[J].现代肿瘤医学,2008,16(10):1694-1696.
[11]李洪生,黄婵娟.联合检测血清CYFRA21-1,CA125和NSE对肺癌诊断的价值[J].现代肿瘤医学,2008,16(6):951-952.
[12]李杨,李苏利.CA125与肺癌[J].中国误诊学杂志,2004,9(4):1416-1417.
[13]张毅敏,夏文进.血清标志物CYFRA21-1、NSE、CEA、CA199、CA125、SCC联合检测在肺癌诊断中的应用价值[J].中国癌症杂志,2008,18(4):306-309.
[14]谢天鹏,赵雍凡,刘华英,等.早期肠内营养对食管癌术后全身炎性反应及细胞免疫功能的影响[J].四川医学,2005,26(1):18-20.
[15]Fagnoni FF,Zerbini A,Pelosi G,et al.Combination of radiofrequency ablation and immunotherapy[J].Front Biosci,2008,13(2):369-381.
Evaluation on clinical efficacy of DC-CIK combined with hemotherapy in treating moderate and advanced esophageal carcinoma*
ZHAOYuan1,NINGShi2,YANGGuang1,ZHANGShu-guang1△
(1.DepartmentofThoracicSurgery,FirstAffiliatedHospitalofChinaMedicalUniversity,Shenyang,Liaoning110001,China;2.SecondDetachment,LiaoningArmedPoliceCorps,Shenyang,Liaoning110034,China)
Objective To investigate the clinical efficacy of dentritic cells cytokines induced killer cell(DC-CIK) combined with the chemotherapy of cisplatin plus docetaxel(DC regimen) in treating moderate and advanced esophageal squamous carcinoma.Methods 100 patients with moderate and advanced esophageal squamous carcinoma were randomly divided into the treatment group and the control group,50 cases in each group.The two groups were treated with the DC regimen.On the basis of chemotherapy,the treatment group was given the DC-CIK immune cell therapy.The short-term effect after treatment,adverse reactions,peripheral serum concentrations of tumor markers before and after treatment and immune function were observed in the two groups.Results The short-term and long-term clinical efficacies after treatment in the treatment group were significantly better than those in the control group(P<0.05);the peripheral serum cyfra211,SCC,CEA and CA125 levels after treatment in the two groups were decreased compared with before treatment(P<0.05);after treatment,the peripheral serum CD3,CD8,CD56/CD3,CD16/CD3,IgG,IgM and IgA in the treatment group were increased compared with before treatment(P<0.05),while CD4/CD8 was decreased compared with that before treatment(P<0.05),CD4 had no significant change compared with before treatment(P>0.05).The peripheral serum CD3,CD8,CD4,CD4/CD8,CD56/CD3 and CD16/CD3 after treatment had no obvious changes compared with before treatment(P>0.05),while the IgG,IgM and IgA levels after treatment were decreased compared with before treatment(P<0.05).The peripheral serum cyfra211,SCC,CEA and CA125 concentrations after treatment were lower than those in the control group(P<0.05);peripheral serum CD3,CD8,CD56/CD3,CD16/CD3,IgG,IgM and IgA levels after treatment in the treatment group were significantly higher those in the control group(P<0.05),while CD4/CD8 was significantly lower than that in the control group(P<0.05),CD4 had no significant difference compared with the control group.Fever and chills occurred during therapy in the treatment group;the two groups appeared different degrees of gastrointestinal reactions,bone marrow suppression after treatment,moreover the occurrence rates in the treatment group was lower than that in the control group(P<0.05).Conclusion The DC-CIK combined with chemotherapy can raise the clinical efficacy in treating moderate and advanced esophageal squamous carcinoma with less adverse reactions.
advanced esophageal carcinoma; DC-CIK; Clinical efficacy; tumor markers; immune function
国家自然科学青年科学基金资助项目(81201890);辽宁省自然科学基金资助项目(2013021002)。
赵媛,女,本科,护师,主要从事食管外科疾病护理方面的研究。
△通讯作者,E-mail:zsg100610@163.com。
10.3969/j.issn.1672-9455.2015.19.005
A
1672-9455(2015)19-2823-04
2015-03-25
2015-07-20)
