核酸适配体修饰的铁纳米粒对EGFR阳性肿瘤细胞的靶向热疗效应
2015-03-16于连元段金虹许海燕杨先达
于连元,胡 燕*,段金虹,许海燕,杨先达*
(中国医学科学院基础医学研究所1.病理学与病理生理学系;2.生物医学工程学系,北京100005)
表皮生长因子受体(epithelial growth factor receptor,EGFR)在肿瘤的生长、增殖、分化等生理学过程中起重要作用。它在许多肿瘤表面过表达,如上皮样恶性肿瘤、恶性胶质瘤、肺癌、胰腺癌、人胶质细胞瘤,使其成为肿瘤治疗中一种重要的靶向分子。目前针对EGFR 阳性肿瘤的靶向治疗手段主要依赖单克隆抗体和小分子抑制剂,但患者接受这些治疗后容易产生免疫耐受,降低治疗效果,因此急需要一种新型的针对EGFR 阳性肿瘤的靶向治疗手段。铁纳米粒可以在交变磁场中吸收热量,对细胞产生杀伤效应,但这种效果缺乏靶向性。核酸适配体是经过筛选得到的单链寡聚核苷酸,是一种新型的靶向分子,与抗体相比其具有免疫原性低、制备成本低、易于修饰等诸多优点,目前被广泛研究于肿瘤的诊断和靶向治疗。本实验通过生物素与链霉素反应,将针对EGFR 的核酸适配体[1-2]与铁纳米粒结合,构建核酸适配体修饰的铁纳米粒,并首次探索了其对EGFR 阳性肿瘤细胞的热疗调节效应。
1 材料与方法
1.1 材料
人胶质瘤细胞系(U251)和人乳腺癌细胞系(MDA-MB-231)(北京协和医学院细胞中心),铁纳米粒(Promaga 公司),亲和素修饰物、FAM 修饰物(Invitrogen 公司),Taq 酶和dNTPs(Genstar 公司)。
1.2 方法
1.2.1 细胞的培养:U251 和MDA-MB-231 培养于含10%胎牛血清的DMEM(高糖型)。两种细胞系培养在37 ℃、5% CO2的孵箱中。所有细胞实验均使用对数增殖期间的细胞。
1.2.2 Apt-NP 的构建:PCR 获得P1-biotin 修饰的双链EGFR 核酸适配体(95 ℃,40 s;55 ℃,30 s;72 ℃,40 s;25 个循环),混合60 pmol 的PCR 产物和100 μL 链霉素修饰的铁纳米粒,室温下振荡15 min,PBS 洗涤3 次,加40 mmol NaOH 振荡5 min,磁铁吸附后弃去上清,加100 μL PBS 重悬。
1.2.3 流式检测:PCR 获得P1-FAM 修饰的双链EGFR 核酸适配体。混合20 pmol PCR 产物与20 μL磁珠,室温下振荡15 min,PBS 洗涤3 次,加40 mmol NaOH 振荡5 min,磁铁吸附后取上清,加入100 mmol盐酸中和至pH 呈中性,混匀。分别于U251 和MDMBA-231 细胞孵育30 min,PBS 洗涤3 次,200 μL PBS 重悬后,进行流式检测。
混合40 pmol FAM 标记的EGFR DNA 杂交探针与40 μL Apt-NP 混匀,室温下振荡15 min,PBS洗涤3 次后重悬,进行流式检测。
1.2.4 表征检测:分别吸取10 μL Apt-NP 以及NP,双蒸水稀释至1 mL,在动态光散射仪下分别检测其尺寸分布。
1.2.5 吸光度值检测:U251 和MD-MBA-231 细胞分别接种于6 孔板中,过夜培养。分别加入100 μL Apt-NP 或未修饰的铁纳米粒(NP),37 ℃ 孵育30 min,PBS 洗涤3 次,室温下普鲁士蓝染液反应20 min,PBS 洗涤2 次,酶标仪检测760 nm 吸收波长。
1.2.6 Apt-NP 热疗效率检测:U251 和MD-MBA-231 细胞分别接种6 孔板中过夜培养,分别加入100 μL Apt-NP、100 μL 未修饰的铁纳米粒、60 pmol游离的核酸适配体。37 ℃孵育30 min,PBS 洗涤2次,无血清培养基重悬,在交变磁场中孵育5 h,取上清于96 孔板中,加入乳酸脱氢酶试剂盒中的反应液反应30 min,酶标仪检测490 nm 吸收波长。
1.3 统计学分析
多样本数据采用方差分析,用SPSS 分析各组数据,每组数据以均数±标准差(±s)表示。
2 结果
2.1 EGFR 核酸适配体的结合性质
在EGFR 阳性的U251 细胞中,EGFR 核酸适配体(EGFR-Apt)荧光强度较随机DNA(Random)明显增强,曲线右移(图1A 黑色);在MDA-MB-231 细胞中,EGFR 核酸适配体与随机DNA 的荧光强度基本相同,没有明显位移(图1B)。
2.2 Apt-NP 的构建
相比于对照,DNA 探针处理过的铁纳米粒荧光强度明显增强,曲线右移(图2A 黑色);而未修饰的铁纳米粒荧光强度没有变化,曲线没有明显位移(图2B)。
2.3 Apt-NP 的尺寸表征
Apt-NP 的平均直径为574 nm,呈单峰分布,未修饰的游离铁纳米粒的平均直径为400 nm(图3)。
2.4 Apt-NP 特异性地结合EGFR 阳性细胞
Apt-NP 处理过的U251 细胞中吸光度值较高,而Apt-NP 处理过的MDA-MB-231 细胞中吸光度值较低(P<0.05);未修饰的铁纳米粒在两组细胞的吸光度值均较低(图4)。
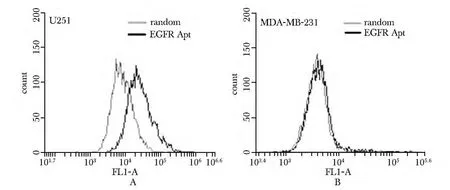
图1 EGFR 核酸适配体结合特异性的流式分析Fig 1 The bindings of the EGFR aptamer to U251 cells and MDA-MB-231 cells

图2 DNA 杂交实验检测Apt-NP 的构建Fig 2 The binding of FAM-labeled DNA probes to Apt-NP and blank NP
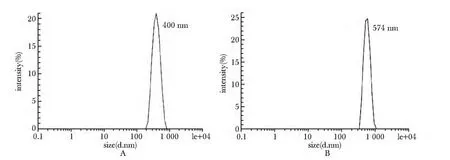
图3 动态光散射评估Apt-NP 尺寸Fig 3 Size distribution analysis of Apt-NP
2.5 Apt-NP 对热疗效果的靶向调节作用
Apt-NP 能显著提升对EGFR 阳性U251 肿瘤细胞的热疗杀伤效率(P<0.05),而NP 和APT 均没有此作用;在MDA-MB-231 细胞组中,Apt-NP、NP、APT 均没有提升热疗效率的作用,说明Apt-NP 可以靶向性的提升针对EGFR 阳性U251 肿瘤细胞的热疗杀伤作用(图5)。
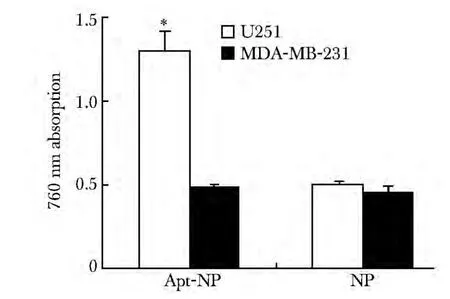
图4 普鲁士蓝染色吸光度值检测Fig 4 The attachment of Apt-NP and NP to U251 cells or MDA-MB-231 cells measured by absorption at 760 nm(±s)
3 讨论
本实验构建了一个核酸适配体修饰的铁纳米粒复合体(Apt-NP),尺寸为574 nm,呈单峰分布,对U251 肿瘤细胞有较强结合,而对MDA-MB-231细胞基本没有结合。此外,Apt-NP 可以显著的提高EGFR 阳性U251 肿瘤细胞的热疗杀伤效率,而对MDA-MB-231 细胞的热疗杀伤效率基本没有影响。
本实验首次将EGFR 适配体与铁纳米粒结合并用来提升对EGFR 阳性的U251 肿瘤细胞的靶向热疗杀伤效率。EGFR 的过度激活能导致细胞的增殖不受控制,在多种恶性肿瘤中有高表达,包括人胶质细胞瘤、肺癌、结肠直肠癌和头颈部鳞状细胞癌等。

图5 Apt-NP 对EGFR 阳性U251 细胞热疗效应的影响Fig 5 Apt-NP enhanced the thermal damage to the U251 cells but not the MDA-MB-231 cells(±s,n=8)
此外,随着EGFR 激活的增多,细胞凋亡减少,血管生成增加,EGFR 的突变还与人胶质瘤细胞的发生发展有关[1]。针对EGFR 的靶向治疗是目前肿瘤治疗研究领域的热点,主要治疗手段有单克隆抗体,如西妥昔单抗和帕尼单抗,以及小分子抑制剂如吉非替尼、埃罗替尼和拉帕替尼[3-6],但是这些疗法容易使患者产生耐药性,因此需要研发全新的针对EGFR 的靶向治疗手段[7-8]。肿瘤热疗是通过升高体温或局部加温,改变肿瘤细胞所处的环境,并使其变性、坏死,从而达到治疗肿瘤的目的,被称为绿色治疗方法。传统热疗中所使用的金属热敏剂不具有靶向性,分散组织中会减少其有效浓度,降低治疗效果,并增加对非病变组织的杀伤。Apt-NP 可以特异性地结合EGFR 阳性的U251 肿瘤细胞,增强对其的热疗效率,减少对非病变组织的杀伤,在EGFR 阳性肿瘤的靶向热疗治疗方面有潜在应用价值,有关核酸适配体的优化和此方法的进一步应用有待后续实验进行探索。
[1]Tan Y,Shi YS,Wu XD,et al.DNA aptamers that target human glioblastom multiforme cells overexpressing epidermal growth factor receptor variant Ⅲin virto[J].Acta Pharmacol Sin,2013,34:1491-1498.
[2]Wang DL,Song YL,Zhu Z,et al.Selection of DNA aptamers against epidermal growth factor receptor with high affinity and specificity[J].Biochem Biophys Res Commun,2014,453:681-685.
[3]Cardo-Vila M,Giordano RJ,Sidman RL,et al.From combinatorial peptide selection to drug prototype (Ⅱ):targeting the epidermal growth factor receptor pathway[J].Proc Natl Acad Sci U S A,2010,107:5118-5123.
[4]Motte Rouge T de LA,Galluzzi L,Olaussen KA,et al.A Novel epidermal growth factor receptor inhibitor promotes apoptosis in non-small cell lung cancer cells resistant to erlotinib[J].Cancer Res,2007,67:6253-6262.
[5]Li S,Schmitz KR,Jeffrey PD,et al.Structural basis for inhibition of the epidermal growth factor receptor by cetuximab[J].Cancer Cell,2005,7:301-311.
[6]Kyle F,Spicer J.Targeted therapies in non-small cell lung cancer[J].Cancer Imaging,2008,8:199-205.
[7]Kruser TJ,Wheeler DL.Mechanisms of resistance to HER family targeting antibodies[J].Exp Cell Res,2010,316:1083-1100.
[8]Pao W,Miller VA,Politi KA,et al.Acquired resistance of lung adenocarcinomas to gefitinib or erlotinib is associated with a second mutation in the EGFR kinase domain[J].PLoS Med,2005,2:225-235.
