在CoCl2模拟低氧条件下HIF-1α直接调控PPARγ2的表达
2015-03-16刘晓玲包韩乌云赵华路张俊武
刘晓玲,包韩乌云,赵华路,张俊武
(中国医学科学院基础医学研究所医学分子生物学国家重点实验室,北京100005)
过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)属于核受体超家族,具有4 种不同的剪接体PPARγ1-4,产生两种不同的蛋白。而PPARγ2 具有其独特的第1 个外显子和N 端额外的28 个氨基酸,受独立的启动子调控。近来有很多研究表明PPARγ 在低氧应答中可能也起着重要的作用。然而PPARγ 是如何参与低氧应答迄今尚不明确。
低氧诱导因子(hypoxia-inducible factor,HIF)是细胞在低氧应答反应中最重要的调节因子。HIF-1α/β二聚体结合于其靶基因的低氧应答元件(hypoxiaresponse element,HREs),从而激活它们的转录。HRE 的共有序列为5'-RCGTG-3'[1]。本研究利用CoCl2可以和呼吸链相互作用,增加细胞的氧消耗,从而模拟低氧条件[2],探讨HIF-1α 和PPARγ2 在低氧应答中的关系。
1 材料与方法
1.1 主要试剂
MEM-NEAA 和DMEM 培养基及无支原体胎牛血清(Gibco 公司),RNA 提取试剂盒Trizol 和反转录试剂盒(Invitrogen 公司),实时定量PCR 试剂盒(TaKaRa 公司),双荧光报告系统检测试剂盒(Promega 公司),PPARγ(Sc-7273)、HIF-1α(Sc-53546)和Actin (sc-1616)(Santa Cruz 公司),HIF-1α(ab2185)和IgG(ab2410)(Abcam 公司)。
1.2 细胞培养及低氧诱导
HepG2、MCF-7 和293T/17 细胞均由本室保存。HepG2 细胞系培养于MEM-NEAA 培养基中,MCF-7和293T/17 细胞用DMEM 培养基,每100 mL培养液中加入10 mL 胎牛血清、100 U 青霉素、100 μg 链霉素,置于37 ℃、5% CO2中培养。向处于对数增殖期的细胞中加入终浓度100 μmol/L CoCl2诱导低氧。
1.3 载体构建
以人基因组DNA 为模板扩增PPARγ2 基因-2 927~+91 的DNA 片段,并插入pGL3-promoter质粒得到pGL3-promoter-Wild。以pGL3-promoter-Wild 为基础得到不同HRE 缺失的突变体质粒,即pGL3-promoter-Mut1-4。通过扩增HA-HIF-1α 质粒(韩国釜山国立大学Yunjin Jung 友情赠送[3])得到HIF-1α的cDNA,将其插入pcDNA6V5HisB 质粒(PC)中,得到PC-H。HIF-1α RNAi 的靶序列与Berchner-Pfannschmidt U 等[4]描述的一致,构建入pSilencer 2.1U6 质粒(PS)得到PS-HI。所有质粒均通过测序验证。
1.4 Real time PCR 检测mRNA 的表达
按照说明书,用Trizol 提取总RNA,并用Super-ScriptⅡ反转录试剂盒合成cDNA。用SYBR® Premix Ex TaqTMkit 试剂盒在ABI PRISM 7500 real-time PCR system 完成real time PCR。以β-actin 做为对照。所用引物如下:HIF-1α 上游引物5'-CCATTAGAAAGC AGTTCCGC-3',HIF-1α 下游引物5'-TGGGTAGGAG ATGGAGATGC-3'[5];PPARγ2 上游引物5'-CTATTG ACCCAGAAAGCG-3',PPARγ2 下游引物5'-GAATG TCTTCGTAATGTGGAGA-3';β-actin 上游引物5'-G CAGCTTGTCACAGTGCAGTTC-3',β-actin 下游引物5'-TGGCAAGAAGGTGCT GACTTC-3'。
1.5 双荧光报告系统检测
转染pGL3-promoter-wild/mut1-4 和HIF-1α 入293T/17 细胞,24 h 后收集细胞,按照说明书,用双荧光报告系统检测试剂盒检测。
1.6 Western blot 分析
在4 ℃条件下收集细胞,取少量用BCA 蛋白分析试剂盒测定蛋白浓度。取50~100 μg 全细胞抽提物,加入4 ×SDS 上样缓冲液,混匀后100 ℃变性10 min,行12%聚丙烯酰胺凝胶电泳。经转膜、封闭、加入PPARγ、HIF-1α 或Actin 的一抗,按照说明书使用,4 ℃过夜或室温1~3 h。加HRP 标记的二抗IgG,室温反应1 h,TBS-T 洗10 min ×3 次后,加ECL 显色液进行显色反应。
1.7 染色质免疫共沉淀
100 μmol/L CoCl2诱导HepG2 或MCF 细胞24 h后收获细胞,按照文献[6]的方法,分别用HIF-1α和IgG 与全细胞抽提物作用,得到与HIF-1α 或IgG结合的DNA 作为PCR 模板。扩增PPARγ2 HRE 区的引物为P1 5'-AGGAATAGACACCGAAAG-3'和P2 5'-AA CAGCATGGAATAGGGG-3'。
1.8 统计学分析
2 结果
2.1 CoCl2 模拟低氧促进PPARγ2 表达
随着CoCl2诱导时间的增加,HIF-1α 的mRNA和蛋白的表达均呈现一个先增加后降低的趋势(图1A),PPARγ2 的mRNA 和蛋白的表达明显增加(图1B)。在HepG2 细胞中得到同样的结果。
2.2 HIF-1α 促进PPARγ2 的表达
与空载体PC 相比,转入过表达HIF-1α 质粒PC-H 的HIF-1α 和PPARγ2 的mRNA 表达均增加(P<0.01)(图2A);与空载体PS 相比,转入HIF-1α 的RNAi 抑制质粒PS-H 的HIF-1α 和PPARγ2 的mRNA 表达均降低(P<0.05)(图2B)。
2.3 HIF-1α 通过直接调控的方式调节PPARγ2的表达
通过分析PPARγ2 的上游调控区,发现了4 个潜在的HRE(图3A),构建了包含野生型PPARγ2的上游调控区及报告基因的质粒,与HIF-1α 的过表达质粒PC-H 以不同比例共转染入HepG2 细胞,发现HIF-1α 对PPARγ2 的调控呈现剂量依赖性(图3B)。100 μmol/L CoCl2诱导下检测野生型(pGL3-promoter-Wild)或缺失某个HRE(pGL3-promoter-Mut)的PPARγ2 上游调控区报告基因的活性,与其他突变体及野生型相比pGL3-promoter-Mut1 的荧光素酶活性明显降低(P<0.01)(图3C)。当过表达HIF-1α 时,与野生型相比,Mut1 的荧光素酶活性明显降低(P<0.01)(图3D)。
用已知的EPO 3'调控区中HRE 位点作为阳性对照,已经证明的无关序列作为阴性对照,做ChIP验证。用100 μmol/L CoCl2培养24 h 后的HepG2细胞裂解液做ChIP 分析,扩增含HRE1 的PPARγ2启动子区,加入HIF-1α 抗体作用后的PCR 产物量明显高于加入IgG 的作用产物(图4A),即HIF-1α直接结合于PPARγ2 的HRE1。当未诱导的MCF-7 的全细胞提取液用HIF-1α 抗体处理后(NHIF-1α),ChIP 结果表明,在未诱导条件下,HIF-1α 不与PPARγ2 的第1 个HRE 相作用,同时在诱导后的MCF-7 中可检测到HIF-1α 与PPARγ2 的HRE1 相结合(图4B)。所有PCR 产物均通过测序验证。

图1 CoCl2 模拟低氧条件下PPARγ2 的表达变化Fig 1 Change of PPARγ2 expression in mimic hypoxia by CoCl2

图2 HIF-1α 调控PPARγ2 的表达Fig 2 HIF-1α modulates the expression of PPARγ2

图3 鉴定PPARγ2 的HIF-1α 结合位点Fig 3 Identification and validation of HIF-1α binding sites at the PPARγ2 promoter
3 讨论
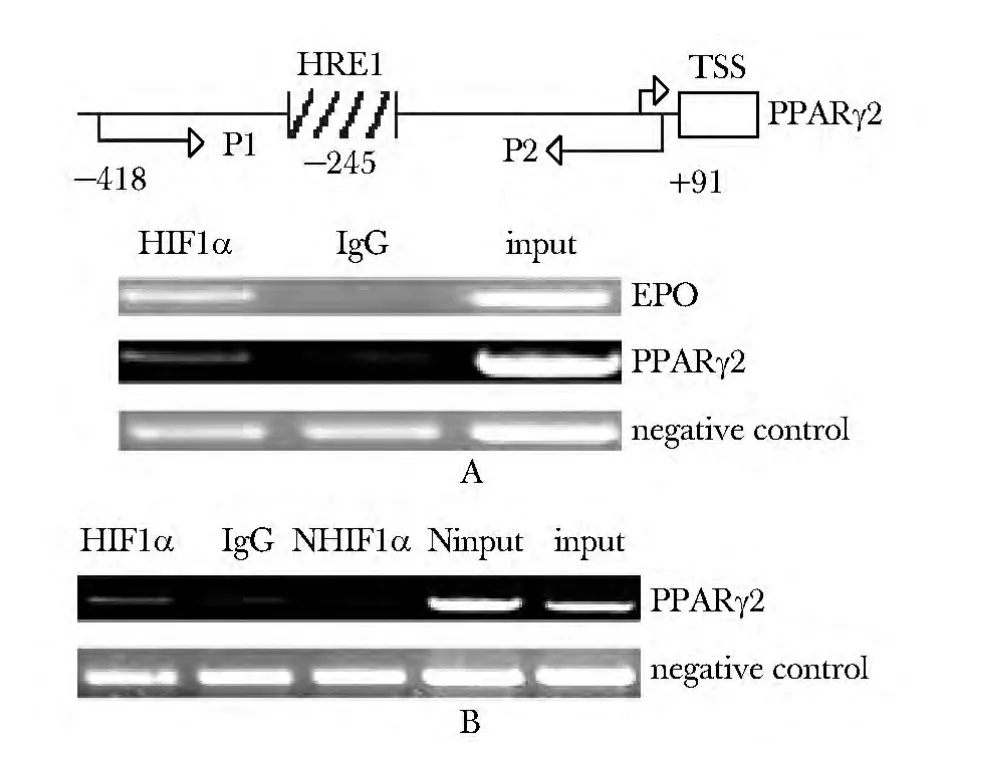
图4 在CoCl2 模拟低氧条件下ChIP 验证HIF-1α直接结合于PPARγ2 上游调控区Fig 4 ChIP assay performed to evaluate in vivo HIF-1α binding at the PPARγ2 5'-flank in mimic hypoxia by CoCl2
在肿瘤发展中,肿瘤细胞的快速扩增将导致肿瘤细胞微环境呈现一个持续的相对低氧状态。而这种低氧的微环境又促进了肿瘤细胞的恶性扩增。PPARγ 在癌细胞中通常呈现高表达,但很少有报道PPARγ 是如何被激活的。HIF-1α 对于大多数肿瘤细胞的生物学特质的形成非常重要。故推测PPARγ 在肿瘤细胞中的高表达是受HIF-1α 调控的。
本研究证明,在100 μmol/L CoCl2模拟低氧的条件下,PPARγ2 在两种肿瘤细胞MCF-7 和HepG2中是低氧诱导表达的,并且证明HIF-1α 正调控PPARγ2 表达。并通过双荧光报告基因及ChIP 实验证明HIF-1α 在模拟低氧条件下结合PPARγ2 的HRE1。总之,本实验结果证明PPARγ2 是HIF-1α的靶基因。这就很好的验证了最初的推测,并可以解释为什么在肿瘤细胞中可以检测到高表达的PPARγ。
然而有报道称HIF-1α 是通过上调DEC1/Stra13 的表达,进而抑制PPARγ2 的表达,但这是在3T3 细胞(小鼠的脂肪)中得到的结论[7]。而本研究结果是在MCF-7(人乳腺癌细胞系)和HepG2(人肝癌细胞系)中得到的。也许是细胞类型的不同导致PPARγ2 受调控的机制不同。在MCF-7 和HepG2 细胞系中,检测到DEC1/Stra13 也是随着低氧诱导时间的增加而增加,和HIF-1α 呈现相同的趋势(数据未显示)。所以本研究提示,在MCF-7 细胞和HepG2 细胞中即使存在DEC1/Stra13 对PPARγ2 的负调节,这种作用比起HIF-1α 对PPARγ2 的正调控也是一种次要途径。也许这是因为这两种调控的同时存在,PPARγ2 才得以维持在一个合适的水平,而这种合适的水平可能对于细胞的低氧适应是非常重要的。
低氧可以促进肿瘤细胞发生一系列的保护性改变[8]。如HIF1 诱导血管生成和影响细胞代谢以帮助肿瘤细胞快速增殖[9]。现已证实PPARγ 的激动剂可以抑制绒癌细胞系JEG3 的增殖和侵袭能力[10]。通过PPARγ 激动剂封闭HIF-1α 的功能是一种新的重要发现,提示未来可以利用这些复合物来抑制肿瘤生长[11-12]。故PPARγ 的激活可能是对于HIF-1α 引起损害的一种负反馈。阐明PPARγ 的激活与HIF-1α 的关系可能对于肿瘤的治疗提供新的线索。
[1]Semenza GL,Jiang BH,Leung SW,et al.Hypoxia response elements in the aldolase A,enolase 1,and lactate dehydrogenase A gene promoters contain essential binding sites for hypoxia-inducible factor 1[J].J Biol Chem,1996,271:32529-32537.
[2]Bunn HF,Poyton RO.Oxygen sensing and molecular adaptation to hypoxia[J].Physiol Rev,1996,76:839-885.
[3]Simonides WS,Mulcahey MA,Redout EM,et al.Hypoxia-inducible factor induces local thyroid hormone inactivation during hypoxic-ischemic disease in rats[J].J Clin Invest,2008,118:975-983.
[4]Berchner-Pfannschmidt U,Petrat F,Doege K,et al.Chelation of cellular calcium modulates hypoxia-inducible gene expression through activation of hypoxia-inducible factor-1alpha[J].J Biol Chem,2004,279:44976-44986.
[5]Hanze J,Eul BG,Savai R,et al.RNA interference for HIF-1alpha inhibits its downstream signalling and affects cellular proliferation[J].Biochem Biophys Res Commun,2003,312:571-577.
[6]Jung K,Kang M,Park C,et al.Protective role of V-set and immunoglobulin domain-containing 4 expressed on kupffer cells during immune-mediated liver injury by inducing tolerance of liver T-and natural killer T-cells[J].Hepatology,2012,56:1838-1848.
[7]Yun Z,Maecker HL,Johnson RS,et al.Inhibition of PPAR gamma 2 gene expression by the HIF-1-regulated gene DEC1/Stra13:a mechanism for regulation of adipogenesis by hypoxia[J].Dev Cell,2002,2:331-341.
[8]史雨晨,刘翠英,李俊发.缺血/低氧相关疾病微小RNA-210 的研究进展[J].基础医学与临床,2013,33:227-230.
[9]Wang WM,Zhao ZL,Ma SR,et al.Epidermal growth factor receptor inhibition reduces angiogenesis via hypoxia-inducible factor-1α and notch1 in head neck squamous cell carcinoma[J].PLoS One,2015,10:e0119723.doi:10.1371/journal.pone.0119723.
[10]丁峰,崔新红,钮彬,等.PPAR-γ 配体对绒癌细胞系JEG-3 体外增殖、分泌和侵袭能力的影响[J].基础医学与临床,2014,34:1344-1347.
[11]von Schwarzenberg K,Held SA,Schaub A,et al.Proteasome inhibition overcomes the resistance of renal cell carcinoma cells against the PPARgamma ligand troglitazone[J].Cell Mol Life Sci,2009,66:1295-1308.
[12]Joshi H,Pal T,Ramaa CS.A new dawn for the use of thiazolidinediones in cancer therapy[J].Expert Opin Investig Drugs,2014,23:501-510.
