沙利度胺对肠道血管畸形出血患者的干预作用
2015-03-16黎可京邱小蕾
黎可京,邱小蕾
(广东省佛山市第一人民医院特需医疗中心 528000)
·论 著·
沙利度胺对肠道血管畸形出血患者的干预作用
黎可京,邱小蕾
(广东省佛山市第一人民医院特需医疗中心 528000)
目的 探讨沙利度胺对肠道血管畸形出血的干预作用。方法 选取该院2010年1月至2012年12月的肠道血管畸形患者84例,按照随机数表法分为对照组和沙利度胺组。对照组36例,给予一般性输液,补充电解质;沙利度胺组38例,给予沙利度胺,100 mg/d口服,连续4个月。观察2组患者治疗前1年以及治疗1年后患者临床疗效评分、输血量、血红蛋白、血管内皮生长因子(VEGF)、肿瘤坏死因子-α(TNF-α)、血管生成素-2(Ang-2)、低氧诱导因子-1(HIF-1)水平的变化。结果 沙利度胺组患者治疗前头晕乏力情况及其持续时间、平均出血次数及其持续时间评分分别为(3.14±0.37)分、(2.99±0.41)分、(5.90±0.83)分、(3.10±0.90)分,治疗后为(0.71±0.42)分、(0.68±0.86)分、(2.02±0.79)分、(0.03±0.81)分,差异均有统计学意义(P<0.05)。治疗前后输血量显著减少[(139.22±153.60) pg/mL,(113.00±161.26) pg/mL,P<0.05],血红蛋白含量明显升高[(51.20±18.36) pg/mL,(90.09±21.63) pg/mL,P<0.05]。服药前血清VEGF、TNF-α、HIF-I、Ang-2分别为(1.99±0.41)pg/mL、(2.10±0.90)pg/mL、(105.67±15.47)ng/mL、(616.70±93.72)ng/mL,治疗后为(0.68±0.86)pg/mL、(1.03±0.81)pg/mL、(63.01±21.28)ng/mL、(233.75±54.90)ng/mL,差异有统计学意义(P<0.05)。对照组患者临床症状治疗前后差异无统计学意义(P>0.05)。治疗前沙利度胺组各项评分与对照组比较,差异无统计学意义(P>0.05),治疗后2组比较差异有统计学意义(P<0.05)。结论 沙利度胺能明显抑制肠道血管畸形出血,疗效显著。
沙利度胺; 肠道血管畸形出血; 干预
肠道血管畸形是胃肠道比较常见的异常血管病变之一,该病变是导致消化道出血的主要原因[1-2]。肠道血管畸形病变一般为多发,可累及整个消化道,容易反复出血,而目前无特效药物治疗[3-4]。沙利度胺曾作为镇静止吐药上市,后因发现其对胎儿致畸而停止使用[5]。近几年来,沙利度胺被发现对血管生成产生抑制作用,逐渐用于肠道血管畸形出血的治疗[6-8]。本研究通过对比沙利度胺治疗前后血管畸形患者,以及与常规治疗的血管畸形出血患者的临床疗效和血清指标的差异,探讨沙利度胺对肠道血管畸形出血的干预作用。报道如下。
1 资料与方法
1.1 一般资料 选取该院2010年1月至2012年12月经胶囊内镜或小肠镜确诊为肠道血管畸形的出血患者84例,按照随机数表法分为对照组和沙利度胺组。对照组患者36例,男17例,女19例,平均年龄(42.21±12.50)岁。病变位于小肠20例,结肠4例,空肠结肠5例。沙利度胺组患者38例,男18例,女20例,平均年龄(43.75±9.67)岁。病变位于小肠21例,结肠3例,同时有7例病变,具有多发性病灶的共有7例位于空肠结肠。纳入标准:内镜下观察,出现局部性或弥漫性的静脉或者毛细血管病变,具体表现为红色扩张血管、搏动性的隆起同时伴有周围静脉扩张以及片状红斑等症状,临床表现为肠道出血、呕血、黑便,甚至两者兼有,严重者出现失血性休克。排除标准:肝、肾功能严重不全;有充血性心脏病史;心肌缺血病史;未控制的原发性高血压;处于育龄期或哺乳期的女性;准备生育者或孕妇;沙利度胺药物过敏者;肝硬化静脉曲张、恶性肿瘤或器官功能严重障碍。2组患者的例数、性别、平均年龄、平均出血时间、平均出血次数等一般病例资料比较,差异无统计学意义(P>0.05),具有可比性。本研究所有入选患者均签署知情同意书。
1.2 方法
1.2.1 治疗方法 对照组患者给予一般性的输液治疗以维持电解质平衡;沙利度胺组患者口服沙利度胺片,25 毫克/次,4次/天,连续治疗4个月。观察患者头晕、乏力等症状及持续时间,并作记录。沙利度胺治疗期间以及治疗后,每2周对患者出血情况进行检查。观察患者服药后有无外周神经炎、深静脉血栓栓塞、嗜睡、皮肤干燥、水肿、便秘等不良反应。
1.2.2 标本收集 患者服用沙利度胺前抽取空腹外周静脉血3 mL,停用沙利度胺1周内再抽取空腹外周静脉血3 mL,室温放置30 min或4 ℃过夜后,1 000 r/min离心20 min,吸取上层血清进行分装,于-70 ℃保存备用。避免血清标本反复冻融,且保存时间不超过4个月。
1.2.3 疗效标准 服用沙利度胺前1年和服用沙利度胺后随访1年(其中包括治疗期间的4个月)的临床症状评分标准,包括头晕乏力及其持续时间、每年平均出血次数及持续时间等。采用ELASA法检测血清血管内皮生长因子(VEGF)、肿瘤坏死因子-α(TNF-α)、血管生长素-2(Ang-2)、低氧诱导因子-1(HIF-1)。见表1。

2 结 果
2.1 2组患者临床疗效结果比较 治疗后沙利度胺组患者的临床症状比治疗前1年内明显改善,差异均有统计学意义(P<0.05)。对照组患者临床症状治疗前后差异无统计学意义(P>0.05)。治疗前沙利度胺组各项评分与对照组比较,差异无统计学意义(P>0.05),治疗后2组比较差异有统计学意义(P<0.05)。见表2。
2.2 2组患者输血量和血红蛋白结果比较 随访期间,对照组患者输血量与治疗前1年内输血量比较,差异无统计学意义(P>0.05),血红蛋白含量与治疗前略有上升,但差异无统计学意义(P>0.05)。沙利度胺组患者输血量比治疗前显著减少(P<0.05),血红蛋白含量比治疗前显著上升,差异均有统计学意义(P<0.05)。沙利度胺组治疗前的输血量、血红蛋白与对照组比较,差异无统计学意义(P>0.05),而治疗后2组比较,差异有统计学意义(P<0.05)。见表3。
2.3 2组患者血清VEGF、TNF-α、HIF-1、Ang-2结果比较 沙利度胺组患者服药后VEGF、TNF-α、HIF-I、Ang-2与服药前比较,差异均有统计学意义(P<0.05)。对照组患者治疗前后比较,差异无统计学意义(P>0.05)。服药前2组患者各指标差异无统计学意义(P>0.05);服药后2组差异有统计学意义(P<0.05)。见表4。
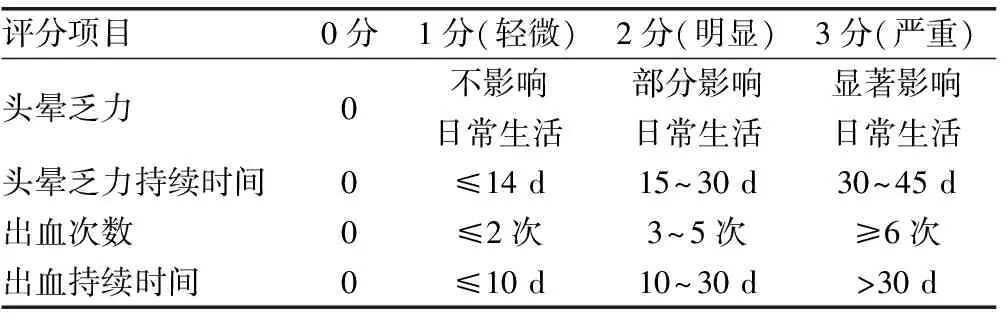
表1 临床疗效评分标准
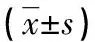
表2 2组患者治疗前后临床症状评分结果比较
注:与对照组比较,#P<0.05;与沙利度胺组比较,*P<0.05。
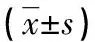
表3 2组患者治疗前后平均出血次数、输血量和血红蛋白结果比较
注:与对照组比较,#P<0.05;与沙利度胺组比较,*P<0.05。
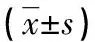
表4 2组患者治疗前后血清VEGF、TNF-α、HIF-1、Ang-2结果比较
注:与对照组比较,#P<0.05;与沙利度胺组比较,*P<0.05。
3 讨 论
肠道血管畸形出血的组织学表现为在黏膜层或其下方组织内管腔呈鲜红色扩张、管壁厚薄不同、变形血管增粗或曲折[4,9]。目前国内治疗该病的特效药物尚未上市,而常规对症处理只能缓解不能根除。由于其具有多发性,使局部治疗难以达到止血和根治的目的,使治疗过程中患者痛苦和创伤性增加,且容易复发。近年来,随着胶囊内镜或者小肠镜的普遍应用,肠道血管畸形出血的检出率越来越高,而且血管畸形病变部位多发者比例也越来越高,阻碍了局部治疗的效果。
有研究发现,沙利度胺在治疗多发性骨髓瘤、麻风结节性红斑、人类免疫缺陷病毒(HIV)、HIV口疮性口炎等多种疾病上发挥着有效作用[10-12]。近年来又表明,沙利度胺在血管生成中起抑制作用,机体免疫应答受抑制,抑制局部炎性反应发生,因此在血管发育不良导致的肠道血管畸形出血中发挥一定的疗效[13-14]:其通过抑制VEGF表达抑制血管生成,VEGF在血管内皮细胞的有丝分裂中发挥重要作用,在血管壁中高表达,能够促进血管生长,增加血管通透性,刺激血管内皮细胞增殖。VEGF作为特异血管生成刺激因子,在生理性和病理性血管生成过程中发挥作用。较多因素可调节VEGF表达,如低氧诱导因子-1(HIF-1)可促进VEGF转录,稳定VEGF mRNA活性,降低HIF-1活力,抑制血管生成及血管成熟。血管生成素-2(Ang-2)与血管生成关系密切,可加强VEGF促进血管生成。目前研究显示,Ang-2的特异性调控因素包括体液因素(如血管紧张素Ⅱ、转录因子、凝血酶)及环境因素等。
本研究结果表明,治疗1年后沙利度胺组患者临床症状比治疗前1年内明显改善,包括头晕乏力及其持续时间、平均出血次数及其持续时间,差异均有统计学意义(P<0.05),对照组患者各指标在治疗前后均无统计学意义(P>0.05)。沙利度胺组患者治疗前的各项评分与对照组比较,差异无统计学意义(P>0.05),而治疗后比较差异有统计学意义(P<0.05)。治疗1年后,沙利度胺组患者输血量显著减少,血红蛋白含量明显升高,与治疗前1年内的相应指标比较,差异均有统计学意义(P<0.05)。提示沙利度胺对肠道血管畸形出血具有一定的治疗作用,可以减少出血次数和出血量。
本研究结果显示,沙利度胺组患者治疗后VEGF及TNF-α水平较治疗前明显下降(P<0.05),HIF-1、Ang-2表达量较治疗前明显降低,差异均有统计学意义(P<0.05)。服药后HIF-1、Ang-2表达降低,VEGF、TNF-α生成和表达受抑制,血管生成以及成熟作用被抑制,肠道血管畸形出血症状缓解。
沙利度胺半衰期较短,大约为5 h,每天分为4次服用100 mg沙利度胺,可以使患者体内维持较为稳定的血药浓度[15]。服药后患者便秘9例(其中8例为原有便秘者)、四肢浮肿2例、轻度嗜睡3例、手脚麻木1例(随服药时间延长逐渐减轻直至消失)、皮肤干燥4例。所有不良反应均不严重,为轻至中度,并在停药后1周内缓解或消失。未发现严重不良反应(如外周神经炎、深静脉血栓等)。本组结果表明沙利度胺不良反应较轻,安全性较高,具有一定临床价值。
[1]谭红红,戈之铮,高云杰,等.肠道血管畸形出血患者低氧诱导因子-1和血管生成素-2表达及沙利度胺的干预研究[J].中华消化杂志,2011,31(3):160-163.
[2]季峰,陈小丽,李霖,等.老年患者结肠血管畸形急性出血的临床特点及内镜治疗[J].中华消化杂志,2010,30(7):448-451.
[3]张开光,王巧民,郑帮海,等.肠血管畸形合并出血的内镜下治疗疗效的随访研究[J].中华消化杂志,2013,33(7):483-486.
[4]赵洪川.胃肠道血管畸形[J].中华内科杂志,2012,51(3):250-251.
[5]Singhal S,Mehta J,Desikan R.Antitumor activity of thalidomide in refractory multiple myeloma[J].N Engl J Med,1999,341(21):1565-1571.
[6]冯倩,谭红红,戈之铮,等.胃肠道血管畸形的发病机制及沙利度胺对其治疗作用的机制[J].中华内科杂志,2012,51(5):385-389.
[7]Christina T,Lynda E,Erin R,et al.Thalidomide induces limb defects by preventing angiogenic outgrowth during early limb formation[J].Pro-ceedings of the National Academy of Sciences of the United States of America,2009,106(21):8573-8578.
[8]Luzzio FA,Mayorov AV,Ng SS.Thalidomide metabolites and analogues.Synthesis and antiangiogenic activity of the teratogenic and TNFalpha-modulatory thalidomide analogue 2-(2,6-dioxopiperidine-3-yl) phthalimidine[J].Expert Opinion on Investigati-onal Drugs,2003,12(9):1211-1225.
[9]Stephen Y.GI-associated hemanglomas and vascular malformations[J].Clin Colon Rectal Surg,2011,24(3):193-194.
[10]吴文强.沙利度胺联合环孢素A治疗骨髓增生异常综合征临床分析[J].检验医学与临床,2012,9(15):1905-1906.
[11]周宏,黄发英.沙利度胺治疗复发性口腔溃疡的临床疗效观察[J].西部医学,2011,23(8):1534-1535.
[12]陈世明,汪玉芳.沙利度胺联合VAD方案治疗多发性骨髓瘤的疗效观察[J].西部医学,2011,23(11):2132-2133.
[13]Tan H,Chen H,Xu C.et al.Role of vascular endothelial growth factor in angiod-ysplasia:an interventional study with thalidomide[J].J Gastroenterol Hepatol,2012,27(6):1094-1101.
[14]Ge ZZ,Chen HM,Gao YJ.et al.Efficacy of thalidomide for refractory gastrointe stinal bleeding from vascular malformation[J].Gastroenterology,2011,141(5):1629-1937.
[15]Pinter M,Wichlas M,Schmid K.Thalidomide in advanced hepatocellular carcinoma as antiangiogenic treatment approach:a phaseⅠ/Ⅱtrial[J].Eur J Gastroenterol Hepatol,2008,20(6):1012-1019.
The intervention effect of thalidomide on patients with intestinal vascular malformation hemorrhage
LIKe-jing,QIUXiao-lei
(SpecialMedicalServiceCenter,FoshanMunicipalFirstPeople′sHospital,Foshan,Guangdong528000,China)
Objective To observe the intervention effect of thalidomide on patients with intestinal vascular malformation hemorrhage.Methods According to the random indicator method,84 cases of patients with intestinal vascular malformation were divided into control group and thalidomide groups from January,2010 to December,2010 in our hospital.36 cases patients of control group were not treated with thalidomide but with general infusion,while 38 cases patients of thalidomide group were treated with thalidomide,100 mg per day by oral,for four months.The changes of clinical efficacy score,blood transfusion amount,quantity of hemoglobin,VEGF,TNF-a,Ang-2,HIF-1 level in serum were detected between the pre-therapy and post-therapy.Results The scores of dizziness anaemic condition and its duration,the average number of bleeding and its duration pre-therapy were (3.14±0.37),(2.99±0.41),(5.90±0.83),(3.10±0.90)scores.The scores post-therapy were (0.71±0.42),(0.68±0.86),(2.02±0.79),(0.03±0.81)scores,the differences were statistically significant (P<0.05).The amount of blood transfusion of thalidomide group post-therapy were decreased than those pre-therapy[(139.22±153.60) pg/mL,(113.00±161.26) pg/mL,P<0.05].The quantity of hemoglo-bin of thalidomide group post-therapy were increased than those pre-therapy[(51.20±18.36) pg/mL,(90.09±21.63) pg/mL,P<0.05].Serum concertration of VEGF,TNF-a,HIF-I,Ang-2 in thalidomide groups post-therapy[(0.68±0.86)pg/mL,(1.03±0.81) pg/mL,(63.01±21.28)ng/mL,(233.75±54.90)ng/mL] were decreased than those pre-therapy[(1.99±0.41)pg/mL,(2.10±0.90)pg/mL,(105.67±15.47)ng/mL,(616.70±93.72)ng/mL].Conclusion Thalidomide can obviously inhibit the intestinal vascular malfor-mation hemorrhage.
thalidomide; intestinal vascular malformation hemorrhage; intervention
黎可京,男,本科,主治医师,主要从事消化内科研究。
10.3969/j.issn.1672-9455.2015.12.034
A
1672-9455(2015)12-1745-03
2014-12-10
2015-02-12)
