枯草菌脂肽钠/丝素蛋白复合水凝胶的研究
2015-03-16李姣姣张珊珊张书洲卢神州
朱 天,张 芳,李姣姣,张珊珊,张书洲,卢神州*
(1苏州大学纺织与服装工程学院,江苏 苏州 215021;2苏州丝瑞宝生物科技有限公司,江苏 苏州 215122)
枯草菌脂肽钠/丝素蛋白复合水凝胶的研究
朱 天1,张 芳1,李姣姣1,张珊珊1,张书洲2,卢神州1*
(1苏州大学纺织与服装工程学院,江苏 苏州 215021;2苏州丝瑞宝生物科技有限公司,江苏 苏州 215122)
为满足水凝胶材料在生物医学领域的应用要求,需要制备一种凝胶时间较短、孔径较大且孔隙率高、生物相容性好的水凝胶材料。采用枯草菌脂肽钠诱导丝素蛋白溶液形成水凝胶,探讨不同浓度枯草菌脂肽钠对形成凝胶时间的影响,并采用SEM观察水凝胶内部形貌、FTIR、XRD表征水凝胶聚集态结构,通过在水凝胶表面培养成纤维细胞评价其生物相容性。结果表明,在一定范围内,水凝胶的胶凝时间与枯草菌脂肽钠浓度成反比,水凝胶中孔径较大且孔隙率高,在凝胶上L929成纤维细胞呈对数稳定增长,生物相容性良好。该丝素蛋白复合水凝胶在组织修复、创伤治愈等生物医学领域具有较大潜力。
水凝胶;丝素蛋白;枯草菌脂肽钠;生物相容性
水凝胶是一种以水为分散介质的三维网络大分子材料,不溶不熔,在其中包裹着大量的水分[1]。三维多孔网络结构使小分子物质能够在这些框架空隙中扩散、迁移。它可以看成是聚合物的浓溶液,又可以认为是高弹性的固体,有一定强度可以保持形态且柔软有弹性[2],其应用涉及到生物医药、组织工程等领域。丝素蛋白是一种纤维状蛋白,以其良好的热稳定性、优异的机械性能和生物相容性等优点在组织工程、创伤治愈和细胞增殖等领域备受关注。丝素蛋白水凝胶,作为一种天然高分子材料构成的三维网络结构水凝胶,以良好的生物相容性、大量水含量和高度交联的空间网络结构、独特的理化性质及对细胞和小分子的透过性和扩散性[3],使其在组织工程、创伤治愈和细胞增殖等领域具有广阔的应用前景[4]。纯丝素蛋白形成凝胶时间较长,且凝胶强度弱弹性差,一般通过物理、化学等方法促进凝胶形成。而通过化学交联剂形成的水凝胶可能具有毒性,细胞相容性较差。所以通过物理交联制备一种胶凝时间短、孔径较大且孔隙率高、细胞相容性良好的丝素蛋白水凝胶材料对于生物医学领域具有重大意义[5]。
脂肽类表面活性剂是由微生物代谢产生的一类具有强表面活性的生物表面活性剂。基于其良好的生物相容性,它们在医药、化妆品、环境保护和微生物采油等方面有良好的应用潜力[6]。枯草菌脂肽更是其中的佼佼者,它是由枯草芽孢杆菌株产生的脂肽类表面活性剂[7],呈晶状,有潜力作为抗肿瘤,抗病毒和抗支原体剂[8]。本文采用枯草菌脂肽钠诱导丝素蛋白快速凝胶化。其与丝素蛋白溶液混合后,短时间内可获得内部孔径较大、细胞相容性较好的丝素蛋白水凝胶,为生物医用领域提供一种新型水凝胶材料。
1 材料与方法
1.1 主要材料与试剂
家蚕生丝(苏州先蚕丝绸生物科技有限公司),枯草菌脂肽钠(安徽帝元生物科技有限公司),溴化锂(天成化工有限公司),无水碳酸钠、碳酸氢钠(国药集团化学试剂有限公司),小鼠成纤维细胞系L929细胞(苏州大学医学院),小牛血清,RPMI-1640培养基(Wisent公司,加拿大),阿尔玛蓝(sigma公司,美国),透析袋(上海普宜生物技术有限公司,截留分子量8~10 kD),实验室用水均为去离子水。
1.2 丝素蛋白溶液制备
称取80 g家蚕生丝,放入4 000 mL质量浓度为1 g/L的碳酸钠—碳酸氢钠缓冲溶液中微沸30 min,取出蚕丝并用去离子水反复搓洗干净,重复上述试验两次,将生丝表面的丝胶脱洗干净。将脱胶后的丝素置于烘箱中在60 ℃的条件下烘干,即得干的纯丝素纤维。将纯丝素纤维在65±2 ℃下溶解于浓度为9.3 mol/L的溴化锂溶液中,浴比为1:10,溶解时间约40 min。完全溶解并冷却后将溶液装入透析袋中,置于去离子水中,每隔两小时换一次水,透析3~4 d即得纯丝素溶液,放在4 ℃冰箱备用[9-10]。
1.3 水凝胶的制备
配制50 g/L的枯草菌脂肽钠水溶液备用。将枯草菌脂肽钠与丝素蛋白溶液以不同浓度混合,控制丝素蛋白溶液终质量浓度为50 g/L,枯草菌脂肽钠终质量浓度分别为0 g/L、0.1 g/L、0.6 g/L、1 g/L、2 g/L、3 g/L。在离心管中充分混合后,放置于37 ℃的恒温培养箱中,充分反应形成具有一定力学强度和弹性的复合水凝胶。
1.4 表面张力测试
利用DataPhysics DCAT-21型表面张力仪,检测37℃下不同浓度枯草菌脂肽钠水溶液的表面张力(Surface Tension) ,采集数据并作出表面张力与表面活性剂浓度之间的关系曲线。
1.5 凝胶时间的测定
将丝素蛋白溶液与枯草菌脂肽钠溶液按比例充分混合后,迅速取300 uL置于24孔板中,每组6个平行样,放入Synergy HT 型多功能酶标仪中,选取Kinetics程序,在37 ℃下每分钟测定对应样品在550 nm下的吸光度(OD)值,用此来表征对应样品的凝胶时间[11]。
1.6 水凝胶的形貌观察
选取枯草菌脂肽钠终质量浓度为2 g/L,丝素蛋白终质量浓度为30 g/L,制备枯草菌脂肽钠/丝素共混水凝胶样品。待凝胶稳定后放入液氮中速冻,真空干燥后用切片器切取一定体积的冻干凝胶样品,表面喷金90 s后取出,采用日本Hitachi S-4800型扫描电子显微镜观察凝胶的表面和截面形貌[12]。
1.7 水凝胶的结构表征
将上述冻干的凝胶样品研磨加工成直径小于80 μm的粉末后,采用KBr压片法制样,在傅立叶变换红外光谱仪上进行测试,扫描400~4 000 cm-1范围内的吸光度,得到红外吸收光谱[13];X-射线衍射测试,扫描速度为8°/min,扫描2θ = 5°~45°,得到样品的广角X射线衍射(WAXD)图谱。
1.8 细胞相容性测试
实验准备:对丝素蛋白溶液、一定浓度的枯草菌脂肽钠水溶液和去离子水进行高压灭菌处理,之后所有实验均在无菌超净台内进行。采用传代后48~72 h生长旺盛的L929成纤维细胞[14-15]。体积分数为89% DMEM培养液,10%胎牛血清和1%抗生素(双抗)。在96孔板中制备水凝胶,其中枯草菌脂肽钠的浓度分别为0 g/L(即纯丝素凝胶)、2 g/L,丝素蛋白浓度分别为30 g/L、40 g/L、50 g/L,每个样品6孔。用DMEM配制1×10-4个/mL L929细胞悬液,待水凝胶稳定成型2 h后,每孔加入80μL细胞悬液,再加入120μL培养液,在体积分数为5%的二氧化碳/空气,温度为37 ℃的恒温培养箱中培养9 d,隔两天加换新鲜培养液200 μL。
细胞增殖活力的测定[16-17]:配制50 μmol/L的阿尔玛蓝溶液,与培养液1:10配制成阿尔玛蓝染色培养液。96孔板每孔加入200 μL,继续在相同条件下培养6 h后,取出100μL在酶标仪上测其荧光值强度,来表征细胞活性,激发波长530 nm,发射波长590 nm。
2 结果与讨论
2.1 表面张力的变化
如图1所示枯草菌脂肽钠水溶液的表面张力随其浓度的变化情况,可知枯草菌脂肽钠水溶液的表面张力有明显拐点,且在临界胶束浓度(CMC)约为9×10-5mol/L ,即0.13 g/L时达到表面张力最低值为28.97 mN/m。这说明枯草菌脂肽钠能明显地降低水溶液中的表面张力,可在短时间内诱导丝素蛋白形成水凝胶。当所选取的表面活性剂有明显最低点时,其诱导丝素形成凝胶所需时间也最短[18]。
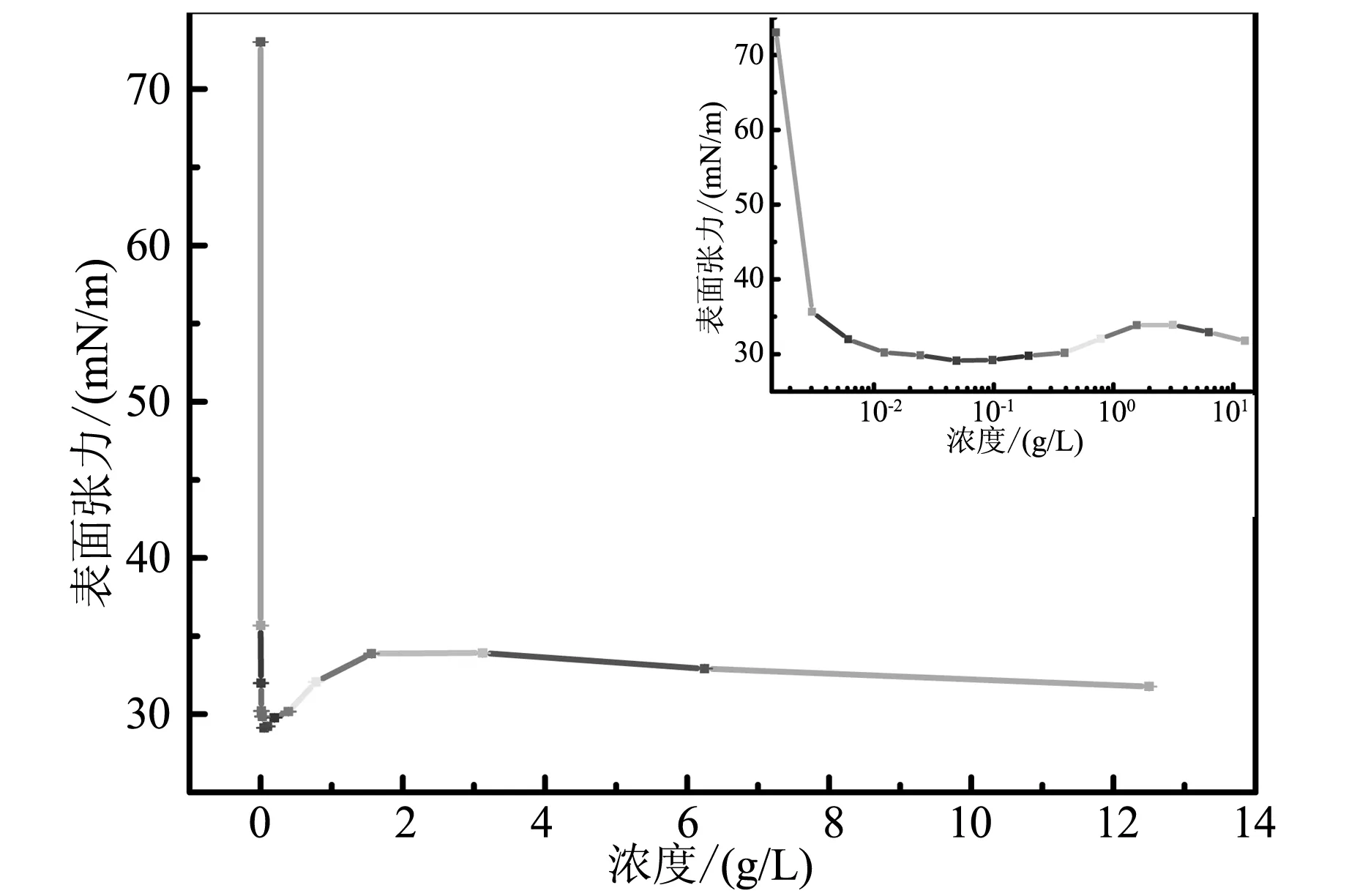
图1 37 ℃下枯草菌脂肽钠水溶液的表面张力随其浓度的变化曲线
2.2 诱导丝素凝胶化时间
在37 ℃下,不同浓度的枯草菌脂肽钠与丝素溶液混合后,其吸光度(OD)值随时间的变化如图2所示。枯草菌脂肽钠浓度为0.6 g/L时即可诱导丝素蛋白形成水凝胶,但需时较长,约9 h;而当枯草菌脂肽钠增大至1 g/L以上时,形成水凝胶所需时间在2 h以内。这可能是随着丝素蛋白溶液中枯草菌脂肽钠浓度的增加,包裹在丝素蛋白周围的表面活性剂不断降低丝素蛋白分子间摩擦力,使丝素蛋白分子运动速度加快,碰撞几率增大,大大缩短凝胶时间。图2中曲线均在出现大幅增大后趋向稳定,说明溶液向凝胶转变的过程如下:枯草菌脂肽钠与丝素溶液混合在开始阶段处于溶液状态,OD值较小;当OD值增大,浑浊度增加时表明凝胶开始形成;当OD值达到平衡时,说明凝胶过程已完成。
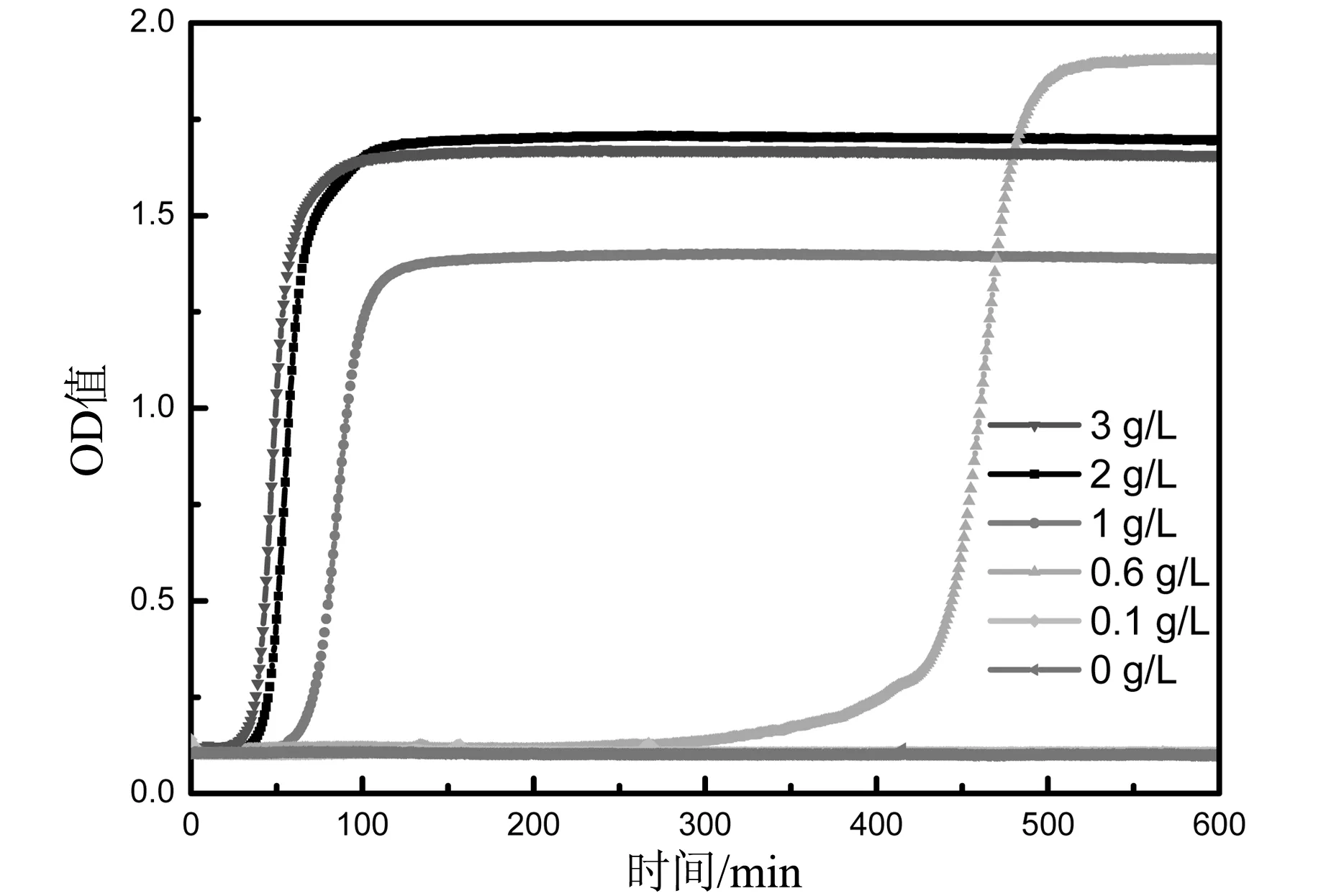
图2 37 ℃不同枯草菌酯肽钠浓度下丝素溶液的吸光度随时间的变化曲线
图2 37 ℃不同枯草菌脂肽钠浓度下,丝素溶液的吸光度随时间的变化曲线
2.3 凝胶的形貌观察
图3分别为纯丝素凝胶截面形貌(A)和枯草菌脂肽钠/丝素共混凝胶的截面形貌(B)。(B)图中共混水凝胶的截面层次清晰,孔径结构大致均匀,范围在10~50 μm。与纯丝素凝胶(A)相比,具有很多丝状纤维,孔径较大,且孔之间相互贯通,使枯草菌脂肽钠/丝素共混凝胶水凝胶内部水分和营养物质传输更快,同时为细胞生长提供足够的空间和适宜的环境。
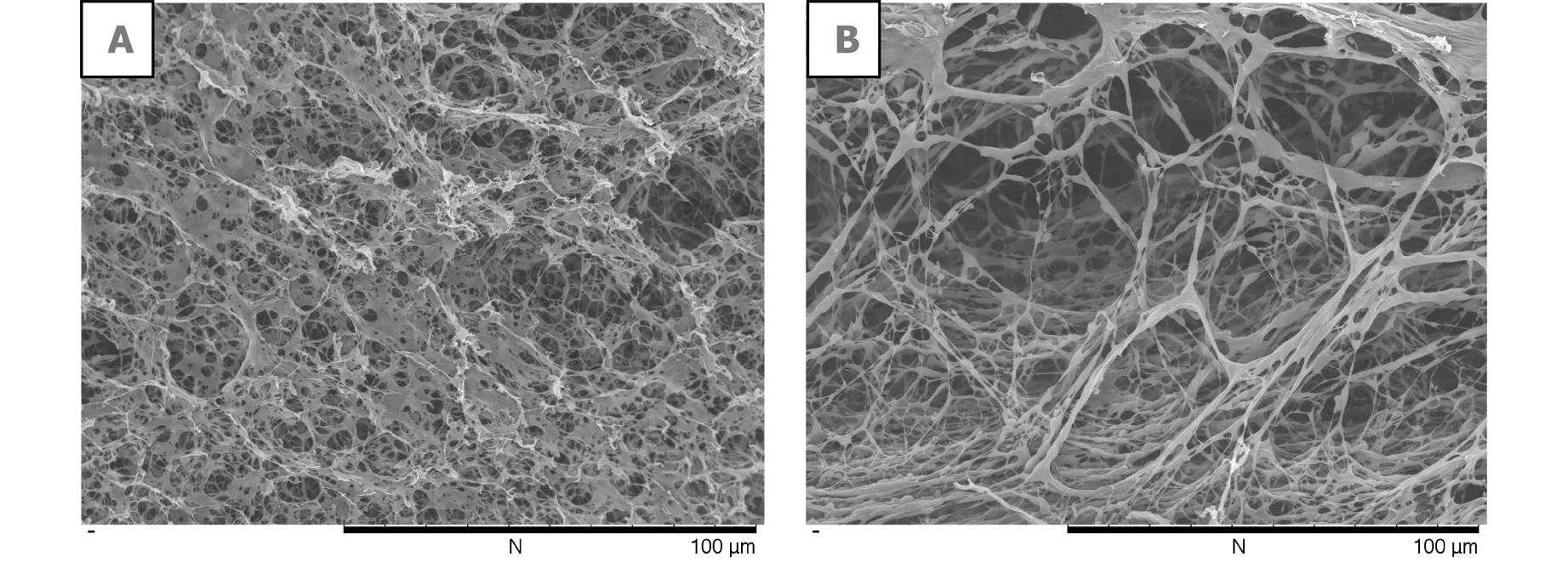
图3 纯丝素凝胶截面形貌(A)和枯草菌脂肽钠/丝素共混凝胶截面形貌(B)
2.4 水凝胶的聚集态结构
图4(A)为纯丝素纤维、纯丝素溶液、纯丝素水凝胶和枯草菌脂肽钠/丝素蛋白水凝胶的红外光谱图(FTIR)。纯丝素纤维中丝素蛋白的酰胺Ⅰ特征峰出现在1 630 cm-1,酰胺Ⅱ特征峰出现在1 520 cm-1,酰胺Ⅲ特征峰出现在1 230 cm-1,均是β-折叠吸收峰,说明丝素纤维以β-折叠结构为主[19]。纯丝素溶液中酰胺Ⅰ特征峰出现在1 655 cm-1,酰胺Ⅱ特征峰出现在1 537 cm-1,酰胺Ⅲ特征峰出现在1 235 cm-1,这些都是无规卷曲吸收峰,说明丝素蛋白溶液中大部分为无规卷曲结构。在丝素纤维溶解为丝素蛋白溶液时,二级结构由β-折叠转变为无规卷曲。枯草菌脂肽钠/丝素水凝胶和纯丝素凝胶的酰胺Ⅰ特征峰出现在1 628 cm-1,是β-折叠结构吸收峰,相对来说纯丝素凝胶的吸收峰更尖锐,说明枯草菌脂肽钠/丝素水凝胶中β-折叠结构含量相对较少;酰胺Ⅱ特征峰出现在1 533 cm-1和1 531 cm-1,这是α-螺旋结构吸收峰;酰胺Ⅲ特征峰出现在1 234 cm-1;两者的酰胺Ⅴ特征峰出现在700 cm-1,这些均为β-折叠结构吸收峰。枯草菌脂肽钠/丝素水凝胶的二级结构与纯丝素凝胶更为相似,即丝素溶液转变为凝胶,是无规卷曲向β-折叠结构的转变,从而出现交联形成网状结构,形成凝胶。
纯丝素纤维、纯丝素溶液、纯丝素水凝胶和枯草菌脂肽钠/丝素水凝胶的X-射线衍射曲线如图4(B)。纯丝素溶液只有20.7°附近有馒头峰,基本为无规卷曲结构。纯丝素纤维的吸收峰在9.1°,20.7°,并且很尖锐,为典型的SilkⅡ结晶结构[20]。纯丝素凝胶在9.1°,20.7°,24.7°附近出现了吸收峰,而枯草菌脂肽钠/丝素水凝胶主要吸收峰也在9.1°,20.7°。这些特征衍射峰表明枯草菌脂肽钠/丝素水凝胶结构与纯丝素纤维的结构相似,是SilkⅡ结晶结构。与FTIR结果一致,表明枯草菌脂肽钠诱导丝素形成水凝胶的过程中,伴随着无规卷曲结构向β-折叠结构的转变。
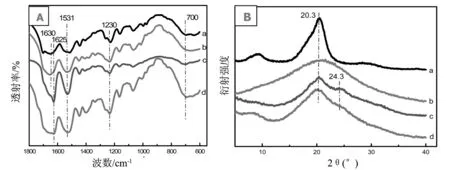
图4 傅立叶红外吸收光谱图(A)和X射线衍射曲线(B)纯丝素纤维(a)、纯丝素溶液(b)、纯丝素凝胶(c)和枯草菌脂肽钠/丝素共混凝胶(d)
2.5 细胞相容性
通过在所制备水凝胶表面培养细胞,测定培养液中阿尔玛蓝的荧光值变化来表征细胞活性,判断水凝胶的细胞相容性[21]。图5表示枯草菌脂肽钠浓度为0g/L、2 g/L时L929细胞在不同浓度丝素蛋白水凝胶表面上的增殖情况。纯丝素凝胶较复合凝胶表面细胞长势稍差,基本接近细胞培养板的增值情况。随着丝素蛋白浓度变化浓度,细胞增殖并没有显著性差异。枯草菌脂肽钠/丝素水凝胶的细胞相容性良好,具备了用于组织修复的条件,并具有良好的应用前景。

图5 不同丝素浓度与枯草菌脂肽钠混合水凝胶表面的细胞在培养不同天数后的荧光值(FLU),其中枯草菌脂肽钠浓度均为2 g/L,丝素浓度分别为50 g/L,40 g/L,30 g/L,TCP为培养板作对照组
3 结论
多肽类表面活性剂枯草菌脂肽钠可诱导丝素蛋白在短时间内快速形成水凝胶。37℃下1 g/L的枯草菌脂肽钠即可诱导丝素蛋白在1 h内形成水凝胶。枯草菌脂肽钠可以诱导丝素蛋白形成均匀的,较大的孔径的水凝胶,有利于水分和营养成分的传输。L929细胞在水凝胶表面生长状况良好,细胞相容性较好,为水凝胶医用材料提供了新的基础。
[1] 张宝萍, 许戈文, 黄毅萍. 丝素蛋白-聚氨酯复合水凝胶的制备及性能研究[J]. 高分子学报, 2012(9):965-971.
[2] Gasperini L, Mano J F, Reis R L. Natural polymers for the microencapsulation of cells[J]. Journal of the Royal Society Interface, 2014, 11(100):1-19.
[3] Numata K, Katashima T, Sakai T. State of water, molecular structure, and cytotoxicity of silk hydrogels[J]. Biomacromolecules, 2011, 12(6): 2137-2144.
[4] Kundu B, Kurland N E, Bano S, et al. Silk proteins for biomedical applications: bioengineering perspectives[J]. Progress in Polymer Science, 2014, 39(2): 251-267.
[5] Drury J L, Mooney D J. Hydrogels for tissue engineering: scaffold design variables and applications[J]. Biomaterials, 2013, 24(24): 4337-4351.
[6] 戴超. 脂肽类生物表面活性剂的提取工艺及其乳化性的研究[D]. 南京:南京农业大学, 2013.
[7] Peypoux F, Bonmatin J M, Wallach J. Recent trends in the biochemistry of surfactin[J]. Applied Microbiology and Biotechnology, 2009, 51(5): 553-563.
[8] Raf De Dier, Maarten Fauvart, Jan Michiels, Jan Vermant. The role of biosurfactants in Bacterial Systerms [M].The Physical Basis of Bacterial Quorun Communication,Springer New York,2015:189-204.
[9] 钱巧芬, 张珊珊, 侯静, 吴琪, 卢神州,乙二醇丝素蛋白共混膜的研究,丝绸,2013, 50(9): 1-6.
[10] Li C, Luo T, Zheng Z, et al. Curcumin-functionalized silk materials for enhancing adipogenic differentiation of bone marrow-derived human mesenchymal stem cells[J]. Acta biomaterialia, 2015, 11: 222-232.
[11] Sun S, Zhang F, Zhang S, et al. Antimicrobial Silk Fibroin Hydrogel Instantaneously Induced by Cationic Surfactant[J]. Biotechnology, 2013, 12(2): 128-134.
[12] Silva S S, Popa E G, Gomes M E, et al. Silk hydrogels from non-mulberry and mulberry silkworm cocoons processed with ionic liquids[J]. Acta biomaterialia, 2013, 9(11): 8972-8982.
[13] 刘明.FTIR对丝素蛋白构象的研究[D]. 杭州:浙江大学,2006.
[14] 黄泉,杨吉成, 缪竞诚. 丝素蛋白材料生物相容性评价研究进展[J]. 国际生物医学工程杂志, 2007, 30: 163-166.
[15] Ziv K, Nuhn H, Ben-Haim Y, et al. A tunable silk-alginate hydrogel scaffold for stem cell culture and transplantation[J]. Biomaterials, 2014, 35(12): 3736-3743.
[16] Marycz K, Szarek D, Grzesiak J, et al. Influence of modified alginate hydrogels on mesenchymal stem cells and olfactory bulb-derived glial cells cultures[J]. Bio-medical materials and engineering, 2014, 24(3): 1625-1637.
[17] Munshi S, Twining R C, Dahl R. Alamar blue reagent interacts with cell-culture media giving different fluorescence over time: Potential for false positives[J]. Journal of pharmacological and toxicological methods, 2014, 70(2):95-98.
[18] Shen Y, Sun S, Zhang F, et al. Instantaneous gelatination of silk fibroin solution[J]. Material Sciences, 2013, 3(5): 187-191.
[19] 周文, 陈新, 邵正中. 红外和拉曼光谱用于对丝蛋白构象的研究[J]. 化学进展, 2006, 18(11): 1514-1522.
[20] Zhong T, Deng C, Gao Y, et al. Studies of in situ-forming hydrogels by blending PLA-PEG-PLA copolymer with silk fibroin solution[J]. Journal of Biomedical Materials Research Part A, 2012, 100(8): 1983-1989.
[21] Thiele J, Ma Y, Bruekers S, et al. 25th Anniversary Article:designer hydrogels for cell cultures:A materials selection guide[J].Advanced Materials, 2014, 26(1): 125-148.
江苏省高校自然科学研究重大项目资助(15KJA540001);江苏省自然科学基金项目(BK20131176)
2014-09-01
