P2Y12基因C34T和G52T位点多态性与氯吡格雷疗效的相关性研究
2015-03-15陈步星杜凤和
赵 敏,陈步星,杜凤和
(首都医科大学附属北京天坛医院心内科,北京 100050)
·论 著·
P2Y12基因C34T和G52T位点多态性与氯吡格雷疗效的相关性研究
赵 敏,陈步星,杜凤和△
(首都医科大学附属北京天坛医院心内科,北京 100050)
目的 研究血小板膜受体P2Y12基因C34T和G52T位点多态性与氯吡格雷疗效的相关性。方法 选取2011年1月1日至2012年1月1日首都医科大学附属北京天坛医院心内科收治的规律服用氯吡格雷的急性冠状动脉综合征患者84例为研究对象。采用单核苷酸多态性(SNP)分型检测方法检测血小板受体基因C34T和G52T,应用血栓弹力仪测定二磷酸腺苷(ADP)途径诱导的血小板抑制率,观察血小板膜受体P2Y12基因C34T和G52T位点多态性与氯吡格雷疗效的相关性。结果 氯吡格雷血小板抑制率达标58例(达标组),未达标26例(未达标组);在C34T基因位点,将所有患者按CC、CT、TT分型,分别为53、31、0例;氯吡格雷血小板抑制率达标组与未达标组基因型分布比较差异无统计学意义(P>0.05)。在G52T基因位点,将所有患者按GG、GT、TT分型,分别为64、19、1例;氯吡格雷血小板抑制率达标组与未达标组基因型分布比较差异有统计学意义(P<0.05)。结论 血小板膜受体P2Y12基因G52T位点多态性,可能是影响患者口服氯吡格雷疗效的重要因素之一,治疗前进行基因检测有利于指导用药,降低心血管事件的发生风险。
氯吡格雷; 血小板膜P2Y12基因; 血栓弹力图
氯吡格雷是一种重要的噻吩并吡啶类抗血小板药物,自1997年应用于临床以来,就成为了冠状动脉粥样硬化性心脏病(简称冠心病)患者,特别是经皮冠状动脉介入治疗(PCI)和急性冠状动脉综合征(ACS)患者的主要治疗用药[1]。阿司匹林联合氯吡格雷是冠状动脉内支架置入术后的标准用药,但是应用双重抗血小板治疗后,仍有部分患者发生心血管事件,以支架内血栓形成最为严重,其中部分由氯吡格雷抵抗导致[2]。近年来研究发现,氯吡格雷抵抗是PCI术中无血流的机制之一,而基因的多态性可能是引起个体差异的主要原因[3]。
血小板膜受体P2Y12是氯吡格雷发挥药理学作用的靶点,属于G蛋白偶联受体。目前已经确认P2Y12基因有5个位点存在基因多肽现象,分别为I-C139T、i-T744C、i-ins801A、C34T和G52T[4]。研究发现,30%的氯吡格雷抵抗与基因有关,主要表现为血小板P2Y12受体基因的多态性、受体数量的增加及受体信号传导障碍[5-6]。到目前为止,我国关于血小板膜受体基因多态性与氯吡格雷疗效的研究并不多。本研究旨在探讨血小板膜受体P2Y12基因C34T、G52T位点多态性与氯吡格雷疗效的相关性,为指导冠心病患者尤其是PCI术后长期服用氯吡格雷治疗的患者的合理用药提供依据。
1 资料与方法
1.1 一般资料 选取2011年1月1日至2012年1月1日本院明确诊断为ACS的住院患者84例为研究对象。纳入标准:患者为汉族,18岁以上,服用氯吡格雷75 mg/d,5 d以上。排除标准:对氯吡格雷过敏或不能耐受者;半年内有内脏出血性疾病史者;严重肝脏疾患和(或) 凝血功能异常者;具有抗血小板治疗禁忌证或近期拟行外科手术者;具有瓣膜病、心肌病、心肌炎、先天性心脏病、周围血管病或感染性心内膜炎者;具有晚期肾功能不全、肿瘤及慢性心力衰竭等严重影响近期预后疾病者。
1.2 仪器与试剂 TEG5000血栓弹力仪(美国Haemoscope公司),试剂:高岭土(含l%的高岭土液)、激活剂F(由蝮蛇血凝酶和血小板ⅩⅢa因子混合而成)及二磷酸腺苷(ADP),均购自Haemoscope公司。电泳仪(北京六一仪器厂)、电泳槽(北京君意东方电泳设备有限公司)、BioSens SC 810B凝胶成像仪(上海山富科学仪器有限公司)、5810R离心机(德国Eppendorf公司)、9700聚合酶链反应(PCR)仪及3730XL测序仪(美国ABI公司),试剂:ABI PRISM®SNaPshotTM多重单核苷酸多态性(SNP)分析试剂盒(美国ABI公司)、Taq 聚合酶(日本TaKaRa公司)及PCR纯化试剂盒(天根生化科技有限公司)。
1.3 方法
1.3.1 标本收集 患者服用氯吡格雷5 d、75 mg/d,禁食12 h后于清晨抽取外周静脉血6 mL分别置入枸橼酸钠和肝素试管中,用于血小板抑制率的检测;另抽取外周静脉血2 mL,-20 ℃储存,用于DNA提取及基因检测。
1.3.2 血小板抑制率检测 抽取静脉血后2 h内完成血小板抑制率检测。在服用氯吡格雷的情况下,由2 μmol/L的ADP诱导的血小板聚集率不低于70%,即抑制率小于30%,为氯吡格雷反应低下[9]。
1.3.3 DNA提取及基因检测 提取并纯化所有患者外周血DNA,根据SNP位点序列信息,使用Primer与软件设计扩增引物和延伸引物并合成;采用3730XL测序仪进行检测,将检测得到的原始数据文件导入到分析软件中进行分析。

2 结 果
2.1 C34T与G52T位点基因分型后患者一般资料比较 在C34T基因分型中,CC型53例、CT型31例、TT型0例;根据是否携带T基因将所有患者分为两组,两组患者的年龄、性别、吸烟史及高血压、糖尿病、陈旧性心肌梗死(OMI)、AMI史等一般资料比较差异均无统计学意义(P>0.05)。在G52T基因分型中,GG型64例、GT型19例、TT型1例;同样根据是否携带T基因将所有患者分为两组,两组患者的年龄、性别、吸烟史及高血压、OMI、AMI史等一般资料比较差异均无统计学意义(P>0.05),而两组糖尿病患病率比较差异有统计学意义(P<0.05)。见表1。
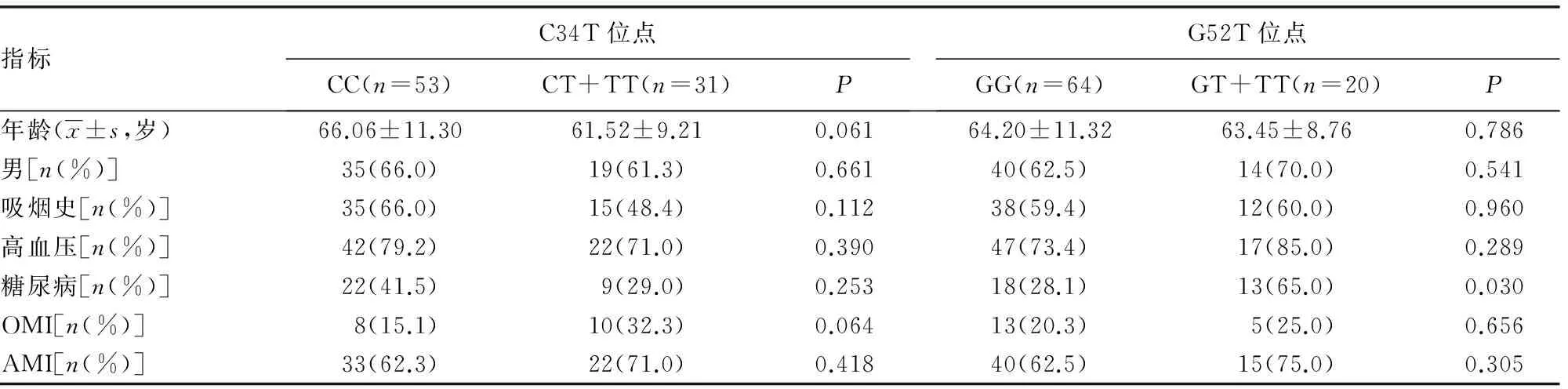
表1 血小板P2Y12受体基因C34T与G52T位点不同基因型的临床基本资料比较(n=84)
2.2 C34T与G52T位点基因型分布与氯吡格雷血小板抑制率的关系 84例患者中氯吡格雷血小板抑制率达标58例(达标组),未达标26例(未达标组)。在C34T位点,两组基因型分布比较差异无统计学意义(P>0.05)。在G52T位点,两组基因型分布比较差异有统计学意义(P<0.05)。见表2。
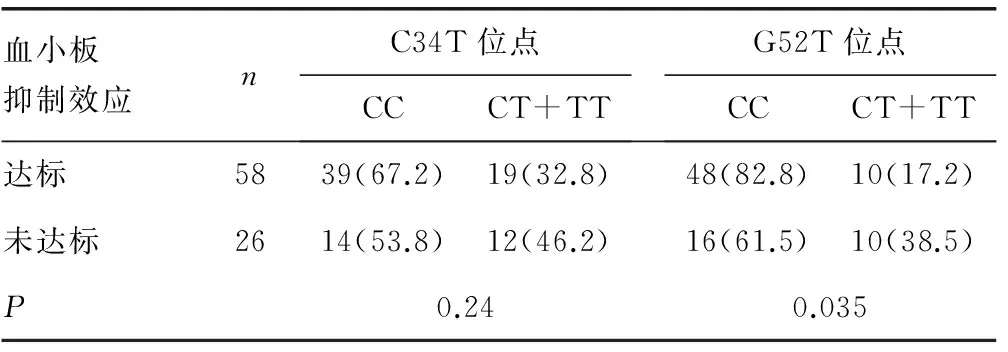
表2 C34T与G52T位点基因型分布与氯吡格雷 血小板抑制率的关系[n(%)]
3 讨 论
氯吡格雷是一种广泛应用于临床的抗血小板药物,是目前不稳定型心绞痛、急性心肌梗死和PCI治疗的基石,能够改善动脉粥样硬化性疾病的近期和远期预后。但研究发现,患者对抗血小板药物的反应存在明显的个体差异,“标准方案”氯吡格雷并不能使所有患者都获得相同的益处,因此药物反应的多样性越来越受到关注。
氯吡格雷的活性代谢产物选择性并不可逆地与血小板表面ADP受体P2Y12结合,减少ADP结合位点,阻断ADP对腺苷酸环化酶的抑制作用,促进环磷酸腺苷(cAMP)依赖和前列腺素E1(PGE1)刺激的血管扩张刺激磷蛋白(VASP)的磷酸化,抑制纤维蛋白原受体(糖蛋白GPⅡb/Ⅲa)活化进而抑制血小板的聚集。而血小板膜P2Y12受体基因的突变可引起P2Y12受体蛋白氨基酸的变异,使P2Y12受体的结构发生改变,从而影响P2Y12受体激活[7]。故血小板ADP受体P2Y12基因的多态性,可影响氯吡格雷的血小板抑制作用。
Fontana等[4]对98例健康受试者进行P2Y12基因序列的变异性分析,结果显示,86%的单倍体为H1单倍体,14%为H2单倍体。研究发现,H2单倍体携带者容易发生动脉粥样硬化性疾病,并且对氯吡格雷的治疗效应降低。Fontana等[8]进行的病例对照研究发现,H2单倍体携带者与外周动脉疾病的发生有关。Ziegler等[9]也发现P2Y12基因变异可增加外周动脉疾病患者服用氯吡格雷后脑血管事件的发生风险,携带至少1个34T变异的患者发生缺血性脑卒中和(或)颈动脉血管重建术的概率是只携带34C变异患者的4倍。王建军[10]研究发现,C34T基因位点C→T的突变可能是氯吡格雷抵抗的危险因子,其作用独立于CPY2C19基因多态性之外。
本研究84例患者入院后开始口服氯吡格雷治疗,并进行了氯吡格雷的血小板抑制率检测。记录患者口服氯吡格雷后的血小板抑制率,分别针对C34T、G52T位点进行氯吡格雷血小板抑制率达标与未达标的定性分析。其中氯吡格雷血小板抑制率达标58例,未达标26例。在C34T位点,将84例患者按CC、CT、TT进行基因分型,各53、31、0例;氯吡格雷血小板抑制率达标组与未达标组基因型分布比较差异无统计学意义(P>0.05)。在G52T位点,将84例患者按GG、GT、TT进行基因分型,各64、19、1例;氯吡格雷血小板抑制率达标组与未达标组基因型分布比较差异有统计学意义(P<0.05)。说明在口服氯吡格雷的患者中,血小板膜受体P2Y12基因G52T的多态性,可能是影响患者口服氯吡格雷疗效的重要因素之一,而C34T的多态性与其关系不明显。
综上所述,氯吡格雷是目前临床常规应用的抗血小板聚集药物,而其效果受基因多态性的影响,因此开展氯吡格雷基因多态性的研究具有非常重要的意义。如果能在抗血小板治疗前对患者的上述基因型进行检测,并根据不同患者的基因型变异情况选择药物和给药方案,不但有利于患者的个体化治疗,还有利于降低心血管事件的发生风险。但是,还需要大规模的人群前瞻性基因多态性筛查和随机临床研究进一步证实。
[1]Yusuf S,Zhao F,Mehta SR,et al.Efects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation[J].N Engl J Med,2001,345(7):494-502.
[2]Vlachojannis GJ,Dimitropoulos G,Alexopoulos D.Clopidogrel resistance:current aspects and future directions[J].Hellenic J Cardiol,2011,52(3):236-245.
[3]Bozbeyoglu E,Satilmis S,Aksu H,et al.Impact of clopidogrel resistance on ST-segment resolution and no-reflow in acute myocardial infarction with ST-elevation patients treated with a primary percutaneous coronary intervention[J].Coron Artery Dis,2012,23(8):523-527.
[4]Fontana P,Dupont A,Gandrille S,et al.Adenosine diphosphate-induced platelet aggregation is associated with P2Y12 gene sequence variations in healthy subjects [J].Circulation,2003,108(8):989-995.
[5]Pena A,Collet JP,Hulot JS,et al.Can we override clopidogrel resistance [J].Circulation,2009,119(21):2854-2857.
[6]Simon T,Verstuyft C,Mary-Krause M,et al.Genetic determinants of response to clopidogrel and cardiovascular events[J].N Engl J Med,2009,360(4):363-375.
[7]Robio JC,Martin MA,Rabadan M,et al.Frequency of the C34T mutation of the AMPD1 gene in world-class endurance athletes:dose this mutation impair performance [J].J Appl Physiol,2005,98(6):2108-2112.
[8]Fontana P,Gaussern P,Aiach M,et al.P2Y12 H2 haplotype is associated with peripheral arterial disease:a case-control study[J].Circulation,2003,108(24):297l-2973.
[9]Ziegler S,Schillinger M,Funk M,et al.Association of a functional polymorphism in the clopidogrel target receptor gene,P2Y12,and the risk for ischemic cerebrovascular events in patients with peripheral artery disease[J].Stroke,2005,36(7):1394-1399.
[10]王建军.血小板P2Y12受体基因(C34T、G52T、iT744C)多态性对冠心病患者氯吡格雷抵抗的影响[D].福州:福建医科大学,2009.
Association between P2Y12 gene C34T and G52T platelet receptor polymorphisms and clopidogrel efficacy
ZHAOMin,CHENBu-xing,DUFeng-he△
(DepartmentofCardiology,BeijingTiantanHospital,CapitalMedicalUniversity,Beijing100050,China)
Objective To study the correlation between platelet receptor P2Y12 gene C34T and G52T sites polymorphism with clopidogrel efficacy.Methods 84 patients with acute coronary syndrome in the internal medicine department of Beijing Tiantan Hospital from 1st Jan. 2011 to 1st Jan. 2012 received the regular oral clopidogrel treatment.The platelet receptor P2Y12 gene C34T and G52T sites polymorphism was detected by the single nucleotide polymorphisms typing.The platelet inhibition ratio induced by the ADP pathway was detected by the thromboelastography.The correlation between platelet receptor P2Y12 gene C34T and G52T sites polymorphism with clopidogrel efficacy was observed.Results 58 cases reached the standard of clopidogrel platelet inhibition ratio and 26 cases did not reach the standard.By the C34T genotyping in 84 cases,the type CC,CT and TT were 53 cases,31 cases and 0 case respectively.At the C34T gene site,no statistical significant difference was found in the frequency of distribution of genotypes between patients reached the standard and patients did not reach the standard(P>0.05).At the G52T gene site,statistical significant difference was found in the frequency of distribution of genotypes between patients reached the standard and patients did not reach the standard(P<0.05).Conclusion Platelet receptor P2Y12 gene G52T site polymorphism may be one of important factors affecting oral clopidogrel efficacy.Conducting the gene detection could be conducive to guide the medication and decrease the risk of cardiovascular event occurrence.
clopidogrel; platelet receptor P2Y12 gene; thrombelastogram
赵敏,女,本科,主治医师,主要从事冠心病临床研究。△
,E-mail:fhduu@sina.com。
10.3969/j.issn.1672-9455.2015.05.019
A
1672-9455(2015)05-0628-03
2014-10-26
2014-12-28)
