热疗和热疗联合放疗对人食管癌ECA109细胞凋亡的影响
2015-03-15刘桂荣康亚辉马建新李雪梅
刘桂荣,康亚辉,马建新,李雪梅
(江苏省连云港市第二人民医院肿瘤放疗科 222000)
·论 著·
热疗和热疗联合放疗对人食管癌ECA109细胞凋亡的影响
刘桂荣,康亚辉,马建新,李雪梅△
(江苏省连云港市第二人民医院肿瘤放疗科 222000)
目的 研究热疗和热疗联合放疗对人食管癌ECA109细胞凋亡的影响。方法 将人食管癌ECA109细胞分为4组:正常对照组、单纯热疗组、单纯放疗组和热疗+放疗组,在热疗联合不同照射剂量下诱导ECA109细胞凋亡,以流式Annexin V-FITC/PI双染色法检测其凋亡率,蛋白质印迹法检测细胞内caspase-3、Bax、Bcl-2的表达,克隆集落形成实验观察热疗的辐射增敏作用。结果 通过多靶单击模型拟合细胞存活曲线,可见热疗+放疗组的ECA109细胞存活分数明显低于单纯放疗组(P<0.01),热疗联合放疗可以增加细胞的辐射敏感性,辐射增敏比为1.24;与单纯放疗组相比,热疗+放疗组ECA109细胞凋亡率明显增加(P<0.05);相对于单纯放疗和单纯热疗,热疗+放疗作用于人食管癌ECA109细胞可以使凋亡相关蛋白caspase-3、Bax的表达明显升高,Bcl-2表达明显降低。结论 热疗能够提高人食管癌细胞的放射敏感性,其机制可能与热疗增加人食管癌细胞的凋亡率密切相关。
热疗; 放疗; 食管癌; 放射敏感性
我国是食管癌高发国家,在我国因恶性肿瘤死亡的病例中,食管癌高居第4位[1]。手术虽是治疗食管癌的首选方法,但手术的创伤性大,患者术后生活质量较差,并且部分患者因发现较晚而失去手术机会。热疗已经成为继手术、放疗、化疗和生物治疗之后的第5类治疗手段[2],热疗联合放疗在肿瘤的临床治疗中应用较多,并且临床疗效明显。包括肿瘤在内的许多疾病的发生是由细胞增殖和凋亡的不平衡造成的[3],研究表明热疗主要通过促进细胞凋亡而发挥治疗肿瘤的作用,caspase-3则是细胞凋亡信号通路中的重要调节分子之一[4]。此外,凋亡的发生受多种基因调控,其中Bcl-2家族在细胞凋亡中的作用备受关注。Bcl-2为凋亡抑制蛋白,Bax为凋亡促进蛋白,两者形成异二聚体抑制Bcl-2的功能,均与细胞凋亡密切相关[5]。尽管热疗增强肿瘤细胞放射敏感性及诱导肿瘤细胞凋亡的作用已经受到越来越多的重视,但热疗联合放疗对人食管癌ECA109细胞的影响的报道甚少。本研究初步探讨热疗联合放疗对人食管癌ECA109细胞凋亡的影响及其机制,为热疗与放疗联合治疗食管癌提供实验依据。
1 材料与方法
1.1 细胞来源 人食管癌ECA109细胞株均为本科室保存标本。
1.2 仪器与试剂 含10%新生牛血清、胰蛋白酶及完全型RPMI-1640培养基均购自美国Gibco公司;羊抗兔二抗、蛋白质分子量标准、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上样缓冲液、放射免疫沉淀(RIPA)蛋白裂解液、TE电泳缓冲液、10×Western转膜缓冲液、30%Acry-Bis、三羟甲基氨基甲烷-盐酸缓冲液(Tris-HCl)、过硫酸铵(AP)、SDS、四甲基乙二胺(TEMED)均购自海门碧云天生物技术研究所;Bcl-2兔抗人单克隆抗体购自美国Santa Cruz公司;caspase-3兔抗人单克隆抗体购自谷歌生物;Bax兔抗人单克隆抗体购自美国Epitomics公司;GAPDH兔抗人单克隆抗体购自美国Bioworld公司,Annexin V-FITC/PI双染色法流式细胞检测试剂盒及吉姆萨染液均购自南京凯基生物科技发展有限公司。23EX医用直线加速器(美国VARIAN公司),FACS Aria流式细胞仪(美国BD公司),Mini-PROTEAN4电泳仪(美国Bio-rad公司),ChemiDoc XRS+凝胶成像系统(美国Bio-rad公司)。
1.3 方法
1.3.1 照射及加热 采用6 MV的X射线垂直照射,源靶距(SSD)100 cm,照射野面积15 cm×20 cm,吸收剂量率为400 cGy/min。恒温孵育箱,温度为(43±0.1)℃。
1.3.2 细胞培养与处理 人食管癌ECA109细胞株用含10%新生牛血清的RPMI-1640培养基,于37 ℃、5%二氧化碳恒温培养箱中孵育培养,每2~3天传代一次。对照组:在37 ℃孵育箱中常规培养;单纯放疗组:以0、1、2、4、6、8 Gy照射,不同剂量照射后继续在37 ℃孵育箱中培养;单纯热疗组:使用恒温孵育箱(43±0.1)℃,加热处理60 min后,再置于37 ℃恒温箱中;热疗+放疗组:照射前于恒温孵育箱(43±0.1)℃加热,再按不同照射剂量(0、1、2、4、6、8 Gy)照射后置于37 ℃恒温箱中继续培养。
1.3.3 流式细胞术检测 细胞凋亡和坏死细胞分组处理之后继续培养24 h,其中单纯放疗组和热疗+放疗组均予以6 Gy照射。收集细胞后用4 ℃预冷的磷酸盐缓冲液(PBS)冲洗2遍后消化离心,重悬计数使其密度大于1×106/mL。取100 μL细胞悬液于5 mL流式管中,加入5 μL Annexin V-FITC和10 μL碘化丙锭溶液(PI)混匀后,于室温避光孵育15 min。于流式细胞仪上检测,激发波长(Ex)488 nm,发射波长(Em)530 nm,计算凋亡率。
1.3.4 蛋白质印迹法(Western blot)检测细胞内caspase-3、Bax及Bcl-2表达 细胞分组处理之后于37 ℃孵育箱中继续培养24 h,其中单纯放疗组和热疗+放疗组均予以6 Gy照射。收集各组细胞,用1×SDS-PAGE上样缓冲液裂解不同处理组细胞,提取细胞总蛋白,测定蛋白浓度,制作10%分离胶和5%浓缩胶,待其凝固后加入蛋白样品15 μL。电泳条件:80 V,10 min;120 V,30 min。转移蛋白至聚偏二氟乙烯膜(PVDF膜),转膜条件:恒流300 mA,90 min。将转膜后的PVDF膜浸润在含5%脱脂奶粉的TBST缓冲液中1 h,加入特异性一抗(1∶400)于4 ℃过夜,加入辣根过氧化物酶(HRP)标记的二抗,室温孵育2 h,最后加入发光底物经X射线曝光显示蛋白条带。重复实验至少3次。
1.3.5 克隆集落形成实验检测热疗的辐射增敏作用 取指数生长期的人食管癌ECA109细胞,以适当密度接种于六孔板中,细胞分组处理后继续培养,每3天换液1次,当六孔板中出现肉眼可见克隆时(约10 d),终止培养,弃去上清液,用PBS冲洗3遍,无水甲醇固定10 min,姬姆萨染色15 min,然后用流动水洗去染色液,自然晾干后于倒置显微镜下计数大于50个细胞的克隆数。克隆形成率(%)=(对照组克隆数/实验组细胞数)×100%,存活分数(SF)=实验组克隆形成率/对照组克隆形成率。根据多靶单击模型SF=1-(1-e-D/D0)N拟合细胞存活曲线,式中D为放射剂量;D0为曲线指数下降63%所需的剂量,即平均致死剂量;D0=1/k,k为存活曲线斜率;N为外推数,Dq为细胞受损所需的准阈剂量,Dq= D0×lnN。计算辐射增敏比(SER),SER=D0(对照组)/D0(实验组)。重复实验3次。

2 结 果
2.1 热疗对凋亡相关蛋白表达的影响 Western blot结果显示,单纯放疗与单纯热疗组人食管癌ECA109细胞促凋亡蛋白caspase-3、Bax的表达均上调,说明单纯放疗、热疗均具有促肿瘤细胞凋亡的作用;而热疗+放疗组促凋亡蛋白表达更加明显,说明热疗联合放疗可以明显地促进肿瘤细胞的凋亡。然而,凋亡抑制蛋白Bcl-2的表达则截然相反,再次验证了热疗对放疗的增敏效应。见图1。
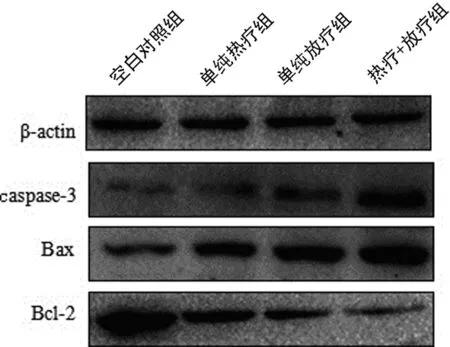
图1 Western blot检测各组ECA109细胞中
2.2 热疗对人食管癌ECA109细胞放射敏感性的影响 人食管癌ECA109细胞经过处理后,根据单击多靶模型拟合细胞存活曲线,计算出热疗+放疗组的SER。可见热疗+放疗组的SF明显低于单纯放疗组,组间比较差异有统计学意义(t=5.659 2,P<0.01)。见图2。细胞加热后再受到不同剂量X射线的照射,细胞存活曲线明显改变,存活曲线的斜率增大,D0值下降,SER为1.24,说明热疗具有明显的辐射增敏作用。见表1。

图2 不同处理组ECA109细胞存活曲线图

组别kND0DqSF2SER单纯放疗0.312.663.232.150.87-热疗+放疗0.512.691.961.660.701.24
注:SF2为单次照射2 Gy的SF;-表示无数据。
2.3 不同处理组人食管癌ECA109细胞流式结果 热疗+放疗组ECA109细胞凋亡率明显高于单纯热疗组(P<0.05)和单纯放疗组(P<0.05),说明热疗与X射线联合作用有增加食管癌细胞凋亡的作用,即热疗对食管癌细胞有辐射增敏作用。见图3、表2。

图3 不同处理组ECA109细胞流式结果

组别n细胞凋亡率(%)空白对照组314.9±0.8单纯热疗组380.8±1.3ab单纯放疗组390.3±1.1ab热疗+放疗组395.2±1.5a
注:与空白对照组比较,aP<0.01;与热疗+放疗组比较,bP<0.05。
3 讨 论
细胞凋亡是一种复杂的生理和病理过程,它在细胞生长、发育过程中对细胞凋亡的发生具有重要的生物学意义,为维持机体内环境所必需的过程。近年来,随着肿瘤分子生物学的快速发展,人们逐渐认识到肿瘤的发生、发展不仅是细胞增殖失控的结果,也可能是由细胞凋亡受限所致。
caspase-3属于天冬氨酸特异性半胱氨酸蛋白酶家族的成员,细胞凋亡开始时,actived-caspase-3剪切聚ADP-核糖聚合酶(PARP酶)使之成为85×103和31×103的2段多肽,进而使PARP酶中与DNA相结合的两个锌指模体结构与羧基端的催化区域分离,失去其正常功能,Ca2+/Mg2+依赖性核酸内切酶活性增高进而裂解核小体间的DNA,使细胞发生凋亡。而Bcl-2及其家族成员在细胞凋亡中起着双重调节作用,Bcl-2与Bax决定细胞接受凋亡信号后存活与否,对肿瘤细胞凋亡的发生有重要意义;研究表明,Bcl-2表达下调和Bax表达上调能抑制肿瘤的生成,促进肿瘤细胞凋亡[6]。
热疗是近20年再度兴盛起来的肿瘤治疗方式,其对局部肿瘤的治疗效果是其他手段无法比拟的。大量研究结果显示,无论是体内还是体外培养的癌细胞,在42~43 ℃的高温均可被杀死,而较长时间置于同样条件下的正常细胞并没有明显损害[7]。此外,有研究报道,热疗联合放疗可使治疗效果提高,两者联合既可以增强对肿瘤的杀伤作用,又可以降低射线剂量,从而实现协同增效作用[8]。
目前临床上常采用43 ℃作为热疗温度,且有报道显示43 ℃可明显促进人食管癌ECA109细胞的凋亡[9],因此本研究选择43 ℃作为实验条件。研究结果发现,热疗联合放疗可以明显提高caspase-3和Bax的表达,降低Bcl-2的表达。这提示热疗联合放疗能够促进ECA109细胞凋亡,且克隆形成实验提示其具有射线剂量依赖性。由此可见,热疗促进ECA109细胞的凋亡可能是其增敏机制之一。
综上所述,热疗能够提高人食管癌细胞的放射敏感性,这可能与热疗可以提高凋亡促进蛋白caspase-3和Bax的表达,降低凋亡抑制蛋白Bcl-2的表达,增加食管癌细胞的凋亡率密切相关。
[1]中华人民共和国卫生部.全国第三次死因回顾抽样调查报告[M].北京:中国协和医科大学出版社,2008:10.
[2]詹宏杰,梁寒.肿瘤热疗的研究[J].国外医学:肿瘤学分册,2005,32(1):35-38.
[3]Waxman DJ,Schwartz PS.Harnessing apoptosis for improved anticancer gene therapy[J].Cancer Res,2003,63(24):8563-8572.
[4]Chang HY,Yang X.Proteases for cell suicide:functions and regulation of caspases[J].Microbiol Mol Biol Rev,2000,64(4):821-846.
[5]Cory S,Adams JM.Killing cancer cells by flipping the Bcl-2/Bax switch[J].Cancer Cell 2005,8(1):5-6.
[6]Inoue S,Salah-Eldin AE,Omoteyama K.Apoptosis and anticancer drug resistance[J].Hum Cell,2001,14(3):211-221.
[7]Kim CS,Hill RP,Kumaradas JC,et al.Effect of simultaneous pulsed hyperthermia and pulsed radiation treatment on survival of SiHa cells[J].Int J Hyperthermia,1998,14(6):573-581.
[8]刘本春,张元芳.肿瘤热疗研究进展[J].国外医学:肿瘤学分册,2004,31(10):758-760.
[9]王希方,秦思达,杜宁,等.热疗通过提高活性caspase-3的表达促进食管癌EC109细胞凋亡[J].现代肿瘤医学,2012,20(11):2236-2239.
Effect of themotherapy and themotherapy combined with radiotherapy on apoptosis of human esophageal cancer cell ECA109
LIUGui-rong,KANGYa-hui,MAJian-xin,LIXue-mei△
(DepartmentofRadiotherapy,LianyungangMunicipalSecondPeople′sHospital,Lianyungang,Jiangsu222000,China)
Objective To research the effect of themotherapy and themotherapy plus radiotherapy on apoptosis of human esophageal cancer cell ECA109.Methods Human esophageal cancer cells ECA109 were divided into four groups:normal control group,themotherapy group,radiotherapy group and themotherapy plus radiotherapy group.The apoptosis of human esophageal cancer cell ECA109 were induced by the themotherapy combined with different radiation doses.The flow cytometry Annexin V-FITC/PI double staining was adopted to detect the apoptosis rate,intracellular caspase-3,Bax,Bcl-2 expression were detected by Western blot and the radiosensitizing effect of themotherapy was observed by the clone colony formation assay.Results By adopting the clicking multiple target model for fitting the cellular survival curves,the survival fraction of human esophageal cancer cells ECA109 cells in the themotherapy plus radiotherapy group was significantly lower than that in the simple radiotherapy group(P<0.01),the themotherapy plus radiotherapy could increase the cellular radiation sensitivity,the sensitization enhancement ratio was 1.24;compared with the simple radiotherapy group,the apoptosis rate of ECA109 cells in the themotherapy plus radiotherapy group was significantly increased(P<0.05).Compared with the simple radiotherapy and simple themotherapy,the themotherapy plus radiotherapy acting on human esophageal cancer ECA109 cells could significantly increased the expression of apoptosis related proteins caspase-3 and Bax,and significantly decreased the Bcl-2 expression.Conclusion Themotherapy can increase the radiosensitivity of human esophageal cancer cells,its mechanism may be closely related with themotherapy increasing the apoptosis rate of human esophageal cancer cells.
thermotherapy; radiotherapy; esophageal cancer; radiosensitivity
刘桂荣,女,本科,副主任医师,主要从事肿瘤放射治疗及肿瘤热疗研究。△
,E-mail:lygcjc2009@163.com。
10.3969/j.issn.1672-9455.2015.05.026
A
1672-9455(2015)05-0646-03
2014-11-20
2014-12-28)
