阿霉素肾病小鼠病理机制中白细胞介素-18水平分析
2015-03-15匡颖,秦达
匡 颖,秦 达
(贵州省人民医院中心实验室,贵阳 550002)
·论 著·
阿霉素肾病小鼠病理机制中白细胞介素-18水平分析
匡 颖,秦 达
(贵州省人民医院中心实验室,贵阳 550002)
目的 探讨白细胞介素-18(IL-18)在阿霉素肾病模型(微小病变型肾病,MCN)小鼠病程中的免疫失调作用。方法 采用阿霉素单次尾静脉注射昆明种小鼠,诱导形成微小病变型肾病模型,设置模型组、生理盐水对照组和IL-18mAb抗体中和实验组(mAb)。测定3组小鼠第1、2、4、6周24 h尿蛋白(24 hUPQ)水平;于第42天时心脏采血法留取血清,检测模型组与对照组血清总蛋白(TP)、清蛋白(ALB)、尿素氮(BUN)、肌酐(Cr)、三酰甘油(TG)、总胆固醇(Tch)的水平;取单侧肾做病理检测,同时制备脾淋巴细胞悬液、肾组织匀浆液检测3组IL-18、γ干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)及IL-4水平。结果 模型组小鼠从注射阿霉素第2周起,24 h UPQ值均高于对照组,差异均有统计学意义(P<0.01);血清TP、ALB、BUN、Cr、Tch、TG结果和病理诊断结果显示,模型小鼠出现低蛋白血症、高脂血症等类肾病综合征症状。检测显示模型组小鼠血清、肾组织匀浆上清液、脾淋巴细胞培养上清液IL-18、INF-γ、TNF-α水平均高于对照组,而IL-4水平均低于对照组,组间比较差异均有统计学意义(P<0.01)。mAb组小鼠24 hUPQ及IL-18、IFN-γ、TNF-α水平均低于模型组,组间比较差异有统计学意义(P<0.01)。结论 模型小鼠病程中,Th1类细胞因子分泌增强,Th2类因子受抑制,且IL-18mAb起到部分中和内源性IL-18的作用,表明IL-18是小鼠MCN病程中重要的免疫失调因子。
微小病变型肾病; 阿霉素; 白细胞介素-18
细胞免疫反应、T细胞激活及肾间质炎性反应是肾病综合征(NS)发病的重要特征[1]。多种血清活性成分,包括多种免疫活性细胞源性细胞因子,可直接造成肾小球的损伤,是诱发临床大量蛋白尿的重要因素。而以细胞介导为主的辅助性T淋巴细胞亚群(Th1/Th2)免疫反应失调是NS发病的主要原因[2]。白细胞介素-18(IL-18)是一种重要的免疫调节因子,不仅参与先天性或特异性免疫调节,且与机体非免疫性预防机制及炎性过程密切相关,在自身免疫性疾病的发病过程中具有重要意义。本研究以阿霉素(ADR)诱导肾病小鼠为实验模型[3],观察微小病变型肾病(MCN)小鼠IL-18水平的变化,以探讨其在NS发病中的生物学意义,同时为NS的治疗提供新的靶分子和新的研究方向。
1 材料与方法
1.1 实验动物 雄性昆明种小鼠36只,体质量18~20 g,年龄3~4周。随机分为模型组16只,对照组20只。
1.2 方法
1.2.1 阿霉素肾病模型小鼠(微小病变型)的建立 单次应用阿霉素溶液以7.5 mg/kg 的剂量于尾静脉内注射模型组小鼠,对照组尾静脉注射等容积生理盐水。观察小鼠的生长情况6周,动态监测24 h 尿蛋白量(24 hUPQ),检测其他生化指标并做病理切片检测。
1.2.2 动态尿蛋白定性及定量检测 阿霉素尾静脉注射后,代谢笼收集第1、2、4、6周24 h尿液,动态监测各期24 hUPQ。以磺基水杨酸比浊法进行尿蛋白定性,显示模型组小鼠自第3周起均出现蛋白尿(++~+++),对照组均为(-)。以双缩脲比色法测定第1、2、4、6周两组小鼠24 hUPQ。
1.2.3 模型组小鼠肾功能生化指标的检测 实验第42天,以心脏采血法获取血清后,采用CK-7型多功能全自动生化仪(美国Beckman公司)分别检测小鼠血清总蛋白(TP)、清蛋白(ALB)、肌酐(Cr)、尿素氮(BUN)及总胆固醇(Tch)、三酰甘油(TG)水平。
1.2.4 肾组织匀浆的制备 实验第42天,小鼠心脏采血获取血清后,用10%水合氯醛0.3 mL/100g体质量腹腔注射麻醉,剪去左背侧被毛,局部消毒,于背旁正中1 cm处纵切口,暴露单侧肾脏,钝性分离脂肪囊及肾包膜,去除脂肪囊及肾包膜,称重约100 mg,加0.5 mL 磷酸盐缓冲液(PBS)冰浴下制作匀浆,以离心半径6 cm,3 000 r/min,离心5 min,取0.3 mL上清液,置于-20 ℃冻存备检。
1.2.5 脾细胞的体外培养 两组小鼠饲养至第42天时,心脏取血法处死。无菌取脾脏,用眼科剪剪成1 mm3的小块,用0.25%的胰酶消化制备成单细胞悬液。之后用无菌水除去红细胞,以淋巴细胞培养液[RPMI-1640,每100 mL含50 U青霉素和50 μg链霉素,25 mmol 4-羟乙基哌嗪乙磺酸(HEPES),10 mL小牛血清]调整脾细胞浓度至1×106/mL,加入5 μg/mL刀豆蛋白A(ConA)作为T淋巴细胞增殖刺激物,在5% 二氧化碳,37 ℃的环境下,诱导48 h,收集上清液。
1.2.6 MCN小鼠的内源性IL-18中和实验 单次应用阿霉素尾静脉注射小鼠,即诱导建立MCN小鼠模型后,随机分成MCN模型组、小鼠IL-18单克隆抗体(IL-18mAb)中和实验组(简称mAb组)。IL-18mAb粉剂以PBS稀释溶解成0.5 mg/kg、1.0 mg/kg两种注射剂量,于第5、7、12、21天行小鼠腹腔注射[4],同步观察小鼠的生长情况,检测各项临床指标。
1.2.7 细胞因子的检测 以酶联免疫吸附试验(ELISA)检测小鼠血清、肾组织匀浆上清液、脾淋巴细胞培养上清液IL-18及IL-4、γ干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)水平。

2 结 果
2.1 两组小鼠24 hUPQ动态监测结果比较 从注射阿霉素第2周起模型组各时段24 hUPQ水平均高于对照组,组间比较差异均有统计学意义(P<0.05),至第4周增加最明显。见表1。
2.2 两组小鼠血清各生化指标比较 与对照组比较,模型组小鼠的TP、ALB均降低,TG、Tch均升高,组间比较差异均有统计学意义(P<0.05);两组Cr、BUN水平比较差异无统计学意义(P>0.05)。见表2。

表1 两组小鼠24 hUPQ动态监测结果比较
注:与对照组比较,aP<0.05。
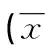
表2 两组小鼠血清各生化指标比较±s)
注:与对照组比较,aP<0.05。
2.3 肾脏病理学改变 肉眼观察显示:模型组小鼠腹腔内有一定量的腹水,部分小鼠(12只)肾色苍白,皮质、髓质分界不清;对照组无此改变。且模型组小鼠肾体积比对照组大,IL-18mAb中和实验组小鼠肾体积变化不明显。苏木精-伊红染色镜检显示:模型组小鼠肾小球未见异常或仅有轻微病变,即缺乏特异的和确定的病理学异常;对照组无病理改变。电镜检查显示:模型组小鼠肾上皮细胞肿胀、有空泡形成,肾小球上皮细胞足突部分融合或融合,见图1;部分区域足突甚至消失,见图1B;对照组小鼠未见上述病理改变。
2.4 两组小鼠各细胞因子水平比较 模型组小鼠血清、肾组织匀浆上清、脾淋巴细胞培养液上清中IL-18、IFN-γ、TNF-α水平均高于对照组,IL-4水平均低于对照组,差异均有统计学意义(P<0.01)。见表3~5。
2.5 IL-18mAb阻断内源性IL-18作用 从第2周开始mAb组小鼠24 hUPQ低于模型组,组间比较差异均有统计学意义(P<0.01);MCN小鼠腹腔注射IL-18mAb后从第2周开始,24 hUPQ逐渐减少,至第6周下降程度更明显。见表6。

图1 MCN模型组小鼠肾组织病理结构电镜(×30 000)
2.6 模型组与mAb组小鼠各细胞因子水平比较 与模型组比较,mAb组小鼠血清、肾组织匀浆上清和脾淋巴细胞培养液上清IL-18、IFN-γ、TNF-α水平均降低,肾组织匀浆上清和脾淋巴细胞培养液上清IL-4水平均降低,差异均有统计学意义(P<0.01);而血清IL-4水平比较差异无统计学意义(P<0.01)。见表7~9。

表3 小鼠血清IL-18、IL-4、IFN-γ、TNF-α 水平比较
注:与对照组比较,aP<0.01。

表4 小鼠肾组织匀浆上清液IL-18、IL-4、IFN-γ、TNF-α 水平比较
注:与对照组比较,aP<0.01。

表5 小鼠脾淋巴细胞培养上清液IL-18、IL-4、IFN-γ、TNF-α 水平
注:与对照组比较,aP<0.01。

表6 模型组与mAb组小鼠24 hUPQ比较
注:与模型组比较,aP<0.01。

表7 小鼠血清IL-18、IL-4、IFN-γ、TNF-α 水平比较
注:与模型组比较,aP<0.01。

表8 小鼠肾组织匀浆上清液IL-18、IL-4、IFN-γ、TNF-α 水平比较
注:与模型组比较,aP<0.01。

表9 小鼠脾淋巴细胞培养上清液IL-18、IL-4、IFN-γ、TNF-α 水平比较
注:与模型组比较,aP<0.01。
3 讨 论
国外学者研究证实,MCN的主要发病机制是免疫性炎症介导的病理损伤,包括全身性自身免疫性疾病所致的肾病变和肾脏本身特发性免疫损伤[5-6]。T细胞功能紊乱与NS关系密切,各种原发性和继发性肾小球疾病都存在Th1/Th2失衡的情况。在MCN病程中,IL-18既可以诱导Th1型免疫反应,还参与调节Th2型反应,具有极为重要的生物学意义。IL-18是一种多功能细胞因子,有多重生物学功能[7-8]:可通过增加IL-2R的表达而促进Th1细胞的形成、诱导Th1细胞产生IFN-γ;能促进IL-1和粒细胞-巨噬细胞集落刺激因子(GM-CSF) 产生;增强自然杀伤细胞(NK细胞)的活性,促进其释放穿孔素,发挥杀伤作用;表达Fas配体(FasL),增强FasL介导的细胞毒性;诱导TNF-α和多种趋化因子的基因表达与蛋白质合成;同时抑制Th2类细胞因子的生成。
本实验以阿霉素注射昆明种小鼠建立MCN动物模型,虽然MCN大鼠模型在1982年已由Bertani等研究者建立,但是采用昆明种小鼠建立此肾病模型尚未见资料报道[9]。阿霉素是含醌的蒽环抗菌药物,在肾脏内被代谢为半醌型自由基,后者与氧反应产生活性氧,在多种脂质介质如血小板活化因子的介导作用下,诱发肾小球上皮细胞脂质过氧化反应,从而改变肾小球上皮细胞糖蛋白代谢,破坏肾小球滤过膜的结构和功能,最终导致膜滤过屏障病变而引起蛋白尿[10]。采用0.75 mg/kg体质量尾静脉注射昆明种小鼠,注药后第2周出现严重蛋白尿,28 d左右达高峰,出现明显低清蛋白血症、高胆固醇血症及胸腔积液和腹水。光镜下肾小球病变甚微,电镜下观察见上皮细胞空泡变性,假绒毛明显变性,足突广泛融合,裂隙消失,符合MCN的病理特点。提示MCN小鼠模型建立成功。
实验结果显示,模型组小鼠血清IL-18、IFN-γ、TNF-α水平明显高于对照组(P<0.01),尤其肾组织匀浆上清液、经ConA刺激增殖的脾淋巴细胞培养液中IL-18表达水平更为灵敏,说明在疾病的活动期伴有高水平的IL-18的释放。证实IL-18参与了MCN的肾损伤过程,病程中出现大量蛋白尿。相反,Th2型细胞因子IL-4的表达水平受抑制。即阐明Th1和Th2型反应相互拮抗,IL-18在促进Th1型细胞因子的释放时,抑制Th2型因子的产生。而Th1/Th2的免疫失衡,导致肾脏的免疫损伤。据已有的相关研究推测,IL-18可能通过下列途径在MCN的发生发展中发挥作用[11-12]:(1)通过促进TNF-α、IL-1β、IFN-γ等细胞因子的产生,引起肾小球微循环发生改变,肾小球系膜细胞活化与增殖,基质膨胀;(2)通过促进一氧化氮的产生,可能引起肾小球超滤过及持续血管扩张;(3)通过增强Fas/FasL介导的细胞凋亡而发挥作用,细胞凋亡可能在MCN的终末期肾萎缩过程中发挥重要作用。Fas/FasL途径是启动细胞凋亡的重要途径之一,推测外周血NK细胞等分泌FasL可与肾脏固有细胞表达的Fas结合而诱导MCN患者肾脏细胞凋亡和肾萎缩。但是,IL-18是否能直接引起肾小球系膜细胞增殖、细胞外基质膨胀,则有待于进一步研究[13]。
综上所述,通过建立MCN小鼠模型,多重比对血清、肾组织匀浆上清液及脾淋巴细胞培养上清液中IL-18释放水平,同时尝试采用拮抗剂IL-18mAb注射模型小鼠,达到部分中和内源性IL-18的作用、减轻其引起的直接或间接肾损伤作用,有力地证实IL-18在MCN肾损伤免疫病程中起重要甚至关键作用。随着免疫治疗技术的发展,设想可以通过阻断IL-18的生成或拮抗其作用,减少IL-18所致的多种促炎细胞因子和凋亡相关因子的产生,减轻对肾脏的损伤作用,具有广阔的临床应用前景。 参考文献
[1]Yoshimoto T,Takeda K,Tanaka T,et al.IL -12 up-regulates IL-18 receptor expression on T cell,Th1 cells and B cells:synergism with IL-18 for IFN -γ production[J].J Immunol,1998,161 (7):3400-3407.
[2]姚航平,张立煌,冷建杭,等.白细胞介素18重组腺病毒对小鼠腹腔巨噬细胞免疫功能的影响[J].浙江大学学报:医学版,2001,30(6):248-251.
[3]Loughrey BV,Maxwell AP,Fogarty DG,et al.An interlukin 1B allele,which correlates with a high secretor phenoltype,is associated with diabetic nephropathy[J].Cytokine,1998,10(12):984-988.
[4]Kokai M,Kashiwamura S,Okamura H,et al.Plasma interleukin-18 levels in patients with psychiatric disorders[J].J Immunother,2002,25(Suppl 1):S68-S71.
[5]Gracie JA,Forsey RJ,Chan WL,et al.A proinflammatory role for IL-18 in rheumatoid arthritis[J].J Clin Invest,1999,104(10):1393-1401.
[6]Dao T,Ohashi K,Kayano T,et al.Interferon-gamma-inducing factor,a novel cytokine,enhances Fas ligand-mediated cytotoxicity of murine T helper 1 cells[J].Cell Immunol,1996,173(2):230-235.
[7]Anderson GP.The immunobiology of early asthma[J].Med J Aust,2002,177 (Suppl):S47-S49.
[8]Sugama S,Cho BP,Baker H,et al.Neurons of the superior nucleus of the medial habenula and ependymal cells express IL-18 in rat CNS[J].Brain Res,2002,958 (1):1-9.
[9]Mallat Z,Henry P,Fressonnet R,et al.Increased plasma concentrations of interleukin-18 in acute coronary syndromes[J].Heart,2002,88 (5):467-469.
[10]Ohshima K,Haraoka S,Takahata Y,et al.Interferon-gamma,interleukin-18,monokine induced by interferon-gamma and interferon-gamma-inducible protein-10 in histiocytic necrotizing lymphadenitis[J].Leuk Lymphoma,2002,43 (5):1115-1120.
[11]Fera MT,Carbone M,Buda C,et al.Correlation between Helicobacter pylori infection and IL-18 mRNA expression in human gastric biopsy specimens[J].Ann N Y Acad Sci,2012,963(18):326-328.
[12]Cendorglo M,Jaber BL,Balakrishnan VS,et al. Neutrophil apoptosis and dysfunction in uremia[J].J Am Soc Nephrol,1999,10(1):93-100.
[13]Daichou Y,Kurashige S,Hashimoto S,et al.Characteristic cytokine products of Th1 and Th2 cells in hemodialysis patients[J].Nephron,1999,83(3):237-245.
Analysis on interleukin-18 level in pathomechanism of adriamycin nephropathy mice
KUANGYing,QINDa
(CentralLaboratory,GuizhouProvincialPeople′sHospital,Guiyang,Guizhou550002,China)
Objective To investigate the immunity dysfunction effect of interleukin-18(IL-18) in the disease course of adriamycin nephropathy mice model(minimal change nephrosis,MCN).Methods Adriamycin(ADR) was given to Kunming mouse by once tail vein injection for inducing the minimal change nephropathy(MCN) model.The model group,normal saline control group and IL-18 antibody neutralization experimental group (mAb group)were set up.The 24 h urine protein quantitation(24 hUPQ) at 1,2 4,6 weeks was detected in the three groups.Serum was prepared by adopting the heart blood collection,and serum total protein (TP),albumin(ALB),blood urea nitrogen(BUN),creatinine(Cr),triglyceride(TG) and the total cholesterol(Tch) levels were detected in the model group and control group.The unilateral kidney was taken for conducting the pathological examination.At the same time the splenic lymphocyte suspension and the renal tissue homogenate were prepared for detecting the IL-18,INF-γ,TNF-α and IL-4 levels.Results 24 h UPQ in the model group was higher than that in the control group from 2 weeks,the difference had statistical significance(P<0.01);the serum TP,ALB,BUN,Cr,Tch,TG and the pathological examination results showed that the model mice appeared the symptoms similar to nephropathy syndrome such as hypoproteinemia,hyperlipemia.The IL-18,INF-γ and TNF-α levels in serum,renal tissue homogenate supernatant and splenic lymphocyte culture supernatant in the model group were higher than those in the control group,while the IL-4 level was lower than that in the control group,the differences between the two groups had statistical significance(P<0.01).The 24 h UPQ,IL-18,IFN-γ and TNF-α levels in the mAb group were lower than those in the model group,the differences had statistical significance(P<0.01).Conclusion The secretion of Th1 type cytokines during the mice disease course is enhanced and Th2 type cytokines are inhibited,moreover IL-18mAb play the role for partially neutralizing endogenous IL-18,which indicating that IL-18 might be an important immunity dysfunction factor in the mice MCN course.
minimal change nephrosis; adriamycin; interleukin-18
匡颖,女,硕士,主管技师,主要从事临床免疫学方面的研究。
10.3969/j.issn.1672-9455.2015.05.018
A
1672-9455(2015)05-0625-03
2014-10-26
2014-12-15)
