骨肉瘤外周血Runx3基因启动子甲基化检测及临床意义
2015-03-15陈令斌
刘 融,陈令斌,张 勇
(武汉市普仁医院:1.骨二科;2.骨一科 430081)
·临床研究·
骨肉瘤外周血Runx3基因启动子甲基化检测及临床意义
刘 融1,陈令斌2,张 勇1
(武汉市普仁医院:1.骨二科;2.骨一科 430081)
目的 研究骨肉瘤患者外周血Runt相关转录因子3(Runx3)基因启动子甲基化及临床意义。方法 选择骨肉瘤患者及健康人作为研究对象,采用甲基化特异性聚合酶链反应(MS-PCR)检测两组研究对象外周血Runx3基因启动子甲基化并比较其差异,分析骨肉瘤患者Runx3基因启动子甲基化与临床病理因素的关系。结果 骨肉瘤患者外周血Runx3基因启动子甲基化率(57.1%)显著高于健康人(2.0%),差异有统计学意义(P<0.05)。在不同性别、年龄、肿瘤部位和病理类型的骨肉瘤患者之间,外周血Runx3基因启动子甲基化率的差异无统计学意义(P>0.05),在不同KPS评分、肿瘤最大径、病理性骨折、组织学分级和Enneking分期的骨肉瘤患者之间,差异均有统计学意义(P<0.05)。KPS评分低于70分、肿瘤最大径大于或等于10 cm、有病理性骨折、组织学分级G3+G4及Enneking分期晚的骨肉瘤患者,其Runx3基因启动子甲基化率显著高于KPS评分大于或等于70分、肿瘤最大径小于10 cm、无病理性骨折、组织学分级G1+G2及Enneking分期早的骨肉瘤患者。结论 骨肉瘤患者外周血Runx3基因启动子呈高甲基化状态,与KPS评分、肿瘤最大径、病理性骨折、组织学分级和Enneking分期密切相关,可用于评估骨肉瘤患者病情及预后。
骨肉瘤; Runx3; 启动子; 甲基化; 临床意义
骨肉瘤的发病机制尚未完全明确,可能与环境及遗传因素密切相关,遗传因素包括基因突变及表观遗传学改变,其中甲基化异常是表观遗传学最常见的病因,越来越多的基因甲基化被发现参与骨肉瘤的发生和发展[1-2]。Runt相关转录因子3(Runx3)为新近发现的抑癌基因,其甲基化表达失活与胃癌等肿瘤的发病机制紧密相关[3],但在骨肉瘤中报道较少。本研究采用甲基化特异性聚合酶链反应(MS-PCR)检测骨肉瘤患者外周血Runx3基因启动子甲基化,现报道如下。
1 资料与方法
1.1 一般资料 选择2012年1月至2014年6月诊治的骨肉瘤患者为研究对象,纳入标准:(1)初次就诊,既往未行手术、放疗或化疗等治疗;(2)均经X射线、CT、磁共振成像(MRI)和病理组织学检查确诊;(3)排除合并其他肿瘤及多发患者。本组骨肉瘤患者共纳入70例,包括男43例,女27例;平均(24.1±5.8)岁。另选择门诊行健康体检的健康者50例为对照,其中男30例,女20例;平均(24.5±6.1)岁。两组研究对象在性别组成和年龄方面差异无统计学意义(P>0.05),具有可比性。
1.2 Runx3基因启动子甲基化检测 骨肉瘤患者和健康者空腹8 h后取静脉血检测Runx3基因启动子甲基化,检测方法为MS-PCR。采用MethPrimer(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)设计MS-PCR引物,见表1,反应体系为25 μL,循环条件为:95 ℃预变性10 min,95 ℃变性1 min,63 ℃退火40 s,72 ℃延伸40 s,30个循环后最后一轮72 ℃延伸10 min。MS-PCR产物经琼脂糖凝胶电泳后检测。
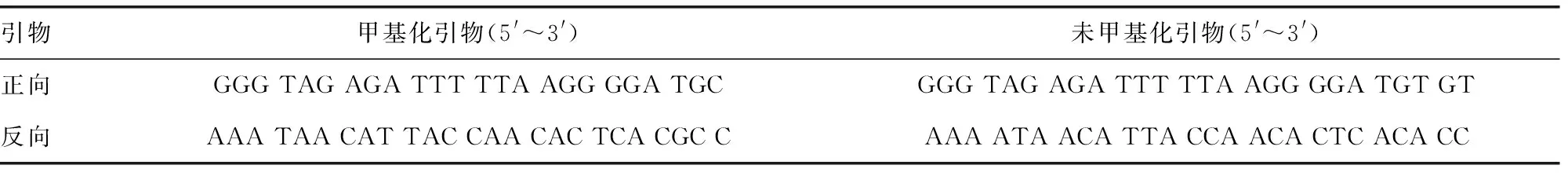
表1 Runx3基因启动子甲基化MS-PCR检测引物序列
1.3 统计学处理 采用SigmaPlot12.0进行统计学分析。不同临床病理因素中Runx3基因启动子甲基化率的差异采用χ2检验。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 Runx3基因启动子甲基化对比 70例骨肉瘤患者中有40例外周血基因启动子检测到甲基化,Runx3基因启动子甲基化率为57.1%;50例健康者中有1例外周血基因启动子检测到甲基化,Runx3基因启动子甲基化率为2.0%,骨肉瘤患者外周血Runx3基因启动子甲基化率显著高于健康者(χ2=37.016,P<0.05)。
2.2 Runx3基因启动子甲基化与临床病理因素的关系 在不同性别、年龄、肿瘤部位和病理类型的骨肉瘤患者之间,外周血Runx3基因启动子甲基化率的差异无统计学意义(P>0.05),在不同KPS评分、肿瘤最大径、病理性骨折、组织学分级和Enneking分期的骨肉瘤患者之间,差异均有统计学意义(P<0.05)。KPS评分低于70分、肿瘤最大径大于或等于10 cm、有病理性骨折、组织学分级G3+G4及Enneking分期晚的骨肉瘤患者Runx3基因启动子甲基化率显著高于KPS评分大于或等于70分、肿瘤最大径小于10 cm、无病理性骨折、组织学分级G1+G2及Enneking分期早的骨肉瘤患者,见表2。

表2 不同临床病理因素骨肉瘤患者中Runx3基因启动子甲基化率比较(n)

续表2 不同临床病理因素骨肉瘤患者中Runx3基因启动子甲基化率比较(n)
3 讨 论
骨肉瘤的发病机制尚未完全明确,主要与基因突变及表观遗传学等遗传因素有关,表观遗传学因素主要包括甲基化,越来越多的基因甲基化表达沉默被证实参与了肿瘤的发生和发展[4]。甲基化不依赖于DNA碱基突变,自身结构或结合甲基结合蛋白可调控基因表达,为基因转录前调控最常见的作用机制[5],在越来越多的肿瘤中检测到甲基化改变,在肿瘤的早期诊断、病情及预后评估中扮演重要角色[6]。Runx3基因是新近发现的抑癌基因,主要通过调控TGF-β信号传导通路而发挥调控细胞周期的功能,其表达水平下降导致正常细胞失去调控而发生癌变,在越来越多的肿瘤中可检测到Runx3基因的甲基化表达失活状态[7]。研究表明,与Runx3基因同家族的Runx2基因在骨肉瘤组织中mRNA表达低于健康人[8],进一步研究发现其处于高甲基化沉默状态,基于Runx3基因与Runx2基因功能类似,推测Runx3基因启动子甲基化可能与骨肉瘤的发病机制密切相关。本研究中骨肉瘤患者外周血Runx3基因启动子甲基化率(57.1%)显著高于健康者(2.0%),差异有统计学意义(P<0.05),证实了Runx3基因启动子甲基化与骨肉瘤发病机制的相关性。
在消化系统和生殖系统肿瘤中可检测到Runx3基因的高甲基化状态,进一步发现其甲基化水平与临床病理因素相关,可作为其诊断、病情及预后评估的标志物,较蛋白质标志物具有更高的灵敏度及特异性[9],基于这些证据,推测Runx3基因启动子甲基化可能与骨肉瘤的病情及预后密切相关。在不同性别、年龄、肿瘤部位和病理类型的骨肉瘤患者之间,外周血Runx3基因启动子甲基化率的差异无统计学意义(P>0.05);在不同KPS评分、肿瘤最大径、病理性骨折、组织学分级和Enneking分期的骨肉瘤患者之间,差异均有统计学意义(P<0.05)。KPS评分低于70分、肿瘤最大径大于或等于10 cm、有病理性骨折、组织学分级G3+G4及Enneking分期晚的骨肉瘤患者Runx3基因启动子甲基化率显著高于KPS评分大于或等于70分、肿瘤最大径小于10 cm、无病理性骨折、组织学分级G1+G2及Enneking分期早的骨肉瘤患者。这些证据表明,Runx3基因启动子甲基化与其他肿瘤类似,在骨肉瘤的病情及预后评估中扮演重要角色。本研究仅检测骨肉瘤患者外周血Runx3基因启动子甲基化,推测骨肉瘤组织中可能存在Runx3基因启动子甲基化状态,与手术切除标本对比,外周血标本可能更具有前瞻性的优点,在临床应用中更具有价值。
吴同申等[9]采用流式细胞仪检测了骨肉瘤中Runx3蛋白质的表达水平,发现Runx3在骨肉瘤中的表达水平明显低于良性肿瘤,骨肉瘤中Runx3表达水平在不同软组织浸润及不同Ennecking分期的比较中有显著差异,说明Runx3蛋白质检测对判断预后有一定价值。进一步研究发现,除Hs888T细胞系的Runx3基因的启动子区域CpG岛可发生广泛甲基化外,MG63、G292、Hs919T、saos2、Hs860T、Hs707A、HOS等细胞系的Runx3启动子区域CpG岛仅发生部分甲基化[10];实时荧光定量PCR显示,MG63、saos2、G292等骨肉瘤细胞系可见明显的Runx3表达,Hs919T、Hs707A、HOS等骨肉瘤细胞系也有不同程度的Runx3表达,实验结果表明在骨肉瘤细胞系中未见明显的Runx3表达异常,在Runx3启动子区域CpG岛没有发生广泛甲基化等表观遗传学异常改变,但本研究中骨肉瘤患者外周血Runx3基因启动子甲基化率显著高于健康者,证实了Runx3基因启动子甲基化与骨肉瘤发病机制的相关性,与前述研究结论相反,可能与细胞和人体表达不一致有关,有待于进一步研究证实。
[1]章振华.骨肉瘤蜡块组织中RASSF1A,DAPK基因启动子区域的甲基化研究[D].合肥:安徽医科大学,2012.
[2]罗一.PTEN甲基化在骨肉瘤发生中的作用及5-AzA-CdR去甲基化对其MG-63 细胞生物学行为的影响[D].长沙:中南大学,2013.
[3]杨国祥,杜寒松,张万里,等.淋巴结 RUNX3 基因甲基化与胃癌临床病理因素的关系研究[J].检验医学与临床,2014,11(6):801-802.
[4]侯贝贝,王妍,张娟,等.软骨肉瘤WIF-1基因甲基化及Wnt-5a蛋白表达的临床病理意义[J].山东大学学报:医学版,2013,51(2):70-74.
[5]赵丹,郑威强,张万里.外周血 RUNX3 基因甲基化在胃癌中的临床价值[J].检验医学与临床,2013,10(18):2451-2453.
[6]李琦,胡昌华,张婧.宫颈脱落细胞 RASSF1A 基因甲基化在宫颈癌中的临床意义[J].检验医学与临床,2013,10(12):1518-1519.
[7]唐国华,孙少卫,贺修胜.Runx3基因CpG岛甲基化与胃癌发生的关系[J].中华病理学杂志,2012,41(5):314-319.
[8]张洁林,闵大六,姚阳.Runx2基因与骨肉瘤研究进展[J].癌症进展,2011,9(3):274-278.
[9]吴同申,彭圣智,孟彦.流式细胞术检测骨肉瘤中RUNX3和β-catenin的表达及意义[J].中国现代医生,2013,50(32):4-5.
[10]张海元,刘娟.骨肉瘤细胞系中Runx3及Runx2基因表达分析[J].长江大学学报自然科学版:医学卷,2008,4(4):325-327.
10.3969/j.issn.1672-9455.2015.07.044
A
1672-9455(2015)07-0978-02
2014-10-05
2014-11-22)