一种新型肠道病毒核酸检测试剂的初步评价*
2015-03-15黄长武单幼兰谭俊杰张晓清
黄长武,单幼兰,唐 彦,谭俊杰,张晓清
(1.重庆医科大学附属第二医院检验科 400010;2.重庆医科大学附属第二医院传染病实验室 400010;3.重庆市中医骨科医院检验科 400012;4.重庆医科大学附属儿童医院分子生物实验室 400014;5.重庆医科大学检验医学院 400016)
·论 著·
一种新型肠道病毒核酸检测试剂的初步评价*
黄长武1,单幼兰2,唐 彦3△,谭俊杰4,张晓清5
(1.重庆医科大学附属第二医院检验科 400010;2.重庆医科大学附属第二医院传染病实验室 400010;3.重庆市中医骨科医院检验科 400012;4.重庆医科大学附属儿童医院分子生物实验室 400014;5.重庆医科大学检验医学院 400016)
目的 评价新型磁珠法肠道病毒核酸检测试剂(以下简称“磁珠法试剂”)的灵敏度和精密度。方法 对204份标本分别用磁珠法试剂和Trizol法试剂进行肠道病毒RNA定性检测,评价其一致性和等效性,并比较两种试剂的灵敏度和精密度。结果 磁珠法试剂与Trizol法试剂的阳性符合率为97.58%,阴性符合率为100.00%,总符合率为98.53%,Kappa值为0.969 4。磁珠法试剂的灵敏度高于Trizol法试剂。对两个中、低浓度标本各重复检测10次,磁珠法试剂的变异系数(CV)为0.84%、0.96%,Trizol法试剂为2.01%、1.43%。结论 新型磁珠法试剂盒与Trizol法试剂盒具有较高的一致性,其灵敏度、精密度优于Trizol法试剂盒,可以用于临床肠道病毒核酸检测。
肠道病毒; 磁珠法; Trizol法; 内标
肠道病毒是引起手足口病的主要病原体。肠道病毒感染会引起发热和手、足、口腔等部位的皮疹或疱疹,少数患者可能出现无菌性脑膜炎、脑炎、急性弛缓性麻痹、神经源性肺水肿和心肌炎等,个别重症患儿病情进展快,可导致死亡[1-3]。
目前,国内检测肠道病毒一般采用Trizol法提取核酸,需要多次离心、洗涤、吸弃废液等一系列繁琐操作过程,在操作过程中存在标本交叉污染的风险,而且大部分试剂没有预防假阴性的内标监控系统,影响检测结果的准确性和重复性。在国家传染病防治重大专项的支持下,基于磁珠法核酸提取的国产检测试剂已成为主流研发方向。本研究对新型磁珠法肠道病毒核酸检测试剂(以下简称“磁珠法试剂”)进行灵敏度、精密度和临床应用质量考评[4-7]。
1 资料与方法
1.1 一般资料 收集2013年1月至2014年5月重庆医科大学附属儿童医院和重庆市中医骨科医院(解放碑社区卫生服务中心、南纪门社区卫生服务中心)咽拭子标本204份,其中男128例,女76例,年龄1~9岁。手足口病按照原卫生部颁布的《手足口病诊疗指南》(2010年版)进行确诊。
1.2 仪器与试剂 磁珠法试剂购自湖南圣湘生物科技有限公司;对比的Trizol法试剂购自广州达安基因生物科技有限公司。按照两种试剂盒的说明书步骤,分别进行核酸提取和检测,上机检测在LifeTechnology公司的ABI 7500实时荧光定量PCR仪上进行。
1.3 方法
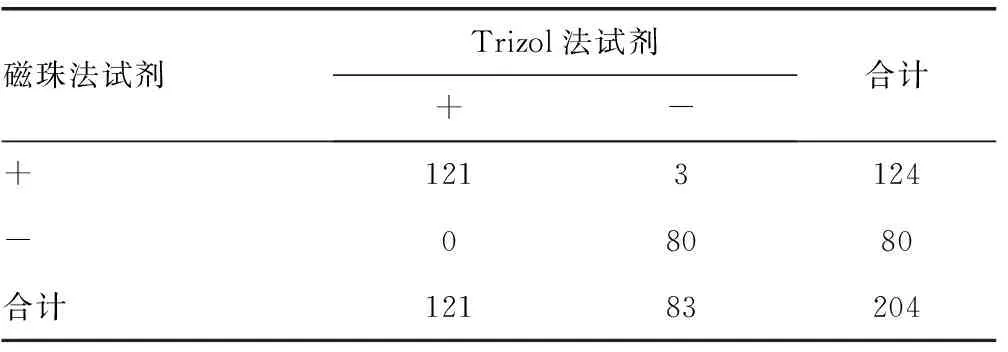
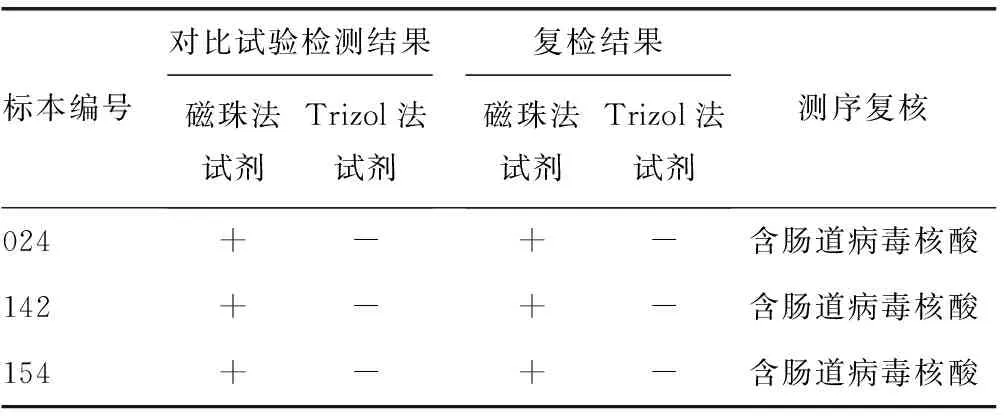
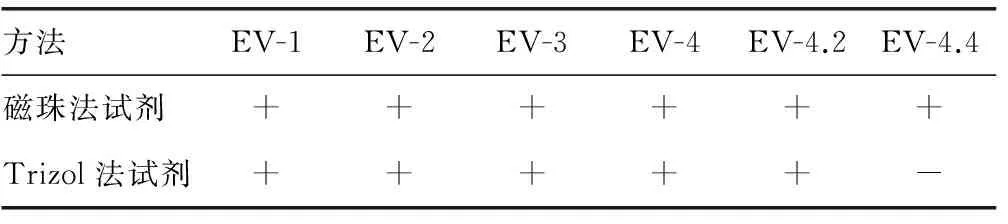
1.3.1 临床标本试验 对204例咽拭子临床标本提取核酸后,在荧光定量PCR仪上进行检测,计算两种试剂的一致性和Kappa值,对Kappa值的参考评价原则如下:0.75 1.3.2 磁珠法操作步骤 在1.5 mL灭菌离心管中依次加入600 μL RNA提取溶液1、200 μL待测标本、100 μL RNA提取溶液2,混匀10 s后,室温静置30 min;瞬时离心后,将离心管置于分离器上,3 min后吸弃废液;向离心管中依次加入600 μL RNA提取溶液3、200 μL RNA提取溶液4,震荡混匀5 s,将离心管置于分离器上,3 min后吸弃废液;向离心管中加入30 μL RNA洗脱液,冲洗磁珠,室温静置10 min,将离心管置于分离器上,静置3 min,将核酸溶液移入新的离心管中。 1.3.3 Trizol法操作步骤 在1.5 mL灭菌离心管中依次加入标本500 μL、Trizol试剂 500 μL,充分混匀,室温放置10 min;加入200 μL氯仿,拧紧离心管盖,用力震荡离心管,直至溶液充分乳化,呈乳白状、无分相现象,室温静置10 min;于4 ℃、13 000 r/min离心15 min,吸取上层液相移入另一离心管;加入等体积异丙醇,轻轻颠倒离心管,充分混匀液体,室温放置10 min;于4 ℃、13 000 r/min离心15 min,弃上清液;向离心管内加入75%乙醇1 mL,震荡混匀,于4 ℃、13 000 r/min离心10 min,弃上清液,在超净台中干燥5 min;向离心管内加入试剂盒中的焦碳酸二乙酯(DEPC)水50 μL,溶解核酸。 1.3.4 灵敏度试验 选取1例强阳性肠道病毒标本,用生理盐水稀释10、100、1 000、10 000、20 000、40 000倍;分别标记为EV-1、EV-2、EV-3、EV-4、EV-4.2、EV-4.4。用磁珠法和Trizol法检测后,选取两种方法中,临界阳性较高检出限梯度浓度和下一个梯度浓度标本作为灵敏度检测标本,每个标本重复检测20次,计算标本的阳性率,考察试剂的灵敏度。 1.3.5 精密度试验 从上述梯度标本中选取EV-2、EV-4(中、低)两个浓度作为精密度检测标本,每个标本重复检测10次,计算标本的变异系数(CV),考察试剂的精密度。 1.4 统计学处理 数据采用SPSS15.0软件包进行统计学处理,一致性分析采用Kappa检验,以P≤0.05为差异有统计学意义。 2.1 临床检测结果及分析 2.1.1 两种方法对204份标本的检测结果 两种方法的阳性符合率为97.58%,阴性符合率为100.00%,总符合率为98.53%,见表1。经统计学处理,Kappa=0.969 4,P<0.05。在α=0.05检验水准下,磁珠法试剂和Trizol法试剂及复核检测结果的一致性有统计学意义,提示诊断一致性好。表明磁珠法试剂与Trizol法试剂对临床标本的检测结果具有等效性,准确度更好。 表1 磁珠法试剂与Trizol法试剂检测结果比较(n) 2.1.2 不符标本的复核结果及分析 将3份磁珠法试剂与Trizol法试剂的检测结果不符标本进行复检,对复检不符的标本再进行测序复核,复检及测序的结果见表2。检测结果不一致标本产生原因的分析:上述3份标本,磁珠法试剂盒检测为阳性,Trizol法试剂盒检测为阴性,经测序复核为阳性。可能是由于这些标本的病毒载量较低,Trizol法试剂盒在提取低浓度标本时,容易出现操作失误,没有提取到肠道病毒核酸;也有可能是这些标本在Trizol法试剂盒引物探针设计的区域基因发生稀有突变,导致无法检出。 表2 不符合标本检测及复检复核结果 2.1.3 内标系统对检测结果的影响 在临床标本的检测结果中,有6份标本磁珠法和Trizol法检测目标基因均为阴性,但是磁珠法内标通道结果也为阴性,由此判断为假阴性。将标本稀释10倍后用磁珠法和Trizol法检测目的基因均为阳性。内标监测了标本提取和检测的整个过程,对内标的结果进行分析后可以采取相应的对策,保证检测结果的准确性。 2.2 灵敏度结果比较 梯度标本检测结果见表3,发现磁珠法试剂的最低检出限低于Trizol法试剂,Trizol法的临界阳性标本检出浓度为EV-4.2的浓度,所以选取EV-4.2、EV-4.4两个标本的浓度作为灵敏度试验标本,两个标本采用两种试剂各检测20次,计算标本的阳性率,磁珠法试剂检测EV-4.2、EV-4.4的阳性率均为100.00%,而Trizol法试剂检测EV-4.2的阳性率为50.00%,检测EV-4.4的阳性率为0.00%,磁珠法试剂的灵敏度高于Trizol法试剂。 表3 梯度标本检测结果 2.3 精密度结果比较 磁珠法试剂对EV-2、EV-4两个标本重复10次检测的CV值分别为0.84%、0.96%,Trizol法试剂的CV值分别为2.01%、1.43%。磁珠法试剂的CV值均小于Trizol法试剂的CV值,说明磁珠法试剂的精密度优于Trizol法试剂。 病毒核酸检测是基于核酸扩增检测技术的体外诊断技术,目前已经广泛用于病原体检测、特定疾病的早期诊断和基因型别鉴定等不同领域,而核酸的提取是核酸检测中的关键步骤。目前常用的核酸提取方法有加热裂解法、酚-氯仿抽提法、柱提法等[8],这些方法都采用手工操作,需要加热、反复离心、洗涤等比较繁琐的过程。由于操作方法上的缺陷,在处理大量临床标本时,容易造成标本间的交叉污染和核酸丢失,导致检测结果出现假阳性和假阴性,影响检测结果的准确性和重复性。磁珠法是近年发展迅速且被广泛应用的一种核酸提取方法,它将生物科学和纳米材料科学结合,具有传统核酸提取方法无法比拟的优势,主要体现在:操作简单、用时短,整个提取流程只有裂解、结合、洗涤、洗脱4步,大多可以在30~90 min完成;安全无毒,不使用传统方法中的苯、氯仿等有毒试剂,对试验操作人员的伤害减少到最少;提取效率高,磁珠与核酸的特异性结合使得提取的核酸纯度高、浓度大;可实现自动化、大批量操作,目前已有96孔的核酸自动提取仪,用一个样品的提取时间即可实现对96个样品的处理,满足临床大批量标本检测的需求。 本研究运用磁珠法试剂盒和传统的Trizol法试剂盒,对204例肠道病毒临床标本进行检测。发现磁珠法试剂与Trizol法试剂的阳性符合率为97.58%,阴性符合率为100.00%,总符合率为98.53%。对此结果进行Kappa检验一致性分析,结果表明磁珠法试剂与Trizol法试剂检测的诊断结果具有很好的一致性,符合临床检测要求。在临床检测的过程中,还发现了6份标本的目的基因检测结果为阴性,而磁珠法内标通道也为阴性,由此推断这6例标本的结果可能是假阴性。将这些标本稀释后复检,证实为阳性。分析造成假阴性的原因,可能是由于标本中含有PCR抑制物,经提取后仍未能去除;也可能是操作过程中失误,没有提取到病毒核酸造成的。当检测结果为阴性的标本内标通道也为阴性时,试验操作人员可以通过稀释标本(稀释抑制物)或重新提取的方法进行复查,从而获得准确的检测结果。在我国医药行业标准YY/T 1182-2010《核酸扩增检测用试剂(盒)》中,对我国最常见的传染病HIV、HBV、HCV核酸扩增试剂盒产品设计要求中规定:在产品设计中,应加入全程参与的内标。可见内标系统的设计是重要且必要的。 通过磁珠法试剂和Trziol试剂对肠道病毒低浓度标本的灵敏度对比检测,发现磁珠法试剂的阳性检出率高,说明磁珠法试剂的灵敏度较高。对肠道病毒中、低浓度标本进行精密度检测,发现磁珠法试剂检测结果的CV值小于Trizol法试剂的CV值,说明磁珠法试剂的重复性较好。 综上所述,磁珠法是一种快速有效的病毒核酸提取方法,其内标系统可预防假阴性,在检测结果的分析中起到重要作用。湖南圣湘生物科技有限公司的新型磁珠法肠道病毒核酸检测试剂盒,将这两个技术有机地结合起来,是一种灵敏度高、精密度好、可靠的肠道病毒核酸检测试剂,具有较高的临床应用价值。 [1]Kaku Y,Sarai A,Murakami Y.Genetic reclassification of porcine enteroviruses[J].J Gen Virol,2001,82(2):417-424. [2]Hyypia T,Hovi T,Knowles NJ,et al.Classification of enteroviruses based on molecular and biological properties[J].J Gen Virol,1997,78(1):1-11. [3]Miura T,Masago Y,Sano D,et al.Development of an effective method for recovery of viral genomic RNA from environmental silty sediments for quantitative molecular detection[J].Appl Environ Microbiol,2011,77(12):3975-3981. [4]Knepp JH,Geahr MA,Forman MS.Comparison of automated and manual nucleic acid extraction methods for detection of enterovirus RNA[J].J Clin Microbiol,2003,41(8):3532-3536. [5]Hamilton MS,Jackson MA,Abel D,et al.Clinical utility of polymerase chain reaction testing for enteroviral meningitis[J].Pediatr Infect Dis J,1999,18(6):533-537. [6]Oberste MS,Schnurr D,Maher K,et al.Molecular identification of new picornaviruses and characterization of a proposed enterovirus 73 serotype[J].J Gen Virol,2001,82(2):409-416. [7]Nijhuis M,Van MN,Schuurman R,et al.Rapid and sensitive routine detection of all members of the genus enterovirus in different clinical specimens by real-time PCR[J].J Clin Microbiol,2002,40(10):3666-3670. [8]Verheyden B,Thielemans A,Rombaut B,et al.RNA extraction for quantitative enterovirus RT-PCR:comparison of three methods[J].J Pharm Biomed Anal,2003,33(4):819-823. Preliminary evaluation of a new reagent of enterovirus nucleic acid detection* HUANGChang-wu1,SHANYou-lan2,TANGYan3△,TANJun-jie4,ZHANGXiao-qing5 (1.DepartmentofClinicalLaboratory,theSecondHospitalofChongqingMedicalUniversity,Chongqing400010,China;2.InfectiousDiseasesLaboratory,theSecondHospitalofChongqingMedicalUniversity,Chongqing400010,China;3.DepartmentofClinicalLaboratory,ChongqingChineseMedicineOrthopaedicHospital,Chongqing400012,China;4.MolecularBiologyLaboratory,Children′sHospitalofChongqingMedicalUniversity,Chongqing400014,China;5.InspectionMedicalSchoolofChongqingMedicalUniversity,Chongqing400016,China) Objective To evaluate the quality of the new beads method reagent for enterovirus detection(hereinafter referred to "beads method")and the role of inter control system.Methods A total of 204 clinical specimens were qualitatively detected by beads method and Trizol assay. The consistency and equivalence of two assays were evaluated.The sensitivity and precision of two assays were compared.Results Comparing beads method with Trizol assay,the positive consistency was 97.58%,the negative consistency was 100.00%,the total consistency was 98.53%,andKappavalue was 0.969 4. One sample with medium concentration and one sample with high concentration were respectively detected 10 times for the calculation of precision. TheCVsof beads method were 0.84% and 0.96%,for the medium and high concentration sample respectively,while those of Trizol assay were 2.01% and 1.43% respectively.Conclusion The new beads method kit has high consistency with Trizol method kit,which shows better sensitivity and precision than Trizol method and can be used for enterovirus detection in clinical. enterovirus; beads method; Trizol method; inter control 重庆市渝中区科技三费资助科技计划项目(20130143)。 黄长武,男,副主任检验师,硕士,主要从事细菌致病与耐药研究。△ ,E-mail:yan77526@yeah.net。 10.3969/j.issn.1672-9455.2015.07.012 A 1672-9455(2015)07-0907-03 2014-10-05 2014-12-28)2 结 果
3 讨 论