乙型肝炎病毒核苷类药物耐药突变和基因型研究
2015-03-15许建平钟国权广东省河源市源城人民医院检验科517000
许建平,钟国权(广东省河源市源城人民医院检验科 517000)
乙型肝炎病毒核苷类药物耐药突变和基因型研究
许建平,钟国权(广东省河源市源城人民医院检验科 517000)
目的 研究聚合酶链反应-连接酶检测反应(PCR-LDR)检测乙型肝炎(下称乙肝)病毒核苷类药物耐药位点和基因型的可行性。方法 运用多重LDR和PCR原理,在乙肝病毒基因相关区域设计引物和探针检测突变位点和基因型。结果 156例临床样本中,B型占60.90%(95/156),C型占37.20%(58/156),非B非C型占1.90%(3/156)。此外共检出56例样本存在突变,其中拉米夫定耐药突变41例。结论 本研究显示拉米夫定耐药突变主要在rtM204I/V和rtL180M,阿德福韦以rtN236T/rtA181V为主;恩替卡韦一般联合拉米夫定耐药,并且发生耐药突变以B型为多。
耐药; 突变; 基因型
根据最新流行病学调查表明,我国乙型肝炎(下称乙肝)病毒(HBV)携带者达到1亿人左右,其中慢性乙肝患者超过2 000万人。HBV持续感染与肝炎、肝硬化、肝癌的发生密切相关。目前,临床长期广泛使用核苷类药物,该类药物长期使用,会使慢性乙肝患者体内HBV出现不同程度对核苷类药物耐药突变。此外,HBV基因型是病毒长期变异进化的结果,不同基因型反映了HBV变异进化特点,并且与肝病临床表现、预后存在一定相关性。聚合酶链反应-连接酶检测反应(PCR-LDR)是一种最新的单核苷酸多态性(SNP)检测方法,PCR-LDR可通过一次扩增检测产物中的多个突变位点[1-6]。本研究通过该方法检测HBV常见耐药突变和基因型,现报道如下。
1 资料与方法
1.1 一般资料 研究标本取自2012年3月至2014年3月广东省河源地区156例慢性乙肝患者,均符合2000年肝炎防治会议制定的诊断标准。其中男98例,女58 例,年龄26~69岁,平均46.5岁。
1.2 方法
1.2.1 标本采集 采集慢性乙型肝炎患者空腹不抗凝静脉血5 mL,2 500 r/min离心10 min,分离血浆至专用血浆保存管,-20 ℃储存备用。
1.2.2 DNA提取 使用Qiagen DNA Mini Kit试剂盒(德国),按照试剂说明书从200 mL血浆中提取血浆HBV DNA。
1.2.3 主要试剂 乙肝耐药和分型检测试剂盒购自上海星耀医学科技发展有限公司,其中TaqDNA ligase酶和dNTP来自上海英俊,Taq酶来自大连宝生物公司。PCR引物和LDR探针和序列见表1。
1.2.4 主要仪器 ABI3130 DNA测序仪(美国ABI公司),MJ2000 PCR仪(美国Agilent公司)。
1.2.5 PCR和LDR扩增体系和条件 PCR扩增体积50 μL体系,包括10 μL PCR缓冲溶液,10 pmol引物2 μL,2 U DNA聚合酶(TaKaRa),5 μL HBV DNA模板,补充蒸馏水至50 μL。PE9600 PCR仪进行扩增,95 ℃ 4 min,94 ℃ 30 s、55 ℃ 40 s、72 ℃ 60 s,循环40次,然后72 ℃延伸10 min。LDR反应20 μL体系,包括2 μL PCR缓冲溶液,3 μL PCR扩增产物,1 U DNA连接酶,补充蒸馏水至20 μL进行LDR,95 ℃变性2 min,95 ℃ 30 s和65 ℃ 2 min,循环25次。2.5 μL LDR产品与上样缓冲液等体积混合。将混合物在94 ℃持续2 min变性,急速冷冻。然后ABI3130 DNA测序仪电泳30 min。结果采用GeneMapper4.0软件分析。
1.3 统计学处理 采用SPSS 17.0统计软件进行分析,计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 HBV基因型结果 156例 HBV基因型分别为:B型60.90%(94/156),C型37.20%(64/156),非B非C型1.90%(3/156)。HBV基因型以B型为主。在各基因型中均可检出耐药基因突变,基因型B型和C型中耐药基因突变差异无统计学意义(χ2=4.157,P>0.05),见表2。

表1 HBV基因PCR引物和LDR探针序列
注:-表示无数据。

表2 不同基因型核苷类药物耐药基因发生例数(n)
2.2 HBV基因突变结果 在156例样本中共56例检出耐药,占33.98%(56/156)。4种核苷类药物耐药基因检出率各异,41例检出rtM204I及其混合突变,为拉米夫定(LAM)耐药,占75.00%(42/56)。单一点突变32.14(18/56),多耐药突变67.86(38/56),其中检出5例拉米夫定/替比夫定(LDT)/阿德福韦(ADV)共同耐药。见表3。
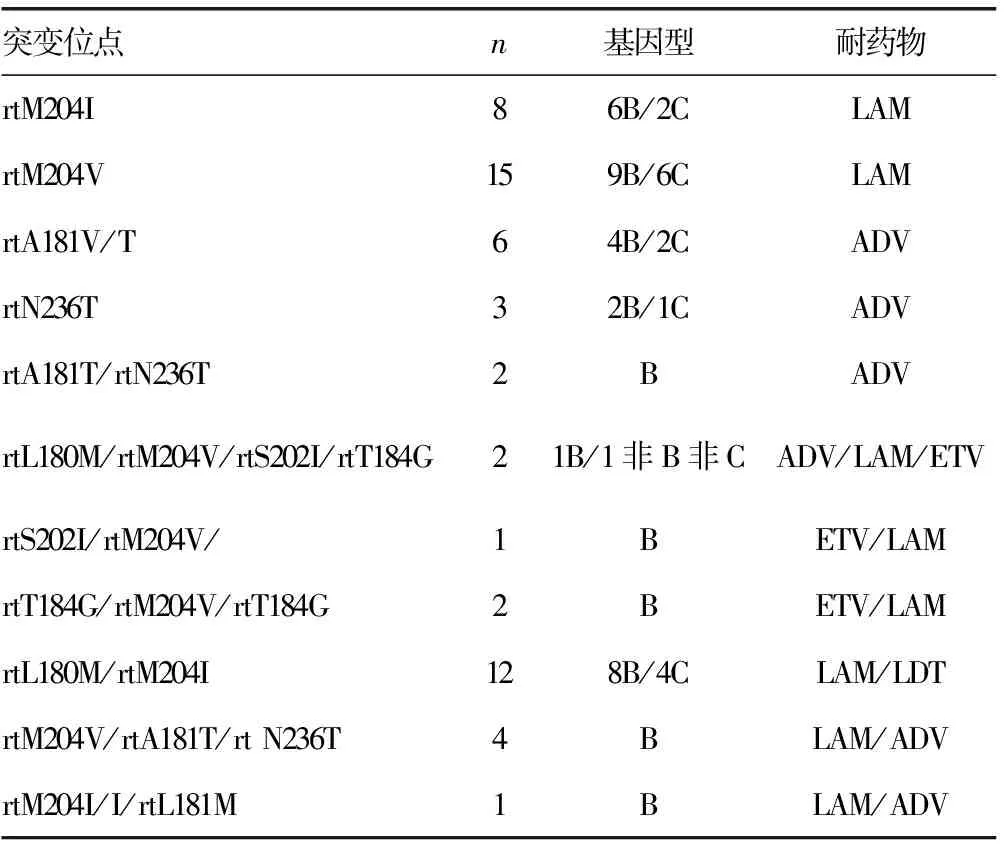
表3 34例不同核苷类药物耐药基因突变位点分析
注:ETV为恩替卡韦。
2.3 PCR-LDR方法验证 从56例HBV 耐药变异样本中随机挑选20例,PCR扩增后送上海英俊公司测序,所得测序结果在DNA star软件上比对,19例测序结果与PCR-LDR耐药变异一致,1例测序结果没有变异,PCR-LDR与金标法测序一致性为95%。本方法通过检测丙型肝炎病毒样本、人巨细胞病毒样本等非HBV样本,所得结果均为阴性,特异性为100%。
3 讨 论
对于HBV核苷酸类似物耐药的检测,欧美国家多采用IN-NO-LIPA方法,其灵敏度和特异性都比较高,但试剂盒非常昂贵,在我国尚难推广普及。目前国内检测HBV基因耐药变异的方法主要有以下几种,各有优缺点。实时PCR操作简便,可检测变异发生率低于10%的耐药变异。缺点为仅能检测已知位点,同样难以实现一次进行多个耐药突变位点检测;同时,针对每个位点不同变异均需合成相应的探针。随着耐药位点增多,相应合成探针的费用增高。PCR产物直接测序:PCR产物直接测序法可检测已知和可能的未知耐药变异位点,是最常用的基因型耐药检测方法之一。PCR产物直接测序的方法应作为基因型耐药检测的金标准,该方法的缺点是灵敏度较差,只有当变异株超过HBV准种池的20%时才能被发现。
PCR-LDR是一种新兴的单SNP分型检测方法。其原理是高温连接酶检测到模板DNA与2条探针DNA的接头处存在碱基错配,则连接反应不能进行;即如果探针与模板有1个碱基不配对,连接反应不能进行,如果探针与模板完全互补,连接反应完成。与其他检测技术相比,LDR检测技术拥有准确度高、通用性强、通量大、操作简单、成本低等众多明显优势[6]。
本研究结果显示,河源地区HBV基因B型占60.90%,C型占37.20%,非B非C型占1.90%,与左兴等[7]广东地区HBV基因型(62.00%为B型,33.00%为C型)基本一致。LAM耐药突变目前报道发现的与LAM相关的主要耐药突变有rtM204V、rtM204I和rtL180M,其他突变位点有rtL80V/I、rtI169T、rtV173L等;ADV相关的耐药突变多为多点突变,目前得到学界公认的主要耐药位点有rtA181T、rtA181V和rtN236T;ETV的耐药变异需要在rtM204+rtL180位突变的基础上,再联合rtT184、rtS202、rtM250和rtI169位点上一个或多个氨基酸突变;LDT主要与M204I变异相关[8-12]。本研究结果显示,LAM耐药突变主要在rtM204I/V和rtL180M,LDT耐药突变与LAM相同,没有检测到其他突变位点。ADV以rtN236T/rtA181V为主;ETV一般联合LAM耐药,并且发生耐药突变以B型为多。
本研究与金标法测序进行比对,二者一致性达到95%,1例PCR-LDR阳性样本测序阴性,通过第3种方法RealTime-PCR检测为阳性变异,通过相对定量估测其突变比率在10%左右,说明该样本测序阴性主要是灵敏度较低造成的。PCR-LDR在检测丙型肝炎病毒、人巨细胞病毒等非HBV样本时均为阴性,特异性达到100%。以上验证说明该方法的准确性和特异性均达到高值[9-10]。
目前报道了核苷类药物的一部分耐药位点,但新的耐药突变位点不断被发现,而目前应用于临床的、可全面反映基因耐药情况、有效指导临床药物选择的检测方法十分有限。本研究采用简便和快速的PCR-LDR检测HBV基因型和核苷类药物耐药基因突变位点,较现有方法具有明显优势。因此,在现有HBV基因耐药突变研究的基础上,建立起适合临床的全面检测HBV耐药突变的新技术,制订更加合理的抗病毒治疗方案,对可能耐药的患者进行相关耐药方面的检测,及时调整治疗方案,具有非常重要的临床意义。
[1]中华医学会传染病与寄生虫病学分会,肝病分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(6):324-329.
[2]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华传染病杂志,2011,29(1):65-80.
[3]徐立中,谢金娜,彭运生.乙型肝炎病毒表面抗原与原发性肝癌的相关性分析[J].河北医学,2008,14(4):406-408.
[4]刘传苗,张欣欣,陆志檬.拉米夫定治疗中乙型肝炎病毒YMDD野毒株和变异株的变化[J].肝脏,2004,9(2):73-76.
[5]刘锦屏,刘友德,杨绍萍,等.烟台地区原发性肝癌患者乙肝病毒基因型分析[J].中华保健医学杂志,2010,12(5):355-357.
[6]张智,张珍,李楠,等.185例广东人乙型肝炎病毒基因分型及耐药基因检测[J].广东医学,2008,29(1):97-98.
[7]左兴,谢奇峰,杨林,等.广东地区HBV基因型在家庭聚集感染中的分布及意义[J].中山大学学报:医学科学版,2009,30(S3):19-24.
[8]Xiao Z,Xiao J,Jiang Y.A novel method based on ligase detection reaction for low abundant YIDD mutants detedtion in hepatitis B virus[J].Hepatology Res,2006,34(3):150-155.
[9]Wang YZ,Xiao JH,Ruan LH,et al.Detection of the rtA181V/T and rt236T nutations associated with resistance to adefovir dipivoxil using a ligase detection reatction assay[J].Clin Chim Acta,2009,408(1/2):70-74.
[10]Matetzky S,Sharir T,Domingo M,et al.Elevated troponin Ilevel on admission is associated with adverse outcome of prim ary angioplasty in acute myocardial infarction[J].Circulation,2000,102(14):161-166.
[11]Orito E,Ichida T,Sakugawa H,et al.Geographic distribution of hepatitis B virus (HBV) genotype in patients with chronic HBV infection in Japan[J].Hepatology,2001,34(3):590-594.
[12]Krucoff MW,Johanson P,Baeza R,et al.Clinical utility of serial and continuous ST segment recovery assessment in patients with acute ST elevation m yocardial infarction:assessing the dynamics of epieardial and myocardial reperfusion[J].Circulation,2004,110(25):533-539.
Study on nucleoside analogue-resistant mutataion and genotyes in hepatitis B virus
XUJian-ping,ZHONGGuo-quan
(DepartmentofClinicalLaboratory,YuanchengPeople′sHospital,Heyuan,Guangdong517000,China)
Objective To study the feasibility of PCR-LDR assay for detedting nucleoside analogue resistant loci and genotypes of hepatitis B virus (HBV).Methods The multiplex LDR and PCR principle was used to design primers and probes in the HBV related regions for detecting mutation loci and genotypes.Results 156 clinical samples,B type accounted for 60.90% (95/156),C type accounted for 37.20% (58/156);non-B non-C type accounted for 1.90% (3/156).Further 56 samples of mutations were detected,in which 41 cases were lamivudine-resistant mutations.Conclusion This study shows that lamivudine resistance mutations are mainly in rtM204I/V and rtL180M,adefovir resistance is dominated by rtN236T/rtA181V;entecavir plus lamivudine are resistant in general.And the occurrence of resistant mutations is mainly B-type.
resistance; mutation; genotype
许建平,男,本科,主管技师,主要从事病原微生物临床检验方面的研究。
10.3969/j.issn.1672-9455.2015.09.024
A
1672-9455(2015)09-1240-03
2014-11-01
2015-01-28)
