Innovance测定血浆D-二聚体的分析性能评价*
2015-03-15白著晓刘慧敏姜宏兵邓朝晖梁学立石河子大学医学院新疆石河子83000新疆生产建设兵团医院石河子大学医学院第二附属医院检验科乌鲁木齐83000
白著晓,刘慧敏,姜宏兵,邓朝晖,梁学立,张 新△(1.石河子大学医学院,新疆石河子 83000;.新疆生产建设兵团医院/石河子大学医学院第二附属医院检验科,乌鲁木齐 83000)
Innovance测定血浆D-二聚体的分析性能评价*
白著晓1,2,刘慧敏2,姜宏兵2,邓朝晖2,梁学立2,张 新2△(1.石河子大学医学院,新疆石河子 832000;2.新疆生产建设兵团医院/石河子大学医学院第二附属医院检验科,乌鲁木齐 830002)
目的 评价Innovance测定血浆D-二聚体的分析性能。方法 参照美国临床和实验室标准化协会文件及相关文献,对Innovance在Sysmex CA1500凝血分析仪上检测D-二聚体的精密度、携带污染率、准确度、分析测量范围、临床可报告范围上限及参考值进行评价。以一套Sysmex CA1500检测系统为目标系统,以mini-VIDAS和另一相同Sysmex CA1500检测系统为比对系统,对目标系统和比对系统检测D-二聚体结果进行比对及偏倚评估。结果 质控品和混合血浆批内与室内精密度结果均符合厂家声明要求。携带污染率符合要求。测定不同浓度赋值参考物质的准确度试验,平均偏倚-0.80%~1.28%。验证的分析测量范围0.20~4.34 mg/L FEU。临床可报告范围上限70.4 mg/L FEU。40例表面健康人群的90百分位数为0.53 mg/L FEU。与mini-VIDAS检测系统比对,相关系数(r)=0.905,结果间差异有统计学意义(P<0.05),均值处相对偏倚21.37%。与另一相同Sysmex CA1500检测系统比对,r=0.996,cut off值处的预期偏倚-4.82%。Sysmex CA1500检测系统能准确检测Innovance配套质控品和校准品的D-二聚体,而检测mini-VIDAS配套的质控品和校准品D-二聚体的偏倚不在允许范围。同样,mini-VIDAS检测系统也只能准确检测相配套的质控品和校准品。结论 Innovance测定血浆D-二聚体的分析性能符合临床要求,同一实验室D-二聚体测定应在相同的检测系统上完成。
D-二聚体; 免疫比浊法; 性能评价
D-二聚体(D-D)是交联纤维蛋白在纤溶系统作用下产生的可溶性降解产物,其水平增高提示机体内存在血栓形成和继发性纤溶亢进[1-2]。研究表明,血浆D-D水平联合临床可能性评价在静脉血栓栓塞症(VTE)的排除性诊断中具有重要意义[3-4]。目前,临床实验室普遍采用免疫比浊法测定血浆D-D水平,但是不同厂家的试剂性能存在很大差异,测定结果的可比性也较差[5-6]。Innovance是一种由西门子医疗诊断公司生产的可以配套用于Sysmex系列凝血分析仪定量测定血浆D-D的试剂,其原理为颗粒增强型免疫比浊法。为深入了解Innovance检测血浆D-D的分析性能及特点,作者参照美国临床和实验室标准化协会文件及相关文献,在1台Sysmex CA1500凝血分析仪上对该试剂进行了全面性能评价,现报道如下。
1 材料与方法
1.1 检测系统组成 目标系统(Y):Sysmex CA1500凝血分析仪、Innovance试剂盒及其配套质控品和校准品;比对系统1(X1):mini-VIDAS免疫分析仪、VIDAS Dimer试剂盒(酶联免疫荧光法)及其配套质控品和校准品;比对系统2(X2):另1台Sysmex CA1500凝血分析仪,试剂、质控品和校准品同Y。
1.2 试剂 (1)Innovance试剂盒(批号:560167)及配套4个批号的质控品和3个批号的校准品(赋值参考物质)。Innovance C1、C2、C3 和C4批号分别为560753、560654、560761和560662;Innovance S1、S2和S3批号分别为560569、560559和560578。(2)VIDAS Dimer试剂盒(批号:1002872390)及配套2个批号的质控品和1个批号的校准品(赋值参考物质)。VIDAS C1、C2批号分别为1072880、1072890;VIDAS S批号为1069250。
1.3 血浆标本 来源于新疆生产建设兵团医院就诊患者和健康体检者,参照《全国临床检验操作规程》(第3版),用3.2%枸橼酸钠抗凝真空管采集2 mL静脉血,3 000 r/min离心15 min,排除溶血、脂血、黄疸及污染标本。
1.4 方法
1.4.1 D-D测定 严格按照Innovance和VIDAS Dimer试剂说明书规范流程测定D-D。测定标本前进行质量控制,整个评价过程使用同一批次的试剂。
1.4.2 精密度试验 溶解Innovance C1和C2,制备D-D低值P1和高值P2混合血浆标本,均分装后冷冻保存。按照EP15-A2文件[7]提供的方案,对上述质控品和混合血浆,每日测定1批,每批重复测定4次,连续测定5 d,计算批内精密度(CV批内)和室内精密度(CV室内),并与厂家声明的CV批内和CV室内比较。
1.4.3 携带污染试验 取P2高值(H)和P1低值(L)混合血浆进行测定,测定顺序及结果记录如下:L1、L2、L3、H1、H2、L4、H3、L5、L6、L7、L8、H4、H5、L9、H6、L10、H7、H8、L11。选出高值对低值(H~L)干扰组(L4、5、9、10、11)与低值对低值(L~L)干扰组(L2、3、6、7、8)两组数值,分别计算均值M与标准差s,要求[M(H~L)-M(L~L)]<3s(L~L)[8]。
1.4.4 准确度试验 参照EP15-A2文件[7],取Innovance S1、S2和S3分别重复测定3次,测定结果与相应靶值比较,计算平均偏倚。
1.4.5 分析测量范围验证 参照EP6-A文件[9],取接近厂家声明分析测量范围下限(0.19 mg/L FEU)的低浓度(L)和接近厂家声明分析测量范围上限(4.4 mg/L FEU)的高浓度(H)新鲜血浆标本,按1L、0.8L+0.2H、0.6L+0.4H、0.4L+0.6H、0.2L+0.8H、1.0H配比方法,制备6种不同浓度的混合标本,每个标本重复测定3次。设定实验室的重复性和线性允许误差范围均为5.0%,进行数据多元线性回归分析,对二次多项式非线性系数b2和三次多项式非线性系数b2、b3与0比较进行t检验,以P<0.05为差异有统计学意义,以确定最佳拟合方式。
1.4.6 临床可报告范围上限验证 参照EP6-A文件[9],取3份接近厂家声明线性范围上限浓度的患者血浆标本,用配套稀释液按1∶2、1∶4、1∶8、1∶16、1∶32倍比稀释,计算稀释回收率。回收率在90%~110%为可接受。临床可报告范围上限=最大稀释倍数×分析测量范围上限。
1.4.7 参考值验证 参照C28-A3文件[10],选择40例表面健康体检者标本,男、女各20例,年龄18~65岁,计算均值、标准差及90百分位数。厂家声明参考值:表面健康人群90百分位数为0.55 mg/L FEU。
1.4.8 检测系统间比对和偏倚评估 (1)参照EP9-A2文件[11],每天收集患者6~9份新鲜血浆标本,分别在Y和X上按标本编号正向测定一次,再反向测定一次,连续测定5 d,共计40份血浆标本。结果统计:①组内、组间离群值检验。②做散点图和偏倚图。③计算线性回归方程和相关系数(r)。④检测系统间的系统误差,如r<0.975,使用配对t检验进行分析,并计算Y和X检测结果均值处的平均偏倚;如r≥0.975,计算在cut off值(Innovance和VIDAS Dimer均为0.5 mg/L FEU)处Y与X之间检测结果的预期偏倚。(2)使用Innovance和VIDAS Dimer配套质控品、校准品,分别在Y和X上进行D-D测定,结果与其相应赋值进行比较。
2 结 果
2.1 精密度试验结果 尽管2个批号质控品和2个水平混合血浆的CV批内和CV室内均大于厂家声明的CV批内和CV室内,但均小于相应的验证值,见表1。

表1 Innovance测定D-D精密度试验结果
2.2 携带污染试验结果 M(H~L)-M(L~L)=0.018 mg/L FEU,3s(L~L)=0.047 mg/L FEU。
2.3 准确度试验结果 Innovance S1、S2和S3的D-D测定结果与靶值平均偏倚分别为1.28%(0.64%~1.71%)、-0.80%(-1.59%~2.19%)和-0.11%(-3.80%~2.19%)。
2.4 分析测量范围验证结果 重复测量误差为2.59%,小于5.00%的设定误差。多项式回归分析表明,非线性系数b2、b3与0比较差异均无统计学意义(P>0.05),最佳拟合方式为一次多项式(图1),线性回归方程为Y=0.826 9X-0.595 1,r2=0.998 3,验证的分析测量范围为0.20~4.34 mg/L FEU。

图1 相对浓度水平与实测均值散点图
2.5 临床可报告范围上限验证结果 3份血浆标本1∶16稀释后的回收率均可接受,临床可报告范围上限为70.4 mg/L FEU。稀释回收试验结果见表2。

表2 稀释回收试验结果
注:-表示无数据。
2.6 参考值验证结果 40例表面健康人群D-D测定均值0.29 mg/L FEU,标准差0.15 mg/L FEU,90百分位数为0.53 mg/L FEU,数据呈偏态分布。

图2 X1测定均值对Y测定均值散点图(X1-Y)
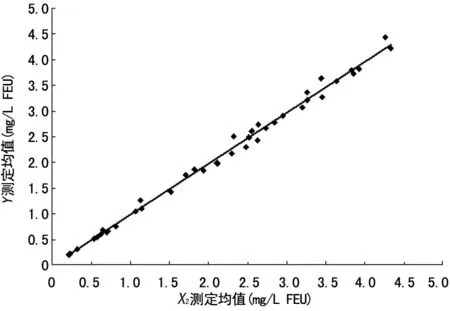
图3 X2测定均值对Y测定均值散点图(X2-Y)

图4 Y与X1二者测定均值与二者均值差值偏倚图

图5 Y与X2二者测定均值与二者均值差值偏倚图
2.7 检测系统间比对和偏倚评估结果 经离群值检验,方法内、方法间无离群值。X与Y测定结果的散点图和偏倚图见图2~5。Y与X1回归方程:Y=1.178X1+0.063,r=0.905,结果差异有统计学意义(P<0.05),均值处的相对偏倚为21.37%。Y与X2回归方程:Y=0.993X2-0.021,r=0.996,cut off值处的预期偏倚为-4.82%(95%CI0.44~0.52 mg/L FEU)。Y和X只能准确检测各自配套质控品和校准品的D-D,而检测对方配套质控品和校准品D-D的偏倚均不在允许范围,见表3。

表3 Innovance和VIDAS Dimer配套质控品、校准品分别在Y和X上测定D-D结果(mg/L FEU)
3 讨 论
D-D是血栓形成的敏感性标志物,假阳性率高、特异性低,但阴性预期值极高[5]。因此,血浆D-D对于排除VTE的诊断颇具价值而在临床上得到广泛应用。D-D检测方法多样,有酶联免疫吸附试验、乳胶凝集法及免疫比浊法,即使同种测定方法其检测试剂和仪器亦不尽相同[12]。由于国际上尚无统一的单克隆抗体和校准品,不同仪器和试剂测定结果可比性差是D-D测定存在的最大问题[2]。实验室选择恰当的D-D检测方法及掌握所选方法的分析性能和特点对于在VTE患者排除诊断时降低临床风险至关重要。
Innovance属于第2代免疫比浊试剂,当其与配套的凝血仪(Sysmex和BCS系列)检测血浆D-D时,具备快速、高敏感的特点[13-14]。Innovance定量测定血浆D-D(cut off值:0.50 mg/L FEU)可辅助临床排除VTE的诊断已通过美国食品与药品监督管理局(FDA)的认证。基于上述原因,作者所在实验室选择了Innovance试剂和配套的Sysmex CA1500凝血仪用于患者标本D-D常规检测。
对Innovance进行精密度评价显示,测定质控品和混合血浆批内精密度和室内精密度均低于厂家的声明,但按照EP15-A2文件的验证要求,测定的CV值均小于验证值,说明测定的精密度符合厂家声明的要求,能够满足临床要求。毕波和吕元[15]认为,在进行方法学评价试验方案设计时,应首先完成精密度试验和标本携带污染试验,检测系统的良好重复性和无携带污染是进行其他方法学评价试验的前提。Innovance及其配套的Sysmex CA1500有较低的携带污染率。采用3个不同浓度赋值参考物质对Innovance进行测量准确度评估,平均偏倚均可接受。
厂家声明的分析测量范围是0.19~4.40 mg/L FEU,作者验证的范围为0.20~4.34 mg/L FEU,最高值在厂家提供上限值的±10%以内,故可以接受。Innovance厂家提供的最低检出限(LOD)为0.05 mg/L,由于D-D如此低值对临床的意义不大,故作者未对Innovance的最低检出限和功能灵敏度进行评价,也就未对其临床可报告范围的下限进行评估。临床可报告范围要结合功能灵敏度、最大稀释度及分析测量范围进行确定,在分析测量范围上限浓度附近的3份标本的最大稀释度均为1∶16可接受,因此临床可报告范围的上限是70.4 mg/L FEU。验证的稀释度高于Innovance厂家设置的1∶8稀释度(厂家临床可报告范围上限为35.2 mg/L FEU),若将仪器的自动稀释设置到1∶16,可将测定范围提高至70.4 mg/L FEU。验证的表面健康人群90百分位数D-D值略低于厂家声明的参考值,说明厂家的参考区间基本适合于作者所在医院的就诊人群。
将Innovance与mini-VIDAS进行比对发现,相关性不良(r=0.905),二者测定结果差异有统计学意义(P<0.05),均值处的相对偏倚为21.37%。无论是免疫比浊法还是酶联免疫吸附试验,D-D测定均是基于单克隆抗体对D-D抗原表位进行特异性识别[12]。两种方法同时检测Innovance与mini-VIDAS配套的质控品和校准品结果可比性差,表明Innovance和mini-VIDAS单克隆抗体及抗体识别的抗原表位不同。在Innovance配套的2台Sysmex CA1500凝血分析仪上进行的比对试验发现,2套相同的检测系统测定结果相关性好(r=0.996),cut off值处的预期偏倚为-4.82%。因此,作者建议同一实验室D-D测定应在相同检测系统上完成,避免因不同检测系统间测定结果的差异而引起不必要的临床风险。
总之,Innovance在Sysmex CA1500凝血分析仪上定量测定血浆D-D的各项分析性能指标能够满足临床需求。不同检测系统的血浆D-D测定结果存在差异,同一实验室血浆D-D检测应在相同检测系统上完成。
[1]中华医学会心血管病学分会肺血管病学组,中国医师协会心血管内科医师分会.急性肺血栓栓塞症诊断治疗中国专家共识[J].中华内科杂志,2010,49(1):74-81.
[2]门剑龙,任静.D-二聚体临床应用及标准化分析进展[J].中华检验医学杂志,2010,33(8):793-797.
[3]“D-二聚体检测”急诊临床应用专家共识组.“D-二聚体检测”急诊临床应用专家共识[J].中华急诊医学杂志,2013,22(8):827-836.
[4]朱铁楠.D-二聚体检测在静脉血栓栓塞性疾病诊治中的应用[J].中华内科杂志,2012,51(3):240-242.
[5]Righini M,Perrier A,De Moerloose P,et al.D-Dimer for venous thromboembolism diagnosis:20 years later[J].J Thromb Haemost,2008,6(7):1059-1071.
[6]苏薇,邱玲.D-Dimer PLUS测定血浆D-二聚体浓度性能评价[J].现代检验医学杂志,2008,23(4):38-41.
[7]CLSI.EP15-A2.User verification of performance for precision and trueness;approved guideline-second edition[S].PA,SUA:CLSI,2010.
[8]宋晓玉,张珂,张莉,等.Sysmex CA-1500全自动血凝分析仪性能评价[J].检验医学与临床,2011,8(23):2893-2895.
[9]CLSI.EP6-A.Evaluation of the linearity of quantitative measurement procedures:a statistical approach;approved guideline[S].PA,SUA:CLSI,2010.
[10]CLSI.C28-A3.Defining,establishing,andverifyingreferenceintervalsintheclinicallaboratory;approvedguideline-thirdedition[S].PA,SUA:CLSI,2010.
本研究cTnI结果不确定度为2倍SR。即在95%置信水平下为(0.218±0.016)μg/L。
移动差值控制图评估不确确定度基于“top-down”的原理,通过控制图保证实验室内的长期稳定性和统计受控。与不确定度定义“合理地”相一致。控制图评估不确度是将日常质控工作与不确定度评定有机结合,具有广阔的应用前景。然而,临床实验室使用本法评估cTnI不确定度应注意以下几点:(1)cTnI校准前应对测量系统进行全面保养,校准后控制品测量值应在“靶值”附近,即系统偏移可忽略,如控制品偏离“靶值”则应重新校准。通过严格校准使测量系统过程受控,从而尽量消除系统误差。(2)必须使用均匀性和稳定性良好的控制品。(3)统计时必须剔除离群值。
运用日常质控数据绘制移动极差控制图可进行不确定度评估,值得临床实验室尝试。目前,临床实验室运用控制图评定cTnI不确定度的瓶颈是控制品溯源性及测量浓度不能满足实验室的需求,因此研究与人血清具有相同基质效应cTnI控制品对临床实验室评估不确定度具有重要意义。
参考文献
[1]ISO.ISO 15189 Accreditation criteria for the quality and competence of medical laboratories[S].Geneva:ISO,2012.
[2]王治国,王薇,李小鹏.测量不确定度及其在临床检验中应用[J].中国卫生统计,2005,22(2):85-86.
[3]朱红梅,吴美辉,罗丹,等.临床生化检验测量不确定度的评估[J].检验医学与临床,2012,9(8):922-923.
[4]刘靖,陈特,邓小玲,等.利用室间质评回报结果对临床生化检验常规项目不确定度评定的方法探讨[J].检验医学与临床,2014,11(2):152-154.
[5]刘密凤,刘蔚,郭海,等.临床生物化学指标测量不确定度的评估[J].检验医学与临床,2013,10(23):3153-3154.
[6]中国合格评定国家认可委员会.GB/T27407-2010实验室质量控制 利用统计质量保证和控制图技术评价分析测量系统性能[S].北京:中国标准出版社,2010.
[7]中国合格评定国家认可委员会.基于质控数据环境检测测量不确定度评定指南[S].北京:中国标准出版社,2013.
[8]祝文彩,季伙燕,王惠民.用单值-移动极差法建立HBsAg定量检测室内质量控制图[J].临床检验杂志,2014,32(8):634-636.
Evaluation of analytic performances of Innovance assay for detecting plasma D-dimer*
BAIZhu-xiao1,2,LIUHui-min2,JIANGHong-bing2,DENGZhao-hui2,LIANGXue-li2,ZHANGXin2△
(1.MedicineSchoolofShiheziUniversity,Shihezi,Xinjiang832000,China;2.DepartmentofClinicalLaboratory,HospitalofXinjiangProductionandConstructionCorps/SecondAffiliatedHospital,MedicineSchoolofShiheziUniversity,Wulumuqi,Xinjiang830002,China)
Objective To evaluate the analytical performance of Innovance assay for detecting plasma D-Dimer.Methods Referring to the documents of Clinical and Laboratory Standards Institute(CLSI) and the related literatures,the performances of Innovance for detecting plasma D-dimer on the Sysmex CA 1500 analyzer were evaluated,including precision,carryover contamination rate,accuracy,analytical measurement range,upper limit of clinical reportable range and reference value.With the Sysmex CA 1500 as the objective detection system and the mini-VIDAS and another same Sysmex CA 1500 detection system as the reference detection system,the detection results of D-dimer by these systems were perfromed the comparison and bias estimation.Results The within-run precisions and within-laboratory precision of control materials and pooled plasma samples conformed to those of manufacturer statement.The carryover contamination rate was in accord with the clinical requirement.The average deviation of Innovance assay for detecting different calibrators were -0.80%~1.28%.The verified analytical measurement range was 0.20~4.34mg/L FEU.The upper limit of clinical reportable linear range was 70.4mg/L FEU.The 90th percentile in 40 cases of apparently healthy adults was 0.53mg/L FEU.When the test results of the objective detection system were compared with those of mini-VIDAS system (r=0.905),there were significant difference(P<0.05) and the relative bias in the point of mean value was 21.37%.When the test results of the objective detection system were compared with those of another Sysmex CA1500 (r=0.996),the expected bias in the point of cut-off value was -4.82%.D-dimer concentration of Innovance′s control materials and calibrators can be accurately detected by the Sysmex CA1500,but the detection results of the mini-VIDAS′s control materials and calibrators by the Sysmex CA1500 can not be accepted.Similarly,the D-dimer concentration of the mini-VIDAS′s control materials and calibrators could only be accurately detected by the mini-VIDAS detection system.Conclusion The performance of Innovance assay for detecting plasma D-dimer conforms to clinical requirement,and the D-dimer test at the same laboratory should be accomplished in the same detection system.
D-dimer; immunoturbidimetric assay; performance evaluation
兵团科技局重点科技攻关项目(2013BA018);兵团医院院级课题项目(YJ2014002)。
白著晓,男,硕士,主要从事检验项目的方法学评价及其在疾病诊疗中作用的研究。
△通讯作者,E-mail:zjq010902@126.com。
10.3969/j.issn.1672-9455.2015.09.013
A
1672-9455(2015)09-1211-04
2014-11-05
2015-01-18)
