高脂饮食诱导肥胖大鼠血糖的动态变化研究*
2015-03-15霍瑾璇李文艳商丘医学高等专科学校基础医学部河南商丘476100
霍瑾璇,李文艳(商丘医学高等专科学校基础医学部,河南商丘 476100)
高脂饮食诱导肥胖大鼠血糖的动态变化研究*
霍瑾璇,李文艳(商丘医学高等专科学校基础医学部,河南商丘 476100)
目的 建立高脂饮食喂养大鼠模型,探讨口服葡萄糖耐量试验(OGTT)和胰岛素耐量试验(ITT),观察其血糖(GLU)动态变化。方法 雄性SD大鼠24只,随机分为正常组和高脂组,分别喂养普通饲料和高脂饲料,检测大鼠体质量与血脂,喂养后第2、4、6、8、9周进行OGTT及ITT试验并检测GLU。结果 第4周后高脂组体质量显著高于正常组;第10周高脂组体质量高于正常组,差异均有统计学意义(P<0.05)。第10周高脂组三酰甘油(TG)、血清总胆固醇(TC)、血压均明显高于正常组,24 h尿蛋白定量也高于正常组,差异均有统计学意义(P<0.05);高脂组第2周时检测120 min OGTT GLU明显高于正常组;第4周90 min GLU明显高于正常组;第6周60、90、120 min GLU均明显高于正常组;第8周60、120 min GLU均明显高于正常组;第9周0、120 min GLU均明显高于正常组,差异均有统计学意义(P<0.05)。高脂组第4周检测15 min ITT GLU明显高于正常组;第6周15、30 min ITT GLU明显高于正常组;第8周30 min ITT GLU明显高于正常组;第9周15、30 min ITT GLU明显高于正常组,差异均有统计学意义(P<0.05)。结论 高脂饲料喂养周数的增加,高脂组大鼠体质量随高脂饲料的增加而增大,并发生血脂异常,且具有一定程度的胰岛素抵抗。
高脂饮食; 诱导; 肥胖大鼠; 血糖
2型糖尿病(T2DM)患者常伴随脂代谢紊乱,相关研究认为脂代谢紊乱是T2DM患者糖代谢异常的始动因素[1]。有学者报道三酰甘油(TG)是脂类中反映糖尿病患者病情最有价值的指标,血糖(GLU)控制水平不佳导致T2DM患者脂代谢紊乱,从而增加冠状动脉粥样硬化的风险[2]。肥胖与糖尿病、血脂异常高度密切。上海2006~2007年调查显示,T2DM患者中肥胖比例为51%。体质量和血脂水平也密切相关,总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、TG均随体质量指数(BMI)值改变而呈明显变化趋势。本研究通过高脂饮食建立肥胖大鼠模型,探讨不同时间点大鼠口服葡萄糖耐量试验(OGTT)及胰岛素耐量试验(ITT)的GLU动态变化,分析胰岛素抵抗为临床治疗糖尿病提供参考依据。报道如下。
1 资料与方法
1.1 一般资料 Wistar 雄性SPF 级大鼠20 只,每笼4 只,房笼标准化喂养,体质量约180 g,8 周龄,购自上海斯莱克实验动物中心,喂养于商丘市医药研究所动物实验室,每天行12 h光照,自由饮食进食。
1.2 试剂 胆酸钠、胆固醇、链脲佐菌素(STZ)、胰岛素ELISA试剂盒、葡萄糖试剂盒为美国强生公司生产(One Touch Ultra)。普通饲料为22%粗蛋白,4%粗脂肪,74%碳水化合物,高脂大鼠饲料配方为24%粗蛋白,20%粗脂肪,56%碳水化合物,购自苏州双狮公司。
1.3 方法
1.3.1 分组及建立模型 对大鼠行1周的适应性喂养后,按随机方法分为高脂组和正常组各10只,2组大鼠体质量、周龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。正常组饮用自来水,给予常规饲料喂养;高脂组饮用12%果糖水,66.5%常规饲料,20%猪油,1%胆酸钠,2.5%胆固醇,10%蔗糖的高脂饮食喂养。均自由进水进食,8周后禁水禁食12 h。饲养期间2组大鼠自由进食并饮用清洁水,室温(22±1)℃,湿度50%~60%。高脂组造模成功10只,实验中每2周检测1次体质量。
1.3.2 实验室及病理诊断 (1)血液及尿液标本:大鼠饲养满8周后和STZ注射后即造模成功,大鼠自由饮食,行12 h禁食。抽取500 μL血液,将血清分离,胰岛素水平应用ELISA法检测,采用RT2100C型自动酶标仪。第10周,对2组大鼠24 h尿蛋白定量进行检查,收集24 h尿液标本10 mL,全自动生化仪检测。给予无水乙醚实施吸入麻醉,对心脏血液开胸进行抽取,检测TC、TG、尿素氮(BUN)、血肌酐(Scr)等。(2)OGTT:大鼠饲养第2、4、6、8、9周进行OGTT检测,注射STZ前,不禁水禁食12 h,灌胃20%葡萄糖,分别在0、30、60、90、120 min获取眦静脉丛血液标本,对胰岛素进行检测。(3)血压监测:实验第10周,麻醉后分别对2组大鼠尾动脉血压行3次测量,取平均值。(4)胰岛素耐量试验(ITT):大鼠饲养第2、4、6、8、9周进行ITT检测,实验当天清晨6:00开始禁食,禁食时间5 h,11:00腹腔注射胰岛素(0.5 U/kg体质量),留取眦静脉丛血液标本,检测0、15、30、45、60、90、120 min GLU水平。

2 结 果
2.1 2组大鼠相关指标结果比较 第4周后高脂组体质量显著高于正常组;第10周高脂组体质量下降,正常组增加,2组比较差异均有统计学意义(P<0.05)。第10周高脂组TG、TC、血压均明显增加;24 h 尿蛋白增加也高于正常组,差异均有统计学意义(P<0.05)。见表1、2。
2.2 2组大鼠OGTT GLU结果比较 第2周高脂组检测120 min OGTT GLU明显高于正常组;第4周时90 min GLU明显高于正常组;第6周60、90、120 min GLU均明显高于正常组;第8周时60、120 min GLU均明显高于正常组;第9周时0、120 min GLU均明显高于正常组,差异均有统计学意义(P<0.05)。见表3。

表1 2组大鼠不同时间的体质量结果比较±s,g)
2.3 2组大鼠ITT GLU结果比较 第4周高脂组检测15 min ITT GLU明显高于正常组;第6周时15、30 min ITT GLU明显高于正常组;第8周时30 min ITT GLU明显高于正常组;第9周时15、30 min ITT GLU明显高于正常组,差异均有统计学意义(P<0.05)。见表4。

表2 2组大鼠在第10周时各指标结果比较 ±s)
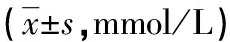
表3 2组大鼠在第2、4、6、8、9周时OGTT GLU结果比较
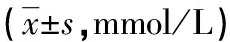
表4 2组大鼠在第2、4、6、8、9周时ITT GLU结果比较
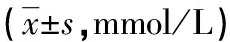
续表4 2组大鼠在第2、4、6、8、9周时ITT GLU结果比较
3 讨 论
我国女性50年体型改变最大的是腰围,从70 cm上升至86 cm[3]。肥胖与糖尿病、冠心病、高血压和恶性肿瘤风险相关[4]。T2DM患者常见的血脂异常是TG升高及HDL-C降低。通常治疗时,不是降低TG及提高HDL-C,而是降低TC和LDL-C水平[5]。有研究表明,通过他汀类药物降低TC和LDL-C水平,可以显著降低糖尿病患者发生大血管病变和病死风险,解决T2DM血脂异常问题。目前尚无明确证据显示,使用他汀类药物的基础上,降低TG和升高HDL-C能减少糖尿病患者发生心脑血管病变和病死率。高脂饮食与肥胖直接相关,是T2DM的高危因素。本研究结果显示随着高脂饲料喂养周数的增加,高脂组大鼠体质量增加,致使血糖、血脂异常,并在不同时间呈一定程度的胰岛素抵抗。Suheyl等[6]在一种新型的胰岛素抵抗动物模型中发现,极低密度脂蛋白胆固醇(VLDL-C)和TG合成与分泌增加还伴随着VLDL-C和载脂蛋白B(ApoB)分泌成倍的增加(4.6倍),提示ApoB的稳定性增加,清除率下降,而ApoB是VLDL-C装配及分泌的限制性因素[7];用免疫印迹分析法发现,线粒体中TG转运蛋白(MTP,一种影响VLDL-C装配的关键酶)在肝细胞中水平升高2.1倍,故认为肝中VLDL-C生成增加还可能与胰岛素抵抗状态下ApoB的过度表达或稳定性增加以及MTP表达增多相关[8-9]。有学者研究报道,OLETF大鼠(一种T2DM模型,6周时出现腹型肥胖,12周时出现胰岛素抵抗)出现胰岛素抵抗时,TG合成的限速酶肝脏脂酰辅酶A活性及其mRNA水平升高,导致TG水平也升高,VLDL-C的合成及装配随之增加[10]。VLDL-C受体近年来备受关注,其可与含载脂蛋白E(ApoE)的脂蛋白(如VLDL-C、CM等)结合,但不结合LDL-C[11]。其主要存在于骨骼肌、脂肪组织、心脏、肝脏,组织特异性显示富含TG的脂蛋白向外周转运过程中发挥重要作用,但近年来已有研究证实VLDL-C受体基因与胰岛素抵抗无相关性[12]。TG水平升高,导致胆固醇酯转运蛋白(CETP)活性升高,使HDL-C核心CE与VLDL-C核心TG发生交换,致使HDL-C下降。同时磷脂转运蛋白(PLTP)在胰岛素抵抗时活性也升高,可提高CETP介导的CE转运[13-14]。胰岛素抵抗状态下,肝脏合成载脂蛋白A1(ApoA1)减少,近年来也有研究表明ApoA1在富含TG的HDL-C颗粒中清除率增加,导致低ApoA1水平,而ApoA1是血浆卵磷脂胆固醇脂酰转移酶(LCAT)的激活剂,LCAT活性下降,影响HDL-C的形成[15]。目前胰岛素抵抗与肥胖的因果关系仍不明确,本研究通过动态观察大鼠OGTT和ITT中GLU变化,提示高脂组在不同时间表现出不同程度的胰岛素抵抗,这为今后进一步从临床不同阶段通过改善胰岛素抵抗,进而预防糖尿病提供研究方向。
[1]高苹,贾汝汉.2 型糖尿病肾病大鼠模型的建立[J].中国中西医结合肾病杂志,2007,8(6):316-319.
[2]Freitas RR,Lopes KL,Carill BA,et al.Sympathetic and rennin-an-giotensinsystems contribute to increased blood preasutre in sucrose-fed rats[J].J Am J Hypertens,2007,20(6):692.
[3]王英,江从海,王惠英,等.血脂异常对2 型糖尿病肾病的影响[J].中国热带医学,2008,8(6):981-982.
[4]邢淑丽,郑君芙,黄文政.单侧肾切除STZ 诱导糖尿病肾病大鼠动物模型研究[J].中国中医急症,2006,15(6):643-644.
[5]王康,李平,张浩军,等.2 型糖尿病肾病中晚期病变大鼠模型的研究[J].中国中西医结合肾病杂志,2010,11(1):14-15.
[6]Suheyl EF,Hasanoglu A,Tumer L,et al.Endothelial activation and inflammation in prepubertal obese Turkish children[J].Metabolism,2005,54(26):1384-1389.
[7]Juonala M,Jarvisalo MJ,Maki TN,et al.Risk factors identified in childhood and decreased carotid artery elasticity in adulthood:the cardiovascular risk in young finns study[J].Circulation,2005,112(7):1486-1493.
[8]Kim F,Tysseling KA,Rice J,et al.Activation of IKKbeta by glucose is necessary and sufficient to impair insulin signaling and nitric oxide production in endothelial cells[J].J Mol Cell Cardiol,2005,39(17):327-334.
[9]KimF,TysselingKA,RiceJ,etal.Freefatty acid impairment of nitric oxide production in endothelial cells is mediated by IKKbeta[J].Arterioscler Thromb Vasc Biol,2005,25(11):989-994.
[10]Yang N,Wang C,Xu M,et al.Interaction of dietary composition and PYY gene expression in diet-induced obesity in rats[J].J Huazhong Univ Sci Technolog Med Sci,2005,25(21):243-246.
[11]Roberts CK,Barnard RJ,Sindhu RK,et al.A high-fat,refined-carbohydrate diet induces endothelial dysfunction and oxidant/antioxidant imbalance and depresses NOS protein expression[J].J Appl Physiol,2005,98(10):203-210.
[12]Molnar J,Yu S,Mzhavia N,et al.Diabetes induces endothelial dysfunction but does not increase neointimal formation in high-fat diet fed C57BL/6J mice[J].Circ Res,2005,96(43):1178-1184.
[13]杨凌辉,邹大进.肥胖致胰岛素抵抗的机制[J].中华内分泌代谢杂志,2002,18(3):244-246.
[14]田德润,李晓东,石玉顺,等.肥胖大鼠血浆摄食相关肽和血脂水平变化[J].天津医科大学学报,2004,3(2):10-11.
[15]邬云红,李秀钧,李宏亮.高脂饮食肥胖大鼠胰岛细胞胰岛素抵抗机制的探讨[J].中华医学杂志,2005,27(9):1607-1610.
河南省商丘市科技局2013年基础研究科技项目(135009)。
10.3969/j.issn.1672-9455.2015.11.040
A
1672-9455(2015)11-1594-03
2014-12-25
2015-02-18)
