环境浓度抗生素选择性压力改变活性污泥微生物群落结构
2015-03-14张滢楹耿金菊任洪强许柯丁丽丽
张滢楹,耿金菊,任洪强,许柯,丁丽丽
南京大学环境学院 污染控制与资源化研究国家重点实验室,南京210023
环境浓度抗生素选择性压力改变活性污泥微生物群落结构
张滢楹,耿金菊*,任洪强,许柯,丁丽丽
南京大学环境学院 污染控制与资源化研究国家重点实验室,南京210023
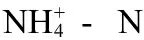
四环素;磺胺甲噁唑;活性污泥;微生物群落结构;废水处理效能
近年来,随着抗生素的大量使用,由此产生的生态环境影响也越发受到人们的关注。全球抗生素的年消耗量约在10~20万t,85%以上的抗生素或其代谢产物经由病人和动物的粪尿排出体外,从而进入到生态环境[1-2]。进入环境中的抗生素除了会对土壤和表层水体等造成化学污染外,还可能诱导产生耐药细菌和抗性基因,且抗性基因在不同环境介质中的传播、扩散并持久性残留,抗性基因往往可能比抗生素本身的危害更大[3]。目前,城市生活污水、医院污水、地表水甚至部分地下水都已检出多种抗生素的存在,浓度在ng·L-1~ mg·L-1量级。四环素(TC)和磺胺甲噁唑(SMX)作为常用的广谱类抗生素,被广泛地用于治疗细菌感染引起的疾病,在环境中检出频率较高。污水处理厂二级出水中检出浓度可达到0.5~10 μg·L-1[4-6],部分制药废水中浓度则高达mg·L-1量级[7]。
环境中抗生素浓度和种类的不断增加可能会改变微生物群落结构和功能。据研究报道,河流中抗生素的存在会改变生物膜的微生物群落结构,并随着抗生素污染程度的加重,生物膜中对应的放线菌含量也随之升高[8]。在硝化生物膜反应器中,四环素的存在导致了部分菌属如Flavobacterium、Caulobacter 、Zooglea 等含量的降低,但同时伴随着Sandarakinorhabdus 等菌种含量的增加[9]。在沥滤池污水处理系统中,四环素的存在会减少其中微生物种类和数量,优势种群的减少幅度最高可达15%[10]。污水处理系统作为抗生素进入天然水环境的主要途径,是水环境中抗生素的重要贮存地和传播源,活性污泥法是污水处理的主要工艺,然而迄今为止,抗生素选择性压力对活性污泥法中微生物群落结构及功能影响的研究尚少且不够深入。
本研究分别以TC和SMX两种抗生素作为研究对象,探讨了环境浓度(5 μg·L-1和50 μg·L-1)抗生素选择性压力下,生物处理过程污水处理效能及活性污泥微生物活性的变化,并利用磷脂脂肪酸(PLFA)及16S rRNA基因高通量测序研究了其对微生物群落结构的影响,为科学评价抗生素类污染物在污水生物处理工艺中的环境风险提供理论依据。
1 材料与方法 (Materials and methods)
1.1 试剂与材料
实验中所用的TC及SMX均购自北京百灵威科技有限公司,纯度≥98%。其他常规化学试剂均为分析纯,购自南京化学试剂有限公司。
实验所用的接种污泥来源于南京江心洲污水处理厂(A/O工艺)的曝气池,污泥浓度约为4 500 mg·L-1,VSS/SS(挥发性固体悬浮物与总固体悬浮物之比)约为0.7 ~ 0.8,污泥沉降指数SVI在80 ~120之间。
1.2 实验方法
1.2.1 反应器的启动与运行
将取自污水处理厂的活性污泥分别接种到6个相同的序批式活性污泥反应器(SBR)中,SBR反应器分为进水、反应、沉淀、出水和闲置5个基本过程,其操作灵活性好,可以很好地模拟以A/O为主体的市政污水处理工艺。实验中反应器有效体积为4 L,其中R0为无抗生素添加的对照组,R1添加50 μg·L-1TC,R2添加50 μg·L-1SMX,R3添加5 μg·L-1TC,R4添加5 μg·L-1SMX,R5添加5 μg·L-1TC和5 μg·L-1SMX。实验配制的模拟废水由C6H12O6、NH4Cl和KH2PO4及微量元素组成,进水COD为300 mg·L-1,其中C:N:P为100:5:1(质量比)。6个反应器的运行参数保持一致,污泥浓度控制在3 000 mg·L-1,单个运行周期为12 h(包括进水0.5 h,曝气10 h,沉淀1 h,出水0.5 h),污泥停留时间7 d,进水pH为6.8~7.0,溶解氧控制在(3.75±0.30) mg·L-1,温度维持在(25±5) ℃。
1.2.2 检测指标与方法

PLFA为甲基化活性污泥中提取的磷脂后得到的脂肪酸产物,不同微生物能够通过不同生化反应形成不同的磷脂脂肪酸,从而使其具有特异的指示性。PLFA的提取方法根据Balser等的方法进行了适当修正[14-15],通过对活性污泥样品的提取、分离及皂化、甲基化、萃取等一系列前处理,最终将提取出的PLFA采用安捷伦7800A气相色谱进行测定。气相色谱各参数由MIDI Sherlock程序设置调用[16-17]。
微生物群落结构(主要为细菌)采用16S rRNA基因高通量测序(Miseq, Illumina)进行检测。污泥样品4 000 r·min-1后弃上清液,利用FastDNA©SPIN Kit for Soil (Qbiogene, USA)进行DNA的提取,提取后的DNA样品利用基于细菌16S rRNA gene V1V2区通用引物进行PCR扩增。PCR反应体系为50 μL,包括5 μL的10×Ex Taq Buffer,4 μL的MgCl2(25 μmol·L-1),0.25 μL的Ex Taq DNA聚合酶(5 U·μL-1),1 μL正反引物(20 μmol·L-1),2 μL的DNA模板(20 ng·μL-1),加灭菌水至50 μL。PCR扩增条件为:初始变性98 ℃、5 min;98 ℃变性30 s,退火50 ℃、30 s,72 ℃延伸40 s,20个循环;最后72 ℃延伸10 min。经琼脂糖凝胶电泳鉴定PCR产物后,采用纯化试剂盒(Cycle-Pure Kit, OMEGA Bio-tek, Inc.) 纯化后送至江苏中宜金大分析检测有限公司进行Miseq测序。
1.3 数据统计与分析
PLFA和16S rRNA基因高通量测序解析微生物群落结构均选取了R0为代表作为生物平行样品,测定结果平行性良好,证明以上2种方法具有可行性。
常规水质指标的数据处理采用Origin 9.0软件,微生物活菌比结果采用ImageJ软件进行分析,Miseq数据经Sickle及Mothur降噪后,通过RDP分类处理。单因素方差分析AVONA用于检验不同样品对于各项微生物活性指标是否具有显著性差异,当P< 0.05时,认为具有显著性差异,使用的分析软件为SPSS statistics 22.0.0。
香农-威尔(Shannon-Wiener)多样性指数通常被定义为:
式中,H 为Shannon-Wiener指数,s 是每个样品中磷脂脂肪酸的总数,pi为各磷脂脂肪酸占总峰面积的的百分比。气相色谱分析的峰面积用来计算为每个磷脂脂肪酸的pi值[17]。
2 结果(Results)
2.1 抗生素选择性压力对废水处理效能及微生物活性的影响
不同抗生素选择性压力下SBR反应器在整个运行阶段的COD去除率如图1所示。由图可见反应器在30 d左右达到稳定运行态,在相应的操作条件下,COD的去除率均高于90%,不同反应器稳定后的COD平均去除率为R0(93.2%),R1(91.87%),R2(90.26%),R3(92.64%),R4(91.68%),R5(91.41%)。2种浓度的TC和SMX持续添加条件下, 6个反应器COD去除率无显著性差异(P> 0.05),相比之下,添加了TC的实验组(R1,R3)对COD去除效果略好于SMX组(R2,R4)。
图2给出了6个SBR反应器在运行阶段NH4+-N的去除效果,由于硝化菌的世代周期较长,因此前30 d中NH4+-N的去除效果不稳定,超过30 d后,各反应器的脱氮过程逐渐进入稳态,平均NH4+-N去除率分别为R0(78.57%),R1(74.93%),R2(73.94%),R3(76.98%),R4(75.36%),R5(76.11%)。同COD的去除效果类似,6个反应器之间NH4+-N的去除效果也无显著性差异(P> 0.05)。
各反应器进出水抗生素浓度测定结果如表1所示。TC和SMX在SBR反应器中去除率维持在25%~30%间,这与反应器各操作运行参数(污泥龄、水力停留时间)等因素有关。
采用LIVE/DEAD荧光染色法作为微生物活菌水平的检测方法,可以从微生物细胞膜完整性的角度评价污泥系统中微生物的活菌水平,具有前处理简单、测定方便、不受细菌种类影响等诸多优点。微生物活菌比可以用来判定活性污泥在受到抗生素选择性压力下细胞膜的损伤程度(表2)。反应器进入稳定阶段后,暴露于抗生素选择性压力下的活性污泥活菌比相比于空白组有所上升,最高为添加了50 μg·L-1SMX的实验组R2,其活菌比例占65.67%,但经统计学分析各组间并无显著性差异(P> 0.05)。
在微生物代谢过程中,三磷酸腺苷(ATP)对提供生命活动所需的能量有着极为重要的作用。活性污泥体系中可以用ATP含量来直观反映微生物的代谢水平,分析简单快速。由表2可知,添加了抗生素的活性污泥微生物ATP含量则显著下降(P =0.013<0.05),其中添加50 μg·L-1TC的R1实验组ATP含量降至(4.55±0.028) RLU/mg MLVSS(以单位混合液挥发性悬浮固体浓度MLVSS计量),低于添加相同浓度SMX的R2实验组的(8.37±1.05) RLU/mg MLVSS。这表明抗生素选择性压力会降低微生物的活性,且TC对微生物活性的影响要大于SMX。

图2 抗生素选择性压力对SBR反应器去除的影响removal of SBR reactors
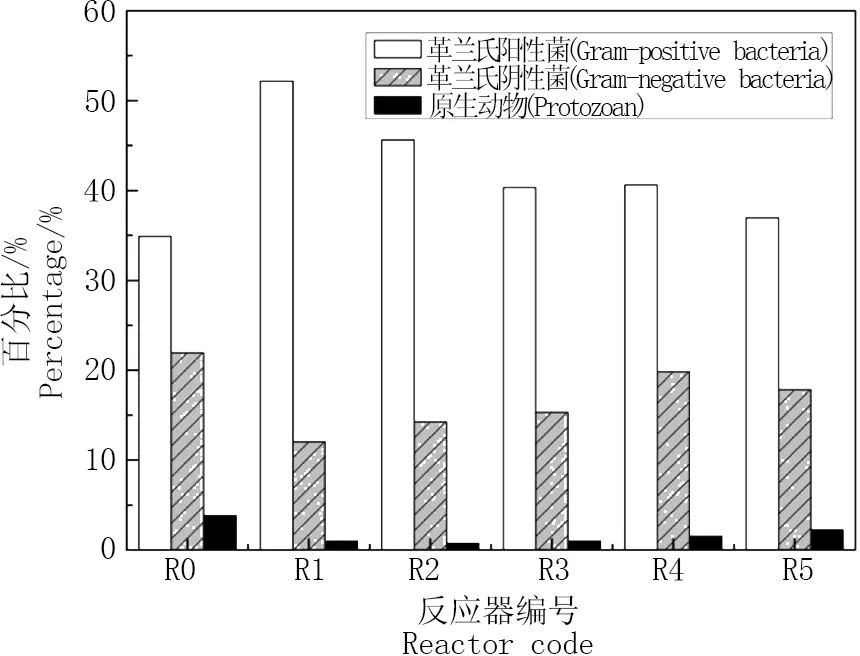
图3 第60天各反应器PLFA生物标记优势菌种
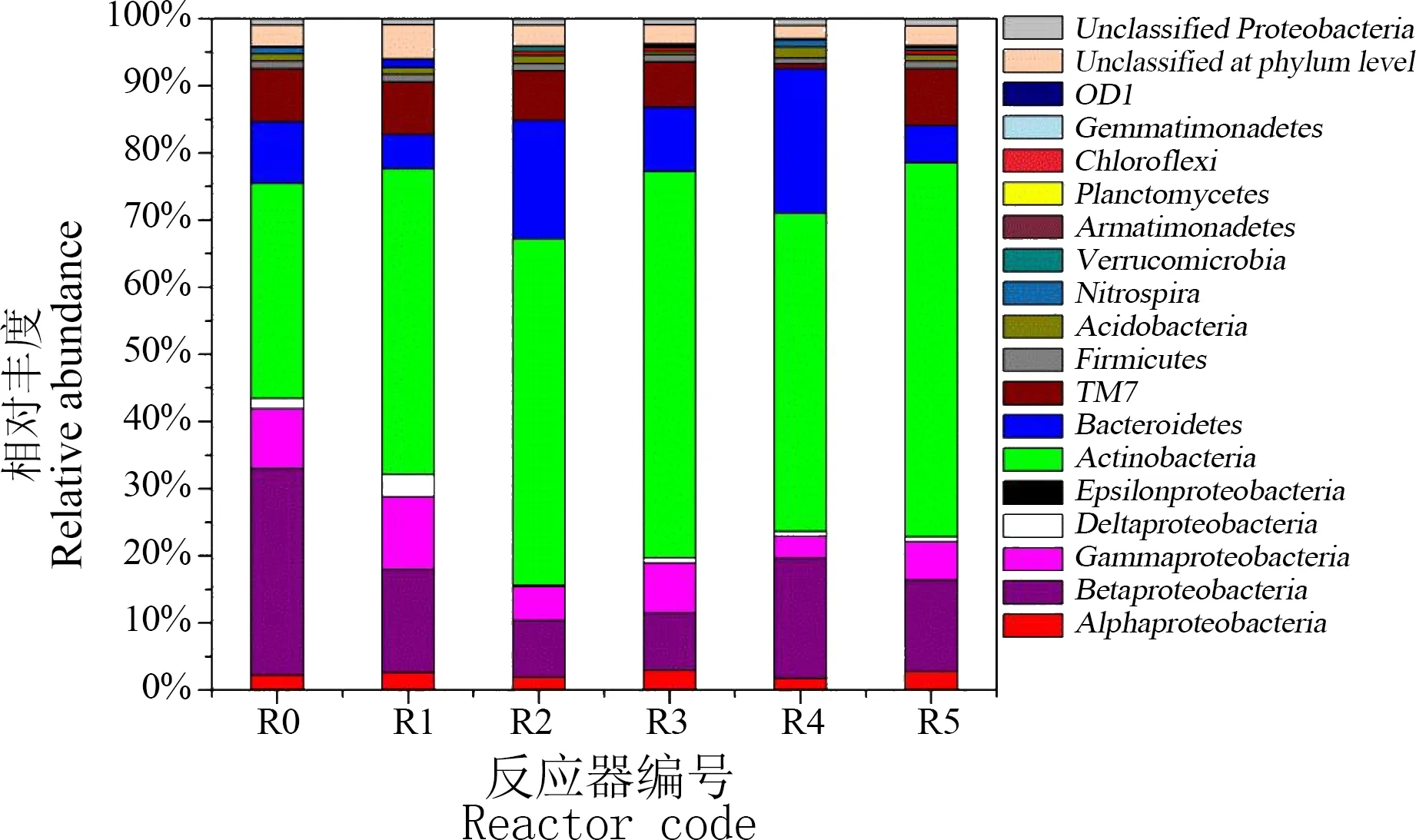
图4 不同抗生素选择性压力下SBR反应器活性污泥微生物群落结构的演变(第60天)

图5 不同抗生素选择性压力下各反应器活性污泥微生物群落结构热图(属水平,相对丰度>0.10%,第60天)
2.2 PLFA解析微生物群落结构的变化
反应器稳定运行末期整个PLFA组成情况如表3所示,PLFA的碳链长度主要分布在C12至C20之间。微生物的群落结构即不同类群微生物的相对丰度,可以通过微生物各种群的特征脂肪酸的相对含量表征。PLFA生物标记可反映革兰氏阳性菌、革兰氏阴性菌及原生动物等的相对含量。一般来说,多种支链脂肪酸可以表征革兰氏阳性菌(如iso-、anteiso-、支链脂肪酸),单不饱和脂肪酸和环丙烷脂肪酸可指示革兰氏阴性菌,特定的脂肪酸(20:2ω6、20:3ω6、20:4ω6)可表征原生动物[17,20]。
如图3所示,在6个反应器中,革兰氏阳性菌的比例均高于革兰氏阴性菌,随着抗生素选择性压力的施加,革兰氏阳性菌明显高于空白对照组,添加50 μg·L-1TC的实验组R1革兰氏阳性菌含量最高,为52.17%,其次是添加50 μg·L-1SMX的实验组R2(45.65%),抗生素浓度为5 μg·L-1的R3(40.35%)和R4(40.61%)中革兰氏阳性菌含量接近,复合污染的实验组R5(36.97%)革兰氏阳性菌比例仅略高于空白对照组R0(34.9%)。革兰氏阴性菌数量变化趋势与阳性菌相反,抗生素选择性压力下革兰氏阴性菌含量均明显低于空白对照组。另外,添加了抗生素后原生动物的含量也明显减少,由R0组的3.82%降至R1(0.99%)、R2(0.75%)、R3(0.98%)、R4(1.56%)和R5(2.23%)。为了考察PLFA的丰富度和均匀度,采用Shannon-Wiener多样性指数来反应微生物种群的多样性。如表4所示,在低浓度的抗生素选择性压力下,稳定阶段的微生物的群落多样性指数相比空白对照组呈现下降趋势。
2.3 16S rRNA基因高通量测序解析微生物群落结构的变化
通过16S rRNA基因高通量测序技术对活性污泥的微生物群落结构进行分析,如图4所示,空白对照组的活性污泥主要以变形菌门为主(Proteobacteria , 41.95%),其中Beta 变形菌(Betaproteobacteria, 30.72%)和Gamma 变形菌(Gammaproteobacteria, 8.96%)是优势菌,而Alpah 变形菌(Alphaproteobacteria, 2.27%),Delta 变形菌(Deltaproteobacteria , 1.48%)及Epsilion 变形菌(Epsilonproteobacteria , <0.01%)均占比较少。除变形菌门占主体外,其次是放线菌门(Actinobacteria , 32.01%)和拟杆菌门(Bacteroidetes , 9.22%)。另外,含量低于10%的门类微生物包括TM7(7.86%),厚壁菌门(Firmicutes , 1.13%),酸杆菌门(Acidobacteria, 1.07%),硝化螺菌(Nitrospira , 0.96%)等共计11个门。相比之下,暴露于抗生素选择性压力的实验组变形菌门减少明显,加入50 μg·L-1TC的R1变形菌门减少至33.01%,加入50 μg·L-1SMX的R2影响更为明显,变形菌门含量骤降至16.53%。暴露于5 μg·L-1TC、5 μg·L-1SMX及两者同时存在的条件下,变形菌门占比分别为20.58%、24.64%和23.89%。抗生素选择性压力下的优势菌是放线菌门,其相对含量分别为R1(45.53%)、R2(51.62%)、R3(57.52%)、R4(47.38%)、R5(55.75%),而空白对照组R0放线菌门仅为32.01%。除放线菌门外,变化比较明显的是拟杆菌门,空白对照组R0拟杆菌占比9.72%,而加入TC的实验组R1和R3拟杆菌门比例减少,分别占5.09%和9.56%,加入SMX的实验组R2和R4拟杆菌有所上升,分别为17.61%和21.54%,两者各添加5 μg·L-1的R5中拟杆菌占5.49%,与单独TC影响的结果接近。

表1 各反应器进出水抗生素浓度Table 1 The influent and effluent TC and SMX concentrations of six reactors

表2 各反应器活性污泥活菌比及三磷酸腺苷(ATP)含量Table 2 Live/dead values and adenosine triphosphate (ATP) concentrations of six SBR reactors
注:MLVSS为混合液挥发性悬浮固体浓度。
Note: MLVSS is mixed liquor volatile suspended solids.
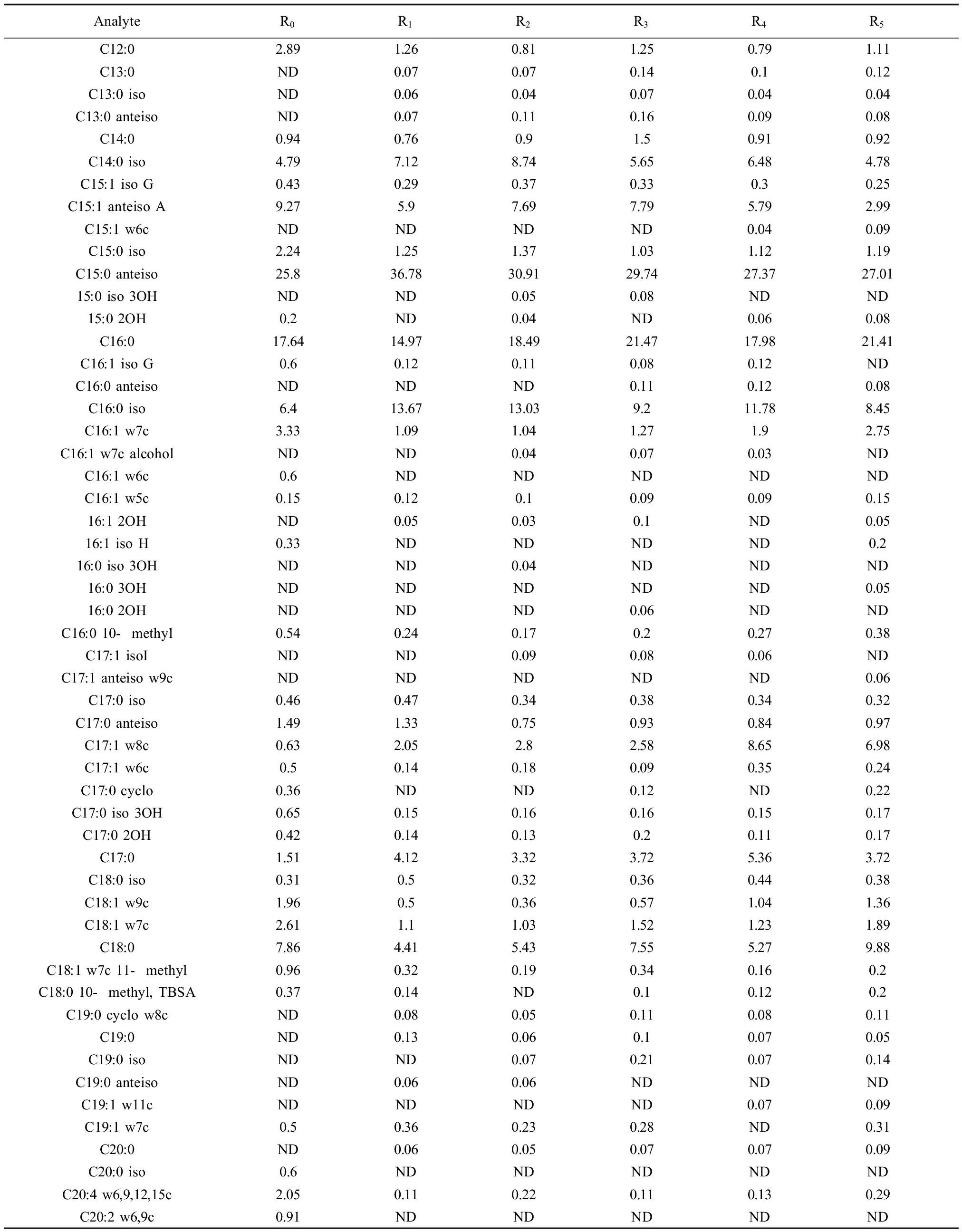
表3 第60天各反应器中活性污泥整体PLFA情况(%)Table 1 The whole PLFA profiles of activated sludge in six reactors at the 60thday (%)
注:表中数值代表每个样品的每个组分的峰值面积占总面积的比值;ND表示未检出。
Note: The values were the percentage of the peak area of each analyte to the total area of each sample. ND mean not detected.

表4 各反应器香农-威尔多样性指数(第60天采样)Table 4 Shannon-Wiener diversity indices of PLFA in each reactor (Sampling at the 60thday)
如图5所示,在属水平上,空白对照组R0的优势微生物(相对丰度>0.10%)包括Micropruina (18.77%,放线菌门)、Zoogloea (12.28%,变形菌门)、TM7 (7.86%,TM7门)、Dechloromonas (6.26%,变形菌门)、Nakamurella (6.25%,放线菌门)、Rudaea (3.55%,变形菌门)、Terrimonas (1.82%,变形菌门)。添加抗生素的实验组Micropruina 比例均明显增加(R129.40%,R224.27%,R324.42%,R430.35%,R532.49%),Zoogloea 比例明显减少(R13.73%,R22.99%,R32.7%,R42.24%,R54.73%),TC和SMX选择性压力下该两种属变化趋势较为一致。
3 讨论(Discussion)
在对出水水质影响方面,低浓度的抗生素选择性压力下污水处理效能所受影响不大,COD和NH4+-N的去除效果仅略低于空白对照组(图1),这主要是由于本研究中所选择的抗生素浓度均较低,相当或略高于目前实际水体中的检出水平。抗生素的平均去除率维持在25%~30%间,与本研究各项工艺操作参数(如泥龄、水力停留时间等)相关。
在对微生物活性影响方面,较低的抗生素浓度对微生物的活菌比的影响不具有显著性差异,说明低浓度的抗生素对微生物的毒性不大,但当抗生素的浓度较高、污染较为严重时,死菌的比例会明显增高。如Proia等[8]研究发现在多种抗生素选择性压力下,生物膜中死菌比例随着抗生素污染程度的加剧而明显上升。在低浓度的抗生素选择性压力下,ATP含量显著下降(表2),ATP含量下降可以表征微生物的活性降低。在微生物代谢过程中,ATP对提供生命活动所需的能量有着极为重要的作用。活性污泥体系中可以用ATP含量来直观反映微生物的代谢水平,有研究报道,在低温等极端条件下,生物膜内部ATP含量降低,生物活性降低[18]。尹军等[19]研究发现,当pH值过大地偏离适宜数值,或受到S2-、CN-等有毒物质影响时,活性污泥微生物细胞新陈代谢的功能随之变化,ATP值下降,微生物活性受到不良影响。
在对微生物群落结构影响方面,PLFA鉴定技术目前已被广泛应用与土壤、水体沉积物、地下水等环境微生物群落结构的研究中[17]。在低浓度的抗生素选择性压力下,通过PLFA生物标记法可以看出微生物的群落结构发生了变化,Shannon-Wiener多样性指数的降低代表着微生物多样性的减少。牛川等[21]通过PLFA分析低温下活性污泥微生物性能时发现,在低温条件下,微生物物种丰富度和多样性降低。
利用16S rRNA基因高通量测序技术对微生物的种群结构及功能进行分析,可以更深入地了解微生物群落结构的变化[22]。在低浓度抗生素选择性压力下,作为活性污泥微生物优势菌的变形菌门数量明显减少,可能是其受抗生素冲击的影响较大[23]。放线菌明显增多,在并未发生丝状菌膨胀的情况下出现这样明显变化,可能是微生物自身在面对抗生素的冲击下分泌更多的胞外聚合物以形成一层保护屏障,作为革兰氏阳性菌,放线菌的增加也验证了PLFA结果中革兰氏阳性菌比例增加。在属级别上,检出比例最高的Micropruina 属于放线菌门,有文献报道其具有一定的耐毒性[24-25],在抗生素选择性压力下,该属比例的增加可以证明其具有抵御部分抗生素冲击负荷的作用。同时,指示Micropruina 的主要脂肪酸为C14:0 iso、C15:0 anteiso、C16:0、C16:0 iso[26],这4种脂肪酸在PLFA的结果中均占主要成分,并通过两种表征微生物群落结构的手段得到了很好的印证。另外,如图5所示,Zoogloea 也是重要的微生物之一,属于Beta 变形菌,该菌是菌胶团的主要组成成分[27],在添加了抗生素后其含量下降,说明抗生素选择性压力对于活性污泥微生物菌胶团的形成有显著的影响,这也可以解释在抗生素存在下ATP含量降低,微生物活性降低的原因。另外,Thiobacter 属于Gamma 变形菌门,有研究报道该菌属的存在有利于降解磺胺类有机物[28-29],本研究中仅在添加了SMX的反应器中检测到该菌属,推测其可能会对SMX的降解起到重要作用。
综上表明:在环境浓度(5 μg·L-1和50 μg·L-1)TC和SMX两种抗生素选择性压力下,SBR反应器中的出水水质(COD和NH4+-N)受到的影响不明显;ATP测定结果表明活性污泥微生物活性降低;PLFA和16S rRNA基因高通量测序结果表明微生物种群结构发生明显变化,革兰氏阳性菌比例上升,其中主要是放线菌含量增加,革兰氏阴性菌比例下降,原生动物数量减少,生物多样性减少。然而,本研究主要针对60 d抗生素选择性压力下活性污泥微生物群落结构进行了解析,长期作用下对污水处理效能的影响及抗生素选择性压力对活性污泥体系中抗生素抗性基因传播的影响还需要进一步研究。
[1] Baquero F, Martinez J L, Canton R. Antibiotics and antibiotic resistance in water environments [J]. Current Opinion in Biotechnology, 2008, 19(3): 260-265
[2] Kümmerer K. Antibiotics in the aquatic environment—A review—Part I [J]. Chemosphere, 2009, 75(4): 417-434
[3] 罗义, 周启星. 抗生素抗性基因(ARGs)——一种新型环境污染物[J]. 环境科学学报, 2008, 28(8): 1499-1505
Luo Y, Zhou Q X. Antibiotic resistance genes (ARGs) as emerging pollutants [J]. Acta Scientiae Circumstantiae, 2008, 28(8): 1499-1505 (in Chinese)
[4] Gu C, Karthikeyan K G. Interaction of tetracycline with aluminum and iron hydrous oxides [J]. Environmental Science & Technology, 2005, 39(8): 2660-2667
[5] Batt A L, Kim S, Aga D S. Comparison of the occurrence of antibiotics in four full-scale wastewater treatment plants with varying designs and operations [J]. Chemo sphere, 2007, 68(3): 428-435
[6] Gros M, Rodríguez-Mozaz S, Barceló D. Fast and comprehensive multi-residue analysis of a broad range of human and veterinary pharmaceuticals and some of their metabolites in surface and treated waters by ultra-high-performance liquid chromatography coupled to quadrupole-linear ion trap tandem mass spectrometry [J]. Journal of Chromatography A, 2012, 1248(27): 104-121
[7] Deng Y, Zhang Y, Gao Y, et al. Microbial community compositional analysis for series reactors treating high level antibiotic wastewater [J]. Environmental Science & Technology, 2011, 46(2): 795-801
[8] Proia L, Lupini G, Osorio V, et al. Response of biofilm bacterial communities to antibiotic pollutants in a Mediterranean River [J]. Chemosphere, 2013, 92(9): 1126-1135
[9] Matos M, Pereira M A, Parpot P, et al. Influence of tetracycline on the microbial community composition and activity of nitrifying biofilms [J]. Chemosphere, 2014, 117: 295-302
[10] Atoyan J A, Staroscik A M, Nelson D R, et al. Microbial community structure of a leach field soil: Response to intermittent aeration and tetracycline addition [J]. Water, 2013, 5(2): 505-524
[11] 国家环境保护局. 水和废水监测分析方法(第4版)[S]. 北京: 中国环境科学出版社, 2002
[12] Sule P, Wadhawan T, Wolfe A, et al. Use of the Bac Titer-Glo microbial cell viability assay to study bacterial attachment in biofilm formation [J]. Promega Notes, 2008, 99: 19-21
[13] Kim S, Eichhorn P, Jensen J N, et al. Removal of antibiotics in wastewater: Effect of hydraulic and solid retention times on the fate of tetracycline in the activated sludge process [J]. Environmental Science & Technology, 2005, 39(15): 5816-5823
[14] Smithwick E A H, Turner M G, Metzger K L, et al. Variation in NH4+mineralization and microbial communities with stand age in lodgepole pine (Pinus contorta ) forests, Yellowstone National Park (USA) [J]. Soil Biology and Biochemistry, 2005, 37(8): 1546-1559
[15] Kao-Kniffin J, Balser T C. Elevated CO2differentially alters belowground plant and soil microbial community structure in reed canary grass-invaded experimental wetlands [J]. Soil Biology and Biochemistry, 2007, 39(2): 517-525[16] Dong X, Huai-Ying Y, De-Yong G, et al. Soil microbial community structure in diverse land use systems: A comparative study using Biolog, DGGE, and PLFA analyses [J]. Pedosphere, 2008, 18(5): 653-663
[17] Niu C, Geng J, Ren H, et al. The strengthening effect of a static magnetic field on activated sludge activity at low temperature [J]. Bioresource Technology, 2013, 150: 156-162[18] 吴成强, 杨敏, 张昱. 低温生物膜和活性污泥的生物活性比较[J]. 应用与环境生物学报, 2005, 10(5): 647-650
Wu C Q, Yang M, Zhang Y. Comparison of microbial activities in bio-film reactor and in activated sludge reactor at low temperature [J].Chinese Journal of Applied & Environmental Biology, 2005, 10(5): 647-650 (in Chinese)
[19] 尹军, 桑磊, 李琳. ATP 检测在活性污泥工艺中的应用进展[J]. 吉林建筑工程学院学报, 2007, 3(24): 7-11
Yin J, Sang L, Li L. Status of application and study of ATP measurement in activated sludge process [J]. Journal of Jilin Architectural and Civil Engineering Institute, 2007, 3(24): 7-11 (in Chinese)
[20] 陈振翔, 于鑫, 夏明芳, 等. 磷脂脂肪酸分析方法在微生物生态学中的应用[J]. 生态学杂志, 2005, 24(7): 828-832
Chen Z X, Yu X, Xia M F, et al.Application of phospholipid fatty acid (PLFA) analysis in microbial ecology [J]. Chinese Journal of Ecology, 2005, 24(7): 828-832 (in Chinese)[21] Niu C, Geng J, Ren H, et al. The cold adaptability of microorganisms with different carbon source in activated sludge treating synthetical wastewater [J]. Bioresource Technology, 2012, 123: 66-71
[22] Yu K, Zhang T. Metagenomic and metatranscriptomic analysis of microbial community structure and gene expression of activated sludge [J]. Plos One, 2012, 7(5): e38183[23] Xia S, Jia R, Feng F, et al. Effect of solids retention time on antibiotics removal performance and microbial communities in an A/O-MBR process [J]. Bioresource Technology, 2012, 106: 36-43
[24] Begum S A, Batista J R. Microbial selection on enhanced biological phosphorus removal systems fed exclusively with glucose [J]. World Journal of Microbiology and Biotechnology, 2012, 28(5): 2181-2193
[25] Wang Z, Gao M, She Z, et al. Effects of hexavalent chromium on performance and microbial community of an aerobic granular sequencing batch reactor [J]. Environmental Science and Pollution Research, 2015, 22(6): 4575-4586[26] Shintani T, Liu W T, Hanada S, et al. Micropruina glycogenica gen. nov., sp. nov., a new Gram-positive glycogen-accumulating bacterium isolated from activated sludge [J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(1): 201-207
[27] Farkas M, Táncsics A, Kriszt B, et al. Zoogloea oleivorans sp. nov., a floc-forming, petroleum hydrocarbon-degrading bacterium isolated from biofilm [J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(Pt 1): 274-279
[28] Collado N, Buttiglieri G, Marti E, et al. Effects on activated sludge bacterial community exposed to sulfamethoxazole [J]. Chemosphere, 2013, 93(1): 99-106
◆
Environmental Concentration Antibiotic Selection Pressure Changed Microbial Community Composition of Activated Sludge
Zhang Yingying, Geng Jinju*, Ren Hongqiang, Xu Ke, Ding Lili
School of the Environment, Nanjing University, State Key Laboratory of Pollution Control and Resource Reuse, Nanjing 210023, China
Received 24 May 2015 accepted 10 July 2015

tetracycline; sulfamethoxazole; activated sludge; microbial community composition; wastewater treatment efficiency
国家自然科学基金(No.51278241)
张滢楹(1990-),女,硕士研究生,研究方向为污水深度处理,E-mail: zyyorwheat@163.com;
*通讯作者(Corresponding author), E-mail: jjgeng@nju.edu.cn
10.7524/AJE.1673-5897.20150524001
2015-05-24录用日期:2015-07-10
1673-5897(2015)5-066-09
X171.5
A
耿金菊(1978—),女,环境科学博士,副教授,主要研究方向水处理与水环境修复,废水深度处理及生物处理,污染物的环境行为及生态效应。
张滢楹, 耿金菊, 任洪强, 等. 环境浓度抗生素选择性压力改变活性污泥微生物群落结构[J]. 生态毒理学报,2015, 10(5): 66-74
Zhang Y Y, Geng J J, Ren H Q, et al. Environmental concentration antibiotic selection pressure changed microbial community composition of activated sludge [J]. Asian Journal of Ecotoxicology, 2015, 10(5): 66-74 (in Chinese)
