铜及其与四环素的联合暴露对斑马鱼胚胎的毒性效应
2015-03-14章强辛琦强丽媛程金平
章强,辛琦,强丽媛,程金平,*
1. 华东师范大学河口海岸学国家重点实验室,上海 200062 2. 香港城市大学深圳研究院,深圳 518057
铜及其与四环素的联合暴露对斑马鱼胚胎的毒性效应
章强1,2,辛琦1,2,强丽媛1,程金平1,2,*
1. 华东师范大学河口海岸学国家重点实验室,上海 200062 2. 香港城市大学深圳研究院,深圳 518057
近年来工业和养殖业中铜和四环素的滥用,导致了一定程度的水环境污染问题。为探究铜与四环素对水生生物的毒害作用,选择斑马鱼作为受试生物,研究了铜及其与四环素的联合暴露对斑马鱼胚胎的毒性效应,并进一步探索了其中可能的致毒机制。结果表明:铜在低浓度下(10%致死浓度LC10=2.5 μg·L-1,10%效应浓度EC10=0.1 μg·L-1)明显延迟了斑马鱼胚胎的孵化、卵黄囊吸收、头部、鱼鳔和体长等生长指标的发育,同时在心脏区域引起了明显的细胞凋亡效应。幼鱼体内总铜含量检测结果显示低浓度下铜的生物利用度相对更高。基因表达结果显示环境浓度的铜可能通过影响神经和心脏相关基因的表达引起斑马鱼胚胎的神经发育和心脏发育异常。铜和四环素的联合暴露实验结果表明二者的复合污染类型为拮抗作用,且两者相互作用可以形成络合物。综合以上结论,说明环境浓度的铜可能通过细胞凋亡、分子水平的变化等方式对水生生物的早期生长发育产生危害,如延迟生长发育、神经及心脏发育异常,另外铜可通过和四环素等环境中其他污染物的结合改变铜的生物有效性和毒性。
铜;四环素;络合物;斑马鱼胚胎;神经发育;心脏发育
铜是自然环境中大量存在的一种过渡元素。天然水体中的铜主要来自于工业、农业、生活废水的污染和水产养殖饲料中高铜和鱼药硫酸铜的大量使用。在现代产业中,铜被广泛应用于机械、电子、能源、石化和养殖等行业。据统计,2011年全球的精铜消费量为19.9百万t,而中国的精铜消费量更是从2001年的2.2百万t增长到2011年的7.8百万t,年平均增长率约为13%[1]。如此大的消费量必然会日益增加自然环境的承载量。全球范围内,铜在天然海水和淡水中的浓度水平分别为0.03~0.23 μg·L-1和0.20~30 μg·L-1[2]。近年在我国很多水环境中已检测到高浓度铜的存在,如在渤海湾水域中最高浓度甚至能达到2.8 mg·L-1[3]。另外铜作为一种重金属元素,它在生态系统中既不能被分解,也不能被消除[4],所以沉积相中的铜也会成为水体中铜的污染源之一,导致铜的水体污染具有持久性,因此受到环境科学界的广泛关注。
铜是许多酶类(如赖氨酰氧化酶、超氧化物歧化酶和细胞色素C氧化酶等)的主要构成成分之一[5],所以它是水生动物必需的营养元素之一,但高浓度的铜将变成一种抑制物或毒性物质[6],铜超过一定浓度就会成为环境污染物。因此调查铜在环境中的浓度和生物可利用性非常重要。生物体内的铜含量往往能较好地反映水环境中铜的污染程度。近年来有多篇文献记载了我国多地牡蛎中的铜含量。Wang等[7]首次报道了我国的“蓝牡蛎”现象,调查发现福建省九龙江口香港巨牡蛎(Crassostrea hongkongensis)的铜浓度为14.4 mg·g-1,肉组织呈现蓝色。一般水环境中铜的存在形态包括溶解态(溶解于水中)和颗粒态(存在于悬移质中的悬移态及存在于表层沉积物中的沉积态)。溶解态的铜又可以以自由离子、颗粒态、有机物或无机离子的结合态存在,其中自由铜离子(Cu2+)被认为是毒性最强的形态。已有的毒理学研究表明一定浓度的铜离子会对水生生物产生毒害作用[8-9]。鱼类早期发育阶段(胚胎和仔、稚、幼鱼)是对各种污染物最为敏感的阶段之一[10]。较低剂量的铜离子就可抑制胚胎的发育[11],且铜离子可穿过绒毛膜在胚胎内的不断积累,对胚胎造成较强的致畸作用[12-14],如胚胎尾巴弯曲、孵化失败和胚胎死亡等[12]。大多数重金属都有生殖毒性,铜也不例外。铜离子可以通过延缓性成熟[15]、降低受精率[16]、产卵量减少[17]等方式来抑制水生动物的繁殖。铜离子对斑马鱼胚胎早期发育的影响主要表现在抑制孵化、抑制生长发育和心率加快等方面[9]。但目前铜对水生生物的毒理机制研究还不完善,本文主要针对铜对鱼类胚胎的毒性效应及其分子机制展开研究。
在天然水体环境中,颗粒态铜的存在形态可分为离子交换态、碳酸盐结合态、铁锰水合氧化物结合态、有机硫化物结合态及残渣态,前3种形态对生物有潜在有效性,后2种不易被生物吸收利用。而水体中存在大量的阴离子配位体、胶体及有机颗粒,易与自由态的铜离子结合形成不易被生物吸收的形态[18]。在自然环境特别是水环境中,重金属污染往往以复合污染的形式出现,复合污染的多样性使得污染物的形态和毒性效应更为复杂。鉴于在养殖业中四环素也常作为治疗药物和饲料添加剂,我们通过文献资料的调研,发现目前我国的部分水域中同时存在高浓度的溶解性铜和四环素。如在黄浦江水域,检测出溶解性铜的浓度能达到22.9 μg·L-1[19],并且四环素最高能达到1 000.0 μg·L-1[20]。因此,我们进一步研究了铜离子与四环素的复合污染。
现有的文献研究也表明四环素类抗生素能够抑制水生动物多种酶的活性,如乙氧基试卤灵-O-去乙基酶、β-半乳糖苷酶等,并可能产生免疫毒性和基因毒性[21-23],这说明四环素类抗生素对水生生物产生的环境效应不容忽视。此前也有研究表明,相比于铜的单一毒性,铜和四环素的联合毒性变弱了[24]。但目前对此类复合污染的毒性研究还十分有限。本文选取斑马鱼胚胎作为模式生物开展了铜对斑马鱼胚胎的毒性机制研究及铜和四环素复合污染的初步探索。
1 材料与方法(Materials and methods)
1.1 实验试剂和仪器
四环素(tetracycline,纯度90%)购自上海迈瑞尔化学技术有限公司,CuSO4·5H2O(纯度98%)、麻醉剂(tricaine)和RNA later试剂购于西格玛奥尔德里奇公司,其他试剂(分析纯)均购自于国药集团化学试剂有限公司。
多功能光照培养箱(BSP-100,上海,上海博讯实业有限公司)、体视显微镜(SMZ168,厦门,Motic)、Leica荧光体视镜(M165FC,德国,Leica)、实时荧光定量PCR仪(ABI-7500,美国,美国应用生物系统公司)。
1.2 斑马鱼胚胎的收集和急性暴露实验设计
健康良好的野生型斑马鱼成鱼购于花鸟市场。本次用于鱼卵采集的成鱼已在实验室驯养3个月以上,光周期为14 h/10 h(昼/夜)。每天喂食丰年虾幼虫2次,每天清理残饵和粪便。养殖水为充分曝气、除氯24 h以上的自来水。水质条件为:pH(7±0.5),溶解氧为(8±0.5) mg·L-1,硬度(230±0.5) mg·L-1(以CaCO3计),水温控制在(28±0.5) ℃。胚胎培养水(ISO 6341-1982):称取0.294 g CaCl2·2H2O,0.123 g MgSO4·7H2O,0.065 g NaHCO3和0.006 g KCl溶于充分曝气的1 L去离子水中,作为实验稀释液和对照组实验用水。选用饲养3个月以上的成鱼用于产卵。在繁殖前1天,将雌鱼和雄鱼以1:2的比例放入孵化盒中。设定好开灯时间,第2天开灯30 min内斑马鱼产卵完成。用胚胎培养水冲洗胚胎,在体视镜下挑取受精正常的胚胎用于暴露实验。
斑马鱼胚胎毒性实验根据斑马鱼实验用书[25]进行。在体视显微镜下挑选受精后正常发育4 hpf(hours post-fertilization,hpf)的胚胎进行染毒实验。本实验选用的是12孔细胞培养板作为染毒器具,每个孔中盛4 mL的溶液和20颗正常发育的受精卵,每个浓度4个平行,共80枚胚胎,实验重复3次。在预实验基础上,对四环素设置3个浓度(10,100,1 000 μg·L-1),铜设置4个浓度(2.56 μg·L-1,25.6 μg·L-1,128 μg·L-1,256 μg·L-1)。实验过程中,铜单一毒性及其和四环素的联合毒性暴露同时进行,浓度组成分别为0,铜(2.56 μg·L-1,25.6 μg·L-1,128 μg·L-1,256 μg·L-1),铜和四环素(2.56+10,2.56+100,2.56+1000;25.6+10,25.6+100,25.6+1000;128+10,128+100,128+1000;256+10,256+100,256+1000)μg·L-1。
为避免药物因为光照而降解,将受试胚胎置于黑暗培养箱中,温度为(28±1)℃。24 h更换1次溶液。暴露过程中的死亡胚胎和幼鱼及时丢弃,避免对其他的胚胎和幼鱼产生影响。暴露周期为96 hpf,记录了24 hpf、48 hpf、72 hpf、96 hpf的死亡率、72 hpf孵化率。其中暴露96 hpf后的胚胎用0.016 mol·L-1的Tricaine进行麻醉,之后在显微镜下拍照,用于统计96 hpf的畸形率和表型。其中死亡率为死亡数与胚胎总数之比,孵化率为72 hpf的总孵化数与胚胎总数之比,用ImageJ软件统计斑马鱼幼鱼的体长、卵黄囊以及脑部面积。
1.3 暴露溶液和鱼体内吸收的总铜含量分析
将暴露96 h后的斑马鱼幼鱼用胚胎培养水清洗2次后,在体视镜下将斑马鱼幼鱼的头部和躯干分开,收集进行称重,然后参照文献[26]的方法进行样品的前处理。首先,用2 mL浓硝酸对斑马鱼进行消解2 h(180 ℃),之后再加入1 mL的30% H2O2持续1 h(120 ℃)。然后在样品中加入去离子水,使硝酸浓度稀释到体积分数为2%,最后用ICP-MS(Element 2,美国,赛默飞世尔科技公司)检测鱼体内的总铜含量。在检测暴露溶液中的铜元素前,应用孔径为2.0 nm的超滤管进行过滤,以去除溶液中络合物等形态的铜,过滤后的溶液中基本上都是铜离子,然后再应用ICP-MS进行检测。
1.4 Acridine orange (AO)染色
本文应用AO染色来反映铜离子是否导致斑马鱼胚胎产生细胞凋亡,及产生细胞凋亡的区域。参考其他文献的方法[27],经过不同浓度的铜暴露96 h后,每个浓度随机取10条幼鱼,在质量百分比为30%的Danieau溶液(58 mmol·L-1NaCl, 0.7 mmol·L-1KCl, 0.4 mmol·L-1MgSO4, 0.6 mmol·L-1Ca(NO3)2, 5 mmol·L-1HEPES, pH 7.4)中清洗2次,再转移到含有5 μg·mL-1AO的30%Danieau溶液中,在室温下避光振荡20 min。然后再于30% Danieau溶液中清洗3次,每次5 min。之后用0.016 mol·L-1的Tricaine麻醉胚胎3 min,然后用Leica荧光体视镜进行细胞凋亡的检测,有凋亡的细胞会呈现明显的亮点。
1.5 基因表达分析
应用实时荧光定量RT-PCR技术研究了铜对斑马鱼在分子水平上是否影响神经和心脏发育相关基因的表达。96 hpf后收集保存于-20 ℃的RNA later中的胚胎,每个浓度有3个平行,每个平行20个胚胎。然后用Qiagen的RNA提取试剂盒(Qiagen,China Co., Ltd,上海,中国)提取总RNA,再用紫外荧光分光光度计(SMA4000,Merioton)进行总RNA浓度和质量检测,参照说明书再使用反转录试剂盒(Takara,Dalian,Japan)合成cDNA。斑马鱼β-actin基因被选为参照基因进行实验数据的归一化。在NCBI官网上进行引物序列的设计(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)(表1)。使用实时荧光定量PCR仪(ABI-7500)进行实时定量PCR实验。实验数据用2-△△CT方法进行基因表达倍数的分析。
1.6 统计分析
用SPSS 17.0软件 (SPSS, Chicago, IL, USA)计算EC10和LC10,显著性分析之前用SPSS 17.0对数据进行方差齐次检验,然后用单因素方差分析(ANOVA)进行对照组和处理组的显著性分析。百分比的数据先转换为平方根的反正弦,再进行ANOVA分析。采用双因子方差分析法来评价铜和四环素的联合作用。当P<0.05时,说明2个因素具有协同或者拮抗作用。实验数据用平均值(mean)±标准误差(SEM)表示。当P<0.05时具有显著性差异。用Graphpad Prism 5.0作图。
2 结果(Results)
2.1 铜对斑马鱼胚胎生长发育的影响
生长发育相关指标的表型和数据如图1和表2所示。96 h周期的实验结果表明,与对照相比,浓度大于25.6 μg·L-1的铜可以显著增加斑马鱼胚胎的死亡,其中在25.6 μg·L-1、128 μg·L-1和256 μg·L-1下的死亡率分别为31.5%、34.8%和46.7%。从亚致死效应方面来看,铜能够显著抑制斑马鱼胚胎的发育,主要表现在抑制孵化、体长、脑部发育、卵黄囊营养物质的吸收和鱼鳔的生成等效应。当铜浓度达到2.56 μg·L-1就显著抑制了这些生长指标的发育,其中孵化率在对照组能达到97.7%,而2.56 μg·L-1处理组的孵化率只有23.0%,更高浓度组没有幼鱼孵化。96 h正常发育的幼鱼体长为3.8 mm,铜的4个浓度处理组的体长都显著受到了抑制,分别为3.5,3.5,3.4,3.4 mm。另外,经铜处理后的幼鱼的卵黄囊吸收明显受到抑制,卵黄囊面积明显比对照组大。铜的急性暴露结果表明,高于2.56 μg·L-1的铜显著抑制了幼鱼鱼鳔的发育,256 μg·L-1处理组无鱼鳔形成。有研究表明铜离子对斑马鱼胚胎的24 h的LC50为319.4 μg·L-1[28],硫酸铜对斑马鱼成鱼96 h的LC50为375.0 μg·L-1[29]。本文数据统计分析结果表明铜对斑马鱼胚胎的96 h的LC10和EC10分别为2.5 μg·L-1和0.1 μg·L-1。
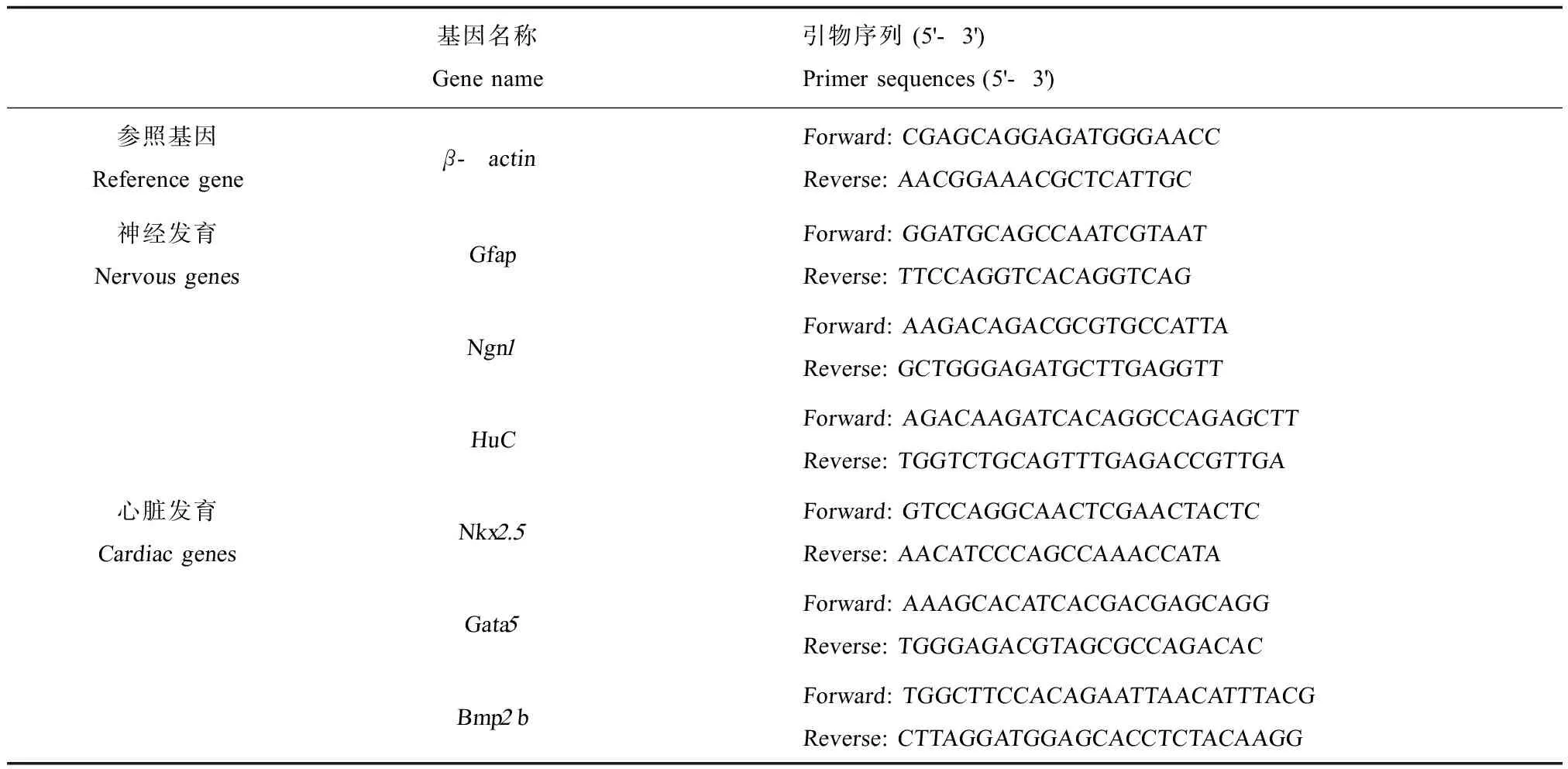
表1 应用在本研究中的基因的引物序列Table 1 Gene and sequence of forward (Fw) and reverse (Rv) primers used in this study
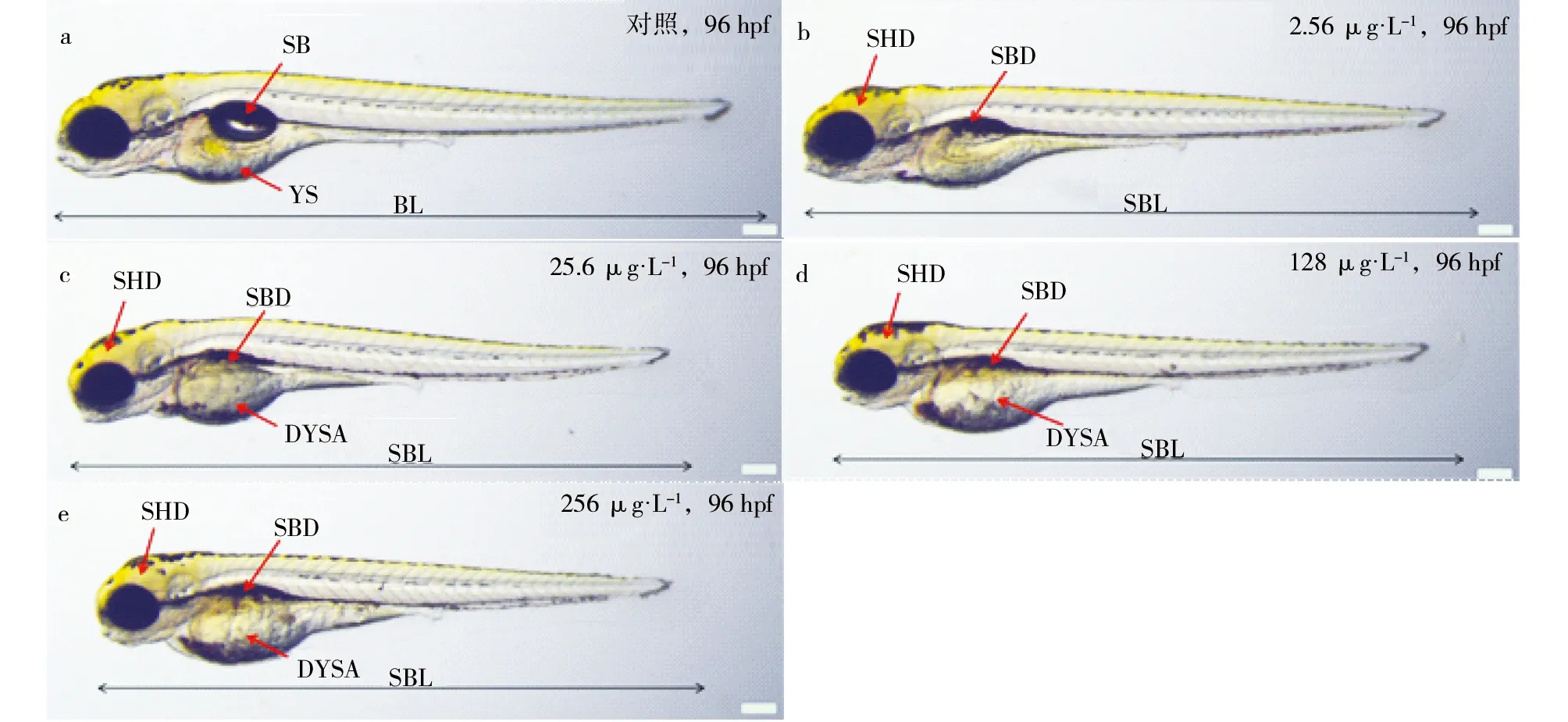
图1 铜处理96 hpf后,斑马鱼幼鱼的表型图
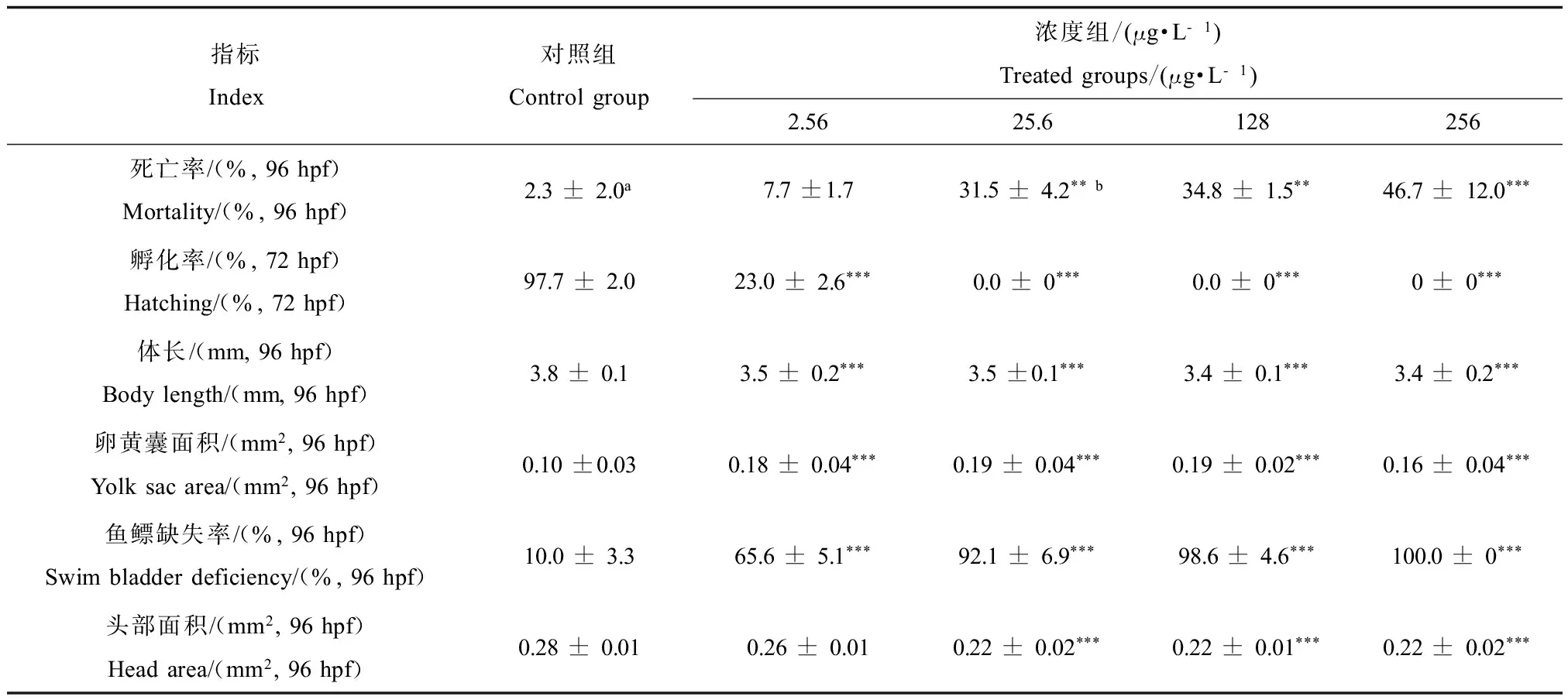
表2 铜对斑马鱼胚胎各指标的影响Table 2 Effects of Cu on the total mortality, hatching and morphologies of zebrafish embryos/larvae
注: a, 数值表示为平均值±标准偏差(n=4); b, 显著性分析使用单因素方差分析(One-way ANOVA),*P<0.05, **P<0.01,***P<0.001。
Note: a, All values were presented as the mean ± standard error; b, Significant differences between mean values were determined using one-way analysis of variance (ANOVA),*P<0.05, **P<0.01, ***P<0.001.
2.2 AO染色
AO染色是一种核酸染色技术,已有文献表明AO染色可以反映细胞凋亡情况[27,30]。实验结果表明:发育到96 hpf时,在正常胚胎中无明显的凋亡信号,但是有大量的凋亡细胞出现在处理组的胚胎(铜,2.56,25.6和128 μg·L-1)的心脏区域(图2b,2c,2d)。另外,还有少量的凋亡细胞集中在幼鱼的尾部,尤其是在2.56 μg·L-1的铜处理组。
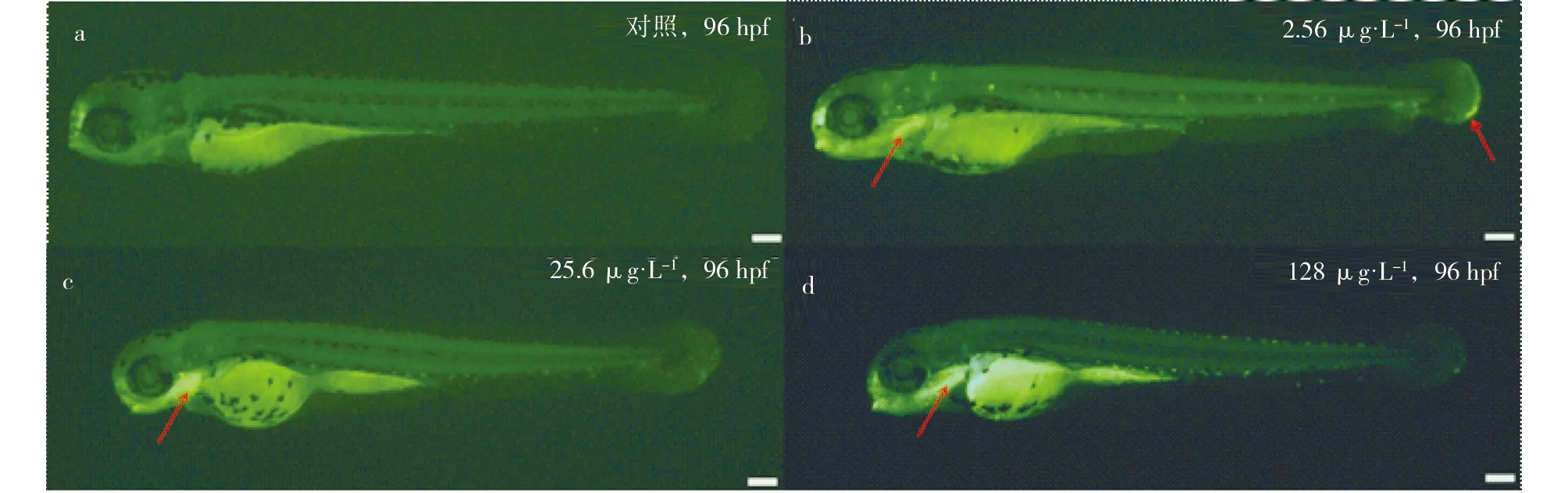
图2 铜处理96 hpf后,斑马鱼幼鱼的AO染色图
2.3 斑马鱼幼鱼体内总铜含量
ICP-MS的结果显示包括对照组的所有幼鱼体内都有检测到铜的存在(图3),这可能是因为自然水体中也存在一定浓度的铜。鱼体内总铜含量随着铜暴露浓度的升高而增加,对照组幼鱼体内总铜平均含量为0.08 μg·g-1,处理组分别为0.14,0.16,0.20,0.26 μg·g-1。其中,25.6 μg·L-1,128 μg·L-1和256 μg·L-1处理组的幼鱼体内总铜含量有显著性提高。然而,斑马鱼胚胎体内总铜含量并没有随暴露浓度的升高而成比例增加。即铜在较低浓度时生物可利用性相对更高,高浓度时虽然体内总量增多,但是吸收率反而较低。
斑马鱼幼鱼不同部位的总铜含量如图4所示。

图3 暴露96 hpf后,幼鱼体内总铜的检测含量
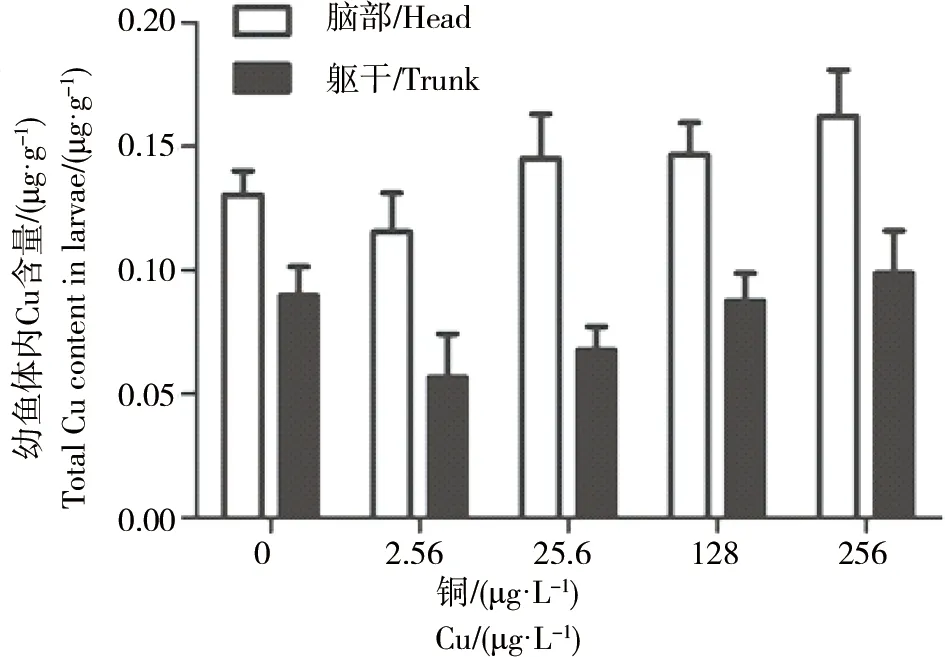
图4 斑马鱼胚胎暴露于Cu 96 hpf后,幼鱼不同部位总铜的检测含量
结果显示,在铜处理组的幼鱼的脑部和躯干部位的总铜含量是随着铜暴露浓度升高而增加;在对照组和所有处理组的幼鱼脑部的总铜的含量都比躯干部位要高,说明斑马鱼胚胎吸收铜后主要富集于脑部。
2.4 对胚胎神经和心脏发育相关基因的影响
斑马鱼胚胎早期发育的前96 hpf是斑马鱼神经和心脏发育的关键时期。从表型图可以看出铜导致幼鱼的头部变小(图1和表2),而神经系统的发育是头部发育过程中重要的组成部分,因此本文选取了神经发育相关基因来研究铜在分子水平上对斑马鱼胚胎神经发育的影响(图5)。结果表明,Gfap基因在2.56 μg·L-1的铜处理组下的表达显著被抑制,而在25.6 μg·L-1和128 μg·L-1下显著上调表达;2.56 μg·L-1的铜显著刺激了HuC基因的表达量;Ngn1基因在铜的低浓度组(2.56 μg·L-1和25.6 μg·L-1)下表达显著上调。

图5 铜暴露96 hpf后,斑马鱼胚胎神经和心脏发育相关基因的表达情况
在心脏发育方面,斑马鱼胚胎的心率加快[9]和心脏区域的细胞凋亡说明了铜可能导致斑马鱼胚胎心脏发育异常。基因表达结果也证实了铜可以显著改变心脏相关基因的表达,25.6 μg·L-1的铜能显著刺激Nkx2.5和Bmp2b基因的表达,而Gata5基因在铜所有浓度组都显著下调了。
2.5 铜和四环素的联合毒性效应及作用机制
铜和四环素的联合暴露毒性数据如图6显示,死亡率(图6a)的结果显示,在没有加入四环素时,256 μg·L-1的铜对斑马鱼胚胎96 h的死亡率为46.7%,但加入1 000 μg·L-1的四环素后,死亡率降低为36.7%。在孵化率方面(图6b),2.56 μg·L-1处理组的孵化率为23.0%,当加入不同浓度的四环素后,联合暴露组的孵化率都显著性地上升,分别为50.6%,63.9%和64.4%。其他指标如头部面积和卵黄囊面积(图6c,6d)方面,四环素的加入明显在不同程度上显著促进了这些指标的发育。
ICP-MS检测结果显示在联合暴露组中,2.56、25.6和128 μg·L-1铜处理组的幼鱼体内总铜含量并没有受到四环素的影响,但已经显示出总铜含量降低的趋势,在铜的最高浓度组(256 μg·L-1)中,加入四环素(100 μg·L-1和1 000 μg·L-1)后显著降低了幼鱼体内吸收的总铜含量(图7)。
利用双因子方差对联合暴露的数据分析后,本研究发现联合暴露的毒性指标,如死亡率、孵化率、卵黄囊和头部面积等效应都显著低于铜的单独暴露组(P<0.05),斑马鱼幼鱼体内吸收的总铜含量显示了四环素的加入明显降低了斑马鱼幼鱼体内吸收的总铜含量,这些联合暴露的数据表明四环素的加入明显缓解了铜对斑马鱼胚胎的毒性,因此推测铜和四环素的复合污染效应属于拮抗作用。已有文献通过红外光谱技术证实了土霉素和铜离子相互作用可以形成一种新的化学结构的络合物[31],我们根据联合毒性的表型效应和幼鱼体内吸收的总铜含量,推测铜离子和四环素相互作用可能形成如图8所示的络合物,而这种络合物形态的铜降低了铜的生物可利用性,其毒性比铜离子的毒性要低。
为了验证四环素和铜离子相互作用形成络合物的假设,本文进一步检测了铜的单独及复合污染的生物可利用浓度(图9)。检测结果显示2.56和25.6 μg·L-1的铜的暴露溶液中铜的实际浓度为3.8和24.8 μg·L-1,当加入100 μg·L-1的四环素后,两者混合溶液中铜的实际浓度为2.3和21.9 μg·L-1,分别下降了44.2%和11.7%。联合暴露溶液比铜的单独暴露溶液中的铜浓度低,表明四环素明显降低了铜的生物可利用浓度,即降低了溶液中的铜离子浓度,从而证实了四环素和铜相互作用形成了新的络合物。并且检测结果与联合毒性的表型效应以及斑马鱼幼鱼体内吸收的总铜含量是相吻合的。以孵化率为例,100 μg·L-1的四环素和2.56及25.6 μg·L-1铜的联合暴露组的孵化率明显比铜的单独暴露组的孵化率要高。
3 讨论(Discussion)
本研究选取了受精后4 h的斑马鱼胚胎用于铜的暴露试验,在致死毒性方面,不同时间段的死亡率统计结果表明铜对胚胎的致死率在4~24 hpf时间段最高,因为此时间段是斑马鱼胚胎的原肠胚期和细胞分裂阶段,相关研究表明此阶段是鱼类发育的关键期[32],选取发育初期阶段的斑马鱼胚胎用于水体污染物的毒性效应研究更为灵敏。
铜对斑马鱼胚胎的亚致死毒性效应方面,主要表现为孵化延迟、体长变短、卵黄囊吸收不全和鱼鳔缺失等效应,本文的研究结果在其他文献中也有报道[9,33]。孵化是斑马鱼胚胎发育过程中最明显的发育指标之一,本文结果显示2.56 μg·L-1的铜就可以明显抑制斑马鱼胚胎的孵化。斑马鱼胚胎的孵化主要是由生物酶、渗透作用和机械过程的结合导致的[34],因此铜引起的孵化延迟和失败可能是这些机制中的一个或多个导致的。卵黄囊是斑马鱼胚胎前期发育的唯一营养来源,一般卵黄囊体积是随着胚胎的发育而减小的,当斑马鱼胚胎卵黄囊中的营养吸收受到影响后,就会抑制斑马鱼胚胎的发育,本文的结果显示环境浓度的铜可以显著抑制斑马鱼的营养吸收,卵黄囊的面积明显比正常发育胚胎的卵黄囊大。鱼鳔在斑马鱼胚胎发育过程中对斑马鱼游泳和保持平衡方面起着很重要的作用[35]。在本研究中,环境浓度的铜明显抑制了斑马鱼胚胎鱼鳔的形成。本研究统计以上毒性数据分析得到铜对斑马鱼胚胎的96 h-LC10和EC10分别为2.5 μg·L-1和0.1 μg·L-1,再结合环境中铜的浓度,说明目前水环境中存在的铜可以影响较为敏感的小型鱼类早期的生长发育,并可能对水生生态系统产生一定的风险。而ICP-MS的结果说明我们需要进一步研究污染物对生物体的生物有效浓度和生物利用度,这对于明确污染物安全浓度是非常重要的。

图6 铜与四环素的联合毒性表型效应
此前已有文献表明铜可以导致斑马鱼成鱼的鱼鳃产生细胞凋亡,并推测出可能的细胞凋亡信号通路[36]。本文中应用AO染色对铜是否对斑马鱼早期发育产生细胞凋亡进行了研究,结果显示,环境浓度的铜可以对斑马鱼胚胎产生细胞凋亡,主要集中于心脏区域,说明了细胞凋亡是铜对斑马鱼产生毒性的主要途径之一,而心脏可能是铜对斑马鱼产生毒性的潜在靶标位置。相关研究还表明铜可以导致斑马鱼胚胎心率在28 hpf时加快[9],并在120 hpf时会减少斑马鱼幼鱼的功能性神经丘(functional neuromasts)生成,而这一功能的缺失将会导致斑马鱼胚胎早期的定位能力下降[9]。根据上述结果,我们推测铜会影响斑马鱼胚胎的神经和心脏发育。本研究中的表型数据也表明铜会导致斑马鱼幼鱼的头部变小,而头部发育和神经系统发育有直接联系。在此基础上,进一步应用RT-PCR对心脏和神经发育相关基因的表达进行了验证。在神经系统发育过程中,Gfap和Ngn1对于中胚层细胞向神经细胞分化、神经系统细胞的形成和成熟、大脑皮层的发育等过程十分关键[37-38]。HuC属于RNA结合蛋白家族,对于神经系统早期发育十分重要,在神经分化和成熟过程中扮演重要角色,其可通过增加mRNA的稳定性而对神经细胞的功能有维持作用[39]。结果证实,低浓度(2.56~256 μg·L-1)的铜可以提高Gfap、HuC和Ngn1基因的表达量,说明环境浓度的铜可能通过影响神经发育相关基因的表达对斑马鱼胚胎造成了部分神经发育的损害。在心脏发育过程中,Nkx2.5在心脏传导系统、心房形成等方面起着重要作用[40]。在斑马鱼中,Gata5和Bmp2b是Nkx2.5的上游基因,本研究中低浓度铜的处理组(2.56和25.6μg·L-1)导致了Gata5的下调,但Bmp2b没有显著变化,这说明铜可能通过Gata5基因来调控Nkx2.5的表达,而Nkx2.5的表达量上升表明铜可能影响了斑马鱼胚胎的心脏发育。这与芘(pyrene)导致的心脏毒性机制类似[41]。我们推测铜最终通过上调Nkx2.5基因表达从而引起了心脏发育异常,心率的改变可能和这些基因变化有关,这有待于后续研究的证实。

图7 铜与四环素联合暴露斑马鱼胚胎96 hpf后,幼鱼体内的总铜含量

图9 单一铜溶液以及铜和四环素的混合溶液中铜的检测浓度

图8 铜离子与四环素可能形成的络合物的化学结构图
在自然环境因素中,铜对水生生物的毒性以及生物有效性取决于铜的浓度及形态。在所有形态中,自由离子态铜的毒性最强,而络合态或其他吸附形态的铜的毒性均比离子态铜的毒性低[42]。已有研究表明土霉素和铜离子形成一定结构的络合物[31],鉴于土霉素和四环素化学结构类似,所以我们推测铜离子和四环素相互作用可能形成如图8所示化学结构的络合物形态,这种形态铜的毒性要比铜离子要低,且不易被生物体吸收,即降低了铜的生物可利用浓度。铜的暴露溶液及四环素和铜的混合溶液中铜的检测浓度证实了四环素和铜离子相互作用产生络合物的假设。另外联合暴露得到的表型指标,如死亡率、孵化率、卵黄囊面积等(图5),也表明铜离子与一定量的四环素结合可以缓解铜对斑马鱼胚胎的毒性。而斑马鱼幼鱼体内总铜检测含量显示,联合暴露的幼鱼体内的总铜含量要比单独暴露的幼鱼体内的总铜含量要低,进一步说明四环素与铜的联合暴露可能降低了铜的生物可利用性。利用双因子方差分析法来评价铜和四环素的联合作用类型,最终结果显示铜和四环素的复合污染环境效应属于拮抗作用。
综上所述,本文研究结果表明:1)环境浓度的铜(2.56、25.6、128和256 μg·L-1)对斑马鱼胚胎的亚致死效应主要为延迟胚胎的生长发育,表现在孵化延迟、体长变短、头部变小、卵黄囊吸收不全、鱼鳔缺失等方面;铜对斑马鱼胚胎96 h的LC10和EC10分别为2.5 μg·L-1和0.1 μg·L-1。2)AO染色试验表明铜可以诱导斑马鱼的心脏区域产生细胞凋亡。3)基因表达分析表明环境浓度的铜可能通过影响神经和心脏相关基因的表达引起斑马鱼胚胎的神经发育和心脏发育异常。4)斑马鱼幼鱼对不同浓度铜的生物有效吸收并不相同,且低浓度铜的生物有效性更高,需更加重视低浓度铜导致的环境效应。5)联合暴露数据表明四环素可以缓解铜对斑马鱼胚胎的毒性,两者的复合污染效应为拮抗作用。6)四环素和铜相互作用形成一种络合物,降低了铜离子的生物有效浓度和毒性。
[1] 潘科, 朱艾嘉, 徐志斌, 等. 中国近海和河口环境铜污染的状况[J]. 生态毒理学报, 2014, 9(4): 618-631
Pan K, Zhu A J, Xu Z B, et al. Copper contamination in coastal and estuarine waters of China [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 618-631 (in Chinese)
[2] Flemming C, Trevors J. Copper toxicity and chemistry in the environment: A review [J]. Water, Air, and Soil Pollution, 1989, 44(1-2): 143-158
[3] Xu L, Wang T Y, Ni K, et al. Metals contamination along the watershed and estuarine areas of southern Bohai Sea, China [J]. Marine Pollution Bulletin, 2013, 74(1): 453-463
[4] Pujin V, Djukie N, Maletin S, et al. Content of heavy metals in some fish species in the section of the Danube flowing through Voiv dina [J]. Water Science & Technology, 1990, 22(5): 79-85
[5] Stohs S J, Bagchi D. Oxidative mechanisms in the toxicity of metal ions [J]. Free Radical Biology Medicine, 1995, 18(2): 321-336
[6] De Boeck G, Meeu W, De Coen W, et al. Tissue-specific Cu bioaccumulation patterns and differences in sensitivity to waterborne Cu in three freshwater fish: Rainbow trout (Oncorhynchus mykiss), common carp (Cyprinus carpio) and gibel carp (Carassius auratus gibelio) [J]. Aquatic Toxicology, 2004, 70(3): 179-188
[7] Wang W X, Yang Y, Guo X, et al. Copper and zinc contamination in oysters: Subcellular distribution and detoxification [J]. Environmental Toxicology and Chemistry, 2011, 30(8): 1767-1774
[8] Abdel-Tawwab M, Mousa M A A, Abbass F E. Growth performance and physiological reponse of African catfish,Clarias gariepinus (B.) fed organic selenium prior to the exposure to environmental copper toxicity[J]. Aquaculture, 2007, 272(1-4): 335-345
[9] Johnson A, Carew E, Sloman K A. The effects of copper on the morphological and functional development of zebrafish embryos [J]. Aquatic Toxicology, 2007, 84(4): 431-438
[10] Westernhagen von H. Sublethal effects of pollutants on fish eggs and larvae[D]. New York, USA: Academic Press, 1988: 253-234
[11] 姚纪花, 周平凡. 铜、锌和甲胺磷对大鳞副泥鳅胚胎发育和仔鱼成活的影响[J]. 上海水产大学学报, 1997, 6(1): 11-16
Yao J H, Zhou P F. Effects of copper, zinc and methamidophos on the embryo development and larva survival of loach Paramisgurns dabyanus sauage [J]. Journal of Shanghai Fisheries University, 1997, 6(1): 11-16 (in Chinese)
[12] 柳敏海, 陈波, 罗海忠. 五种重金属对早繁鮸鱼胚胎和仔鱼的毒性效应[J]. 海洋渔业, 2007, 29(1): 57-62
Liu M H, Chen B, Luo H Z. Toxic effects of five heavymetals on the embryos and larvae of Miichthys miiuyBasilewsky during early developing stages [J]. Marine Fisheries, 2007, 29(1): 57-62 (in Chinese)
[13] 吴鼎勋, 洪万树. 四种重金属对鮸状黄姑鱼胚胎和仔鱼的毒性[J]. 台湾海峡, 1999, 18(2): 186-190
Wu D X, Hong W S. Study on toxicity of four heavy metals to embryo and larval of Nibea miichthioides [J]. Journal of Oceangraphy in Taiwan Strait, 1999, 18(2): 186-190 (in Chinese)
[14] 柳学周, 徐永江, 兰功刚. 几种重金属离子对半滑舌鳎胚胎发育和仔稚鱼的毒性效应[J]. 海洋水产研究, 2006, 27(2): 33-42
Liu X Z, Xu Y J, Lan G G. Toxic effects of several heavy metals on the embryos, larvae of Cynoglossus semilaevis Günther [J]. Marine Fisheries Research, 2006, 27(2): 33-42 (in Chinese)
[15] Koivisto S, Ketola M. Effects of copper on life-history traits of Daphnia pulex and Bosmina longirostris [J]. Aquatic Toxicology, 1995, 32(2/3): 255-269
[16] Reichelt-Brushett A J, Harrison P L. The effect of selected trace metals on the fertilization success of several scleractinian coral species [J]. Coral Reefs, 2005, 24: 524-534
[17] Garnacho E, Tyler P A, Peck L S. Reproduction, seasonality, and copper toxicity in the coastal mysid Praunus flexuosus [J]. Journal of the Marine Biological Association of the United Kingdom, 2001, 81: 433-440
[18] Sadiq M. Toxic Metal Chemistry in Marine Environments [M]. 1992
[19] 王红艳, 郜洪文, 周丹红. 氯磺酚偶氮罗丹宁分光光度法测定天然水中痕量铜(Ⅱ) [J]. 光谱实验室, 2010, 27(3): 1172-1177
Wang H Y, Hao H W, Zhou D H. Determination of trace amounts of copper (II) in natural water by spectrophotometry with sulfochlorophenolazorhodanine [J]. Chnese Journal of spectroscopy Laboratory, 2010, 27(3): 1172-1177 (in Chinese)
[20] 沈群辉, 冀秀玲, 傅淑珺, 等. 黄浦江水域抗生素及抗性基因污染初步研究 [J]. 生态环境学报, 2012, 21(10): 1717-1723
Shen Q H, Ji X L, Fu S J, et al. Preliminary studies on the pollution levels of antibiotic and antibiotic resistance genes in Huangpu River, China [J]. Ecology and Environmental Sciences, 2012, 21(10): 1717-1723 (in Chinese)
[21] Lunden T, Miettinen S, Lonnstroml L G, et al. Influence of oxytetracycline and oxolinic acid on the immune response of rainbow trout (Oncorhynchus mykiss ) [J]. Fish & Shellfish Immunology, 1998, 8(3): 217-230
[22] 曲甍甍, 孙立伟, 陈鋆, 等. 兽药添加剂阿散酸和土霉素的毒理学研究 [J]. 农业环境科学学报, 2004, 23(2): 240-242
Qu M M, Sun L W, Chen J, et al. Toxicological characters of arsanilic acid and oxytetracycline [J]. Journal of Agro-Environment Science, 2004, 23(2): 240-242 (in Chinese)
[23] 李兆利, 陈海刚, 徐韵, 等. 3种兽药及饲料添加剂对鱼类的毒理效应 [J]. 生态与农村环境学报, 2006, 22(1): 84-86
Li Z L, Chen H G, Xu Y, et al. Toxicological effects of three veterinary drugs and feed additives on fish [J]. Journal of Ecology and Rural Environment, 2006, 22(1): 84-86 (in Chinese)
[24] 刘臻. 典型抗生素对热带爪蟾胚胎生态毒性的研究 [D]. 上海: 上海海洋大学, 2012
Liu Z. Ecological toxicity of selected antibiotics on the embryo of Xenopus tropicalis [D]. Shanghai: Shanghai Marine University, 2012 (in Chinese)
[25] Westerfield M. The Zebrafish Book [M]. Eugene: University of Oregon Press, 1993
[26] Griffitt R J, Lavelle C M, Kane A S, et al. Chronic nanoparticulate silver exposure results in tissue accumulation and transcriptomic changes in zebrafish [J]. Aquatic Toxicology, 2013, 130: 192-200
[27] Zeng C, Sun H, Xie P, et al. The role of apoptosis in MCLR-induced developmental toxicity in zebrafish embryos [J]. Aquatic Toxicology, 2014, 149: 25-32
[28] 张亚辉, 刘征涛, 王一喆, 等. Cu2+和Cd2+对斑马鱼胚胎早期发育的联合毒性 [J]. 环境科学研究, 2010, 23(11): 1415-1420
Zhang Y H, Liu Z T, Wang Y Z, et al. Joint toxicity of Cu2+and Cd2+to early development of zebrafish embryos [J]. Research of Environmental Science, 2010, 23(11): 1415-1420
[29] 张丽玉. 重金属铜对斑马鱼的急性毒理试验[D]. 漳州: 漳州师范学院, 2004
[30] Yuan G G, Wang Y M, Yuan X Y, et al. T-2 toxin induces developmental toxicity and apoptosis in zebrafish embryos [J]. Journal of Environmental Sciences, 2014, 26(4): 917-925
[31] Zhang Y, Cai X Y, Lang X M, et al. Insights into aquatic toxicities of the antibiotics oxytetracycline and ciprofloxacin in the presence of metal: Complexation versus mixture [J]. Environmental Pollution, 2012, 166: 48-56
[32] Luckenbach T, Kilian M, Triebakorn R, et al. Fish early life stage tests as a tool to assess embryo toxic potentials in small streams [J]. Journal of Aquatic Ecosystem Stress Recovery, 2001, 8: 355-370
[33] Zhang W, Miao Y, Lin K, et al. Toxic effects of copper ion in zebrafish in the joint presence of CdTe QDs [J]. Environmental Pollution, 2013, 176: 158-164
[34] Yamagami K. Mechanisms of hatching in fish: Secretion of hatching enzyme and enzymatic choriolysis [J]. American Zoologist, 1981, 21(2): 459-471
[35] Jönsson M E, Kubota A, Timme-Laragy A R, et al. Ahr2-dependence of PCB126 effects on the swim bladder in relation to expression of CYP1 and cox genes in developing zebrafish [J]. Toxicology and Applied Pharmacology, 2012, 265(2): 166-174
[36] Luzio A, Monteiro S M, Fontaínhas-Fernandes A A, et al. Copper induced upregulation of apoptosis related genes in zebrafish (Danio rerio) gill [J]. Aquatic Toxicology, 2013, 128-129: 183-189
[37] Tropepe V, Sive H L. Can zebrafish be used as a model to study the neurodevelopmental causes of autism? [J]. Genes Brain and Behavior, 2003, 2: 268-281
[38] Barres B A. The mystery and magic of glia: A perspective on their roles in health and disease [J]. Neuron, 2008, 60: 430-440
[39] Wilson S I, Edlund T. Neural induction: Toward a unifying mechanism [J]. Nature Neuroscience, 2001, 4: 1161-1168
[40] Pashmforoush M, Lu J T, Chen H, et al. Nkx2-5 pathways and congenital heart disease; loss of ventricular myocyte lineage specification leads to progressive cardiomyopathy and complete heart block [J]. Cell, 2004, 117: 373-386
[41] Zhang Y Y, Wang C G, Huang L X, et al. Low-level pyrene exposure causes cardiac toxicity in zebrafish (Danio rerio) embryos [J]. Aquatic Toxicology, 2012, 114-115: 119-124
[42] Huang T C, Chuang A, Wu S J, et al. Relationships among the species and forms of copper and biomass along the Erhjin Chi coastal water [J]. Acta Oceanographica Taiwanica, 1990, 25: 65-76
◆
Developmental Toxicity of Cu and Tetracycline on Zebrafish Embryos (Daniorerio)
Zhang Qiang1,2, Xin Qi1,2, Qiang Liyuan1, Cheng Jinping1,2,*
1. State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062, China 2. City University of Hong Kong Shenzhen Research Institute, Shenzhen 518057, China
Received 26 December 2014 accepted 30 April 2015
With the increase use of copper and tetracycline in industry and agriculture, their aquatic environmental concentration increased greatly in recent years. This study aims to examine the developmental toxicity of Cu and tetracycline on zebrafish embryos (Danio rerio) and further explore its molecular mechanism. Cu shows high toxicity to zebrafish embryos (LC10=2.5 μg·L-1, EC10=0.1 μg·L-1), retarding the development and inducing apoptosis in the heart area of zebrafish larvae. The in vivo uptake of total Cu (96 h) in exposed embryos suggests that the uptake rate is relatively higher in low concentrations as compared to that of high concentrations. Gene expression study results showed that exposure to Cu upregulated gene expression level of Nkx2.5, which is responsible to cardiac development in zebrafish larvae. Exposure to Cu affected the gene expression level of several neuron development governing genes selected in this study. The results obtained in the co-exposure to Cu and tetracycline suggest that the combined toxicity is antagonism. This study suggests that exposure to Cu inhibits embryonic growth, induces the developmental anomaly of the nervous and heart in zebrafish embryos at environmental relevant concentrations. Co-exposure of Cu with other environmental contaminants such as tetracycline can change the bioavailability and the associated toxicity of Cu in aquatic organisms.
Cu; tetracycline; complex; zebrafish embryos; neurodevelopment; cardiac development
国家自然科学基金(41101489);广东省自然科学基金(s2012010010847);教育部新世纪优秀人才计划项目(NECT-12-0181); 河口海岸学国家重点实验室自主课题(2012RCDW-01)
章强(1990-),男,硕士研究生,研究方向为环境毒理学,E-mail: zzggkobe@163.com;
*通讯作者(Corresponding author), E-mail: jinpingcheng@gmail.com
10.7524/AJE.1673-5897.20141226001
2014-12-26录用日期:2015-04-30
1673-5897(2015)5-035-12
X171.5
A
程金平(1978-),女,博士,研究员,主要研究方向为生态毒理学。
章强,辛琦,强丽媛, 等. 铜及其与四环素的联合暴露对斑马鱼胚胎的毒性效应研究[J]. 生态毒理学报,2015, 10(5): 35-46
Zhang Q, Xin Q, Qiang L Y, et al. Developmental toxicity of Cu and tetracycline on zebrafish embryos (Danio rerio) [J]. Asian Journal of Ecotoxicology, 2015, 10(5): 35-46 (in Chinese)
