CIK细胞疗法联合TACE治疗原发性肝癌患者临床疗效观察
2015-03-14张艳梅崔红利颜綦先孙志亚陈东风陈舜贤
张艳梅,崔红利,颜綦先,宋 娇,何 静,孙志亚,徐 祥,陈东风,陈舜贤
细胞因子诱导的杀伤细胞(CIK)是外周血单个核细胞在体外经多种细胞因子共同诱导而获得的一群以CD3+CD8+和CD3+CD56+为主的效应细胞群[1],具有T细胞强大的抗肿瘤活性和自然杀伤(NK)细胞的非主要组织相容性复合体(MHC)限制性的杀瘤活性[2],对肿瘤细胞具有高效的杀伤作用,能够提高机体免疫力,清除患者体内微小肿瘤残留病灶[3]。本研究分析了67例肝癌患者接受CIK细胞疗法联合TACE治疗的临床疗效及安全性,现报告如下。
1 资料与方法
1.1 研究对象 2012年2月~2014年2月间在本院确诊并行TACE术治疗的67例原发性肝癌患者,符合2009年发布的《原发性肝癌规范化诊治专家共识》的标准[4]。年龄>18岁,肝功能为Child-Pugh B级或C级,预计生存时间≥3个月;无生物制品过敏史,无严重细菌、病毒感染,非妊娠及哺乳期患者;患者或授权家属签署CIK细胞治疗知情同意书。排除标准:出现肝性脑病、消化道出血等严重并发症,其他病毒感染、酒精性、药物性肝损伤、严重凝血机制障碍、合并心、肝、肾、造血及代谢系统严重原发性疾病或严重全身感染者、存在化疗和TACE治疗禁忌证的患者。在67例原发性肝癌患者中,男性62例,女性5例;年龄28~83岁,平均年龄(55.3±11.6)岁。按是否联合CIK治疗分为联合治疗组32例和对照组35例。两组临床特征均无统计学差异。
1.2 治疗方法 67例均接受TACE治疗。主要化疗药为:奥沙利铂130 mg/m2、表柔比星5 mg/m2,丝裂霉素5~10 mg。栓塞剂选用超液态碘油(法国Guerbe公司)。第1次介入治疗与第2次介入治疗间隔4周,以后根据患者具体病情决定适当的治疗间隔。同时给予保肝、抗病毒、对症支持治疗等。
1.3 CIK细胞的制备与回输 取新鲜患者抗凝外周全血50 m L,经Ficoll淋巴细胞分离液梯度离心(2000 r/m,20 min),取液面交接处的细胞层,离心洗涤去除残留血小板及分离液后备用(2000 r/m,5 min)。用含有OKM100及56℃灭活的自体血浆的培养基调整细胞密度为(2~4)×106/m L,置于37℃,饱和湿度的5%CO2孵箱内培养。每3天换液1次,并加入重组人IL-2,浓度为1000 IU/μl,共培养14 d。为确保临床安全回输,收获细胞前进行细菌、真菌、支原体和内毒素检测;使用流式细胞仪对培养细胞进行免疫表型检测。每次回输细胞数量为1~2×1010个。联合治疗组在介入治疗后分别于第14 d、17 d和19 d,给予CIK细胞回输治疗(1个疗程)。以后根据患者病情及治疗意愿,继续应用CIK治疗,一般1~2个月给予1个疗程的回输治疗。联合治疗组接受CIK细胞治疗1~4个疗程。
1.4 外周血T细胞亚群检测 使用美国贝克曼Navios流式细胞仪检测。
1.5 疗效评价 所有病例均于首次TACE治疗前、治疗后2 m进行腹部CT检查。参考Karnofsky(KPS)评分评估生活质量,KPS增加≥10分为生活质量改善,增加<10分为生活质量稳定,减少≥10分为生活质量降低。临床疗效按实体瘤疗效判定标准(RECIST标准)[5]分为:完全缓解(CR):所有靶病灶消失,无新病灶出现,且肿瘤标志物正常,至少维持4 w;部分缓解(PR):靶病灶的最大径之和减少≥30%,至少维持4 w;疾病稳定(SD):靶病灶最大径之和缩小未达PR,或增大未达PD;疾病进展(PD):靶病灶最大径之和至少增加≥20%或出现新病灶。有效为CR+PR。无进展生存期为自患者确诊至首次发现疾病进展或任何原因发生死亡的时间。1.5随访 随访时间截止至2015年1月1日,随访时间为3~32月,平均12.9月。
1.6 统计分析 应用SPSS 18.0统计软件进行统计分析,计量资料以()表示,采用t检验。计数资料的比较采用卡方检验,采用Kaplan-Meier法计算无进展生存期。P<0.05为差异有统计学意义。
2 结果
2.1 免疫功能的变化 在CIK回输后,患者CD3+和CD4+细胞比例和C4+/CD8+比值明显上升,CD8+细胞比例下降,CIK治疗前后差异有统计学意义(P<0.05);而在TACE治疗前后两组患者 CD3+、CD4+、CD8+细胞百分率和CD4+/CD8+比值的变化均无统计学差异(P>0.05,表1),提示与单纯TACE术比,CIK联合TACE治疗可改善患者的免疫功能,从而提高机体自身抗肿瘤作用。
表1 联合治疗患者外周血T细胞亚群(%,)的变化
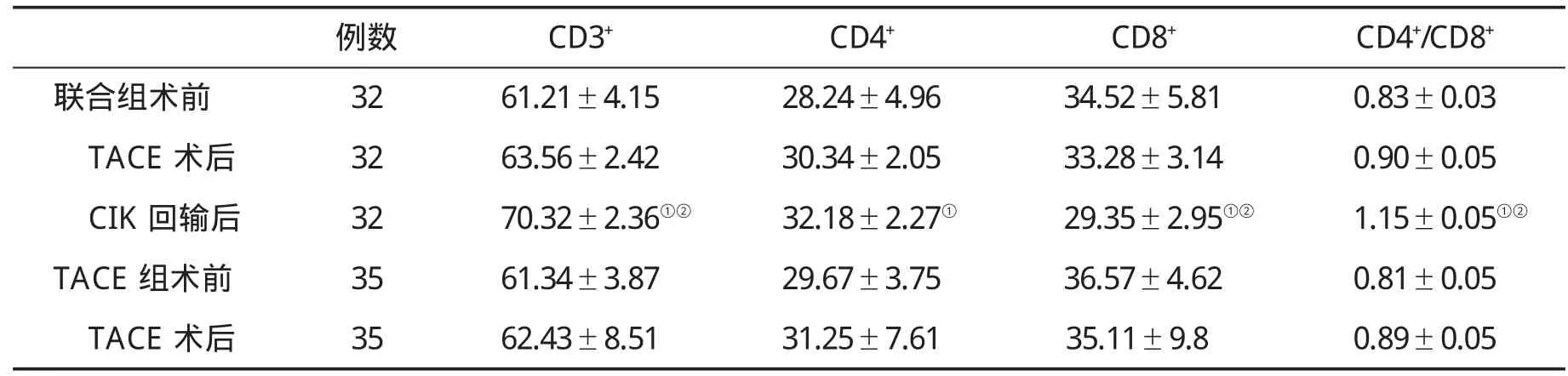
表1 联合治疗患者外周血T细胞亚群(%,)的变化
与TACE术后比,①P<0.05;②与TACE组术后比,P<0.05
例数 CD3+ CD4+ CD8+ CD4+/CD8+联合组术前 32 61.21±4.15 28.24±4.96 34.52±5.81 0.83±0.03 TACE术后 32 63.56±2.42 30.34±2.05 33.28±3.14 0.90±0.05 CIK回输后 32 70.32±2.36①② 32.18±2.27① 29.35±2.95①② 1.15±0.05①②TACE组术前 35 61.34±3.87 29.67±3.75 36.57±4.62 0.81±0.05 TACE术后 35 62.43±8.51 31.25±7.61 35.11±9.8 0.89±0.05
2.2 两组治疗前后KPS评分的变化 于首次TACE治疗前和治疗后2 m进行KPS评分。联合治疗组治疗前 KPS评分为(74.6±12.5),治疗后为[(83.4±14.7),P<0.05];对照组治疗前为(75.3±10.4),治疗后为[(80.5±18.3),P>0.05],提示两组患者治疗后生活质量均有改善,但联合治疗组生活质量改善程度与对照组比,具有显著性差异。
2.3 临床疗效评估 所有患者均于首次TACE治疗前和治疗后2 m进行腹部CT检查。发现两组均无完全缓解病例。联合治疗组PR高于对照组,但两组无显著性差异(P>0.05,表2),提示两组患者均有较高的部分缓解率,但肿瘤的影像学改变无显著性差异。
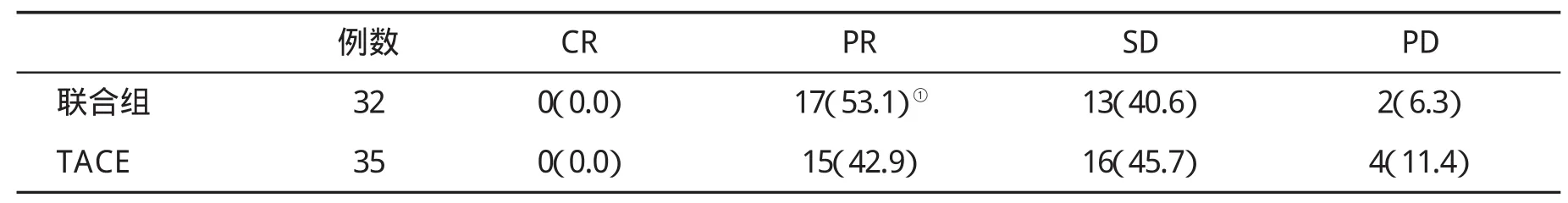
表2 两组临床疗效(%)比较
2.4 无进展生存期比较 联合治疗组患者中位无进展生存期(PFS)为 16 m(95%CI,14.2~17.8 m),对照组则为9.5 m(95%CI,7.2~11.7 m)。两组无进展生存期比较有统计学差异(P<0.05,图1),提示联合治疗更有利于延缓肿瘤进展,对提高患者生存期有一定的作用。
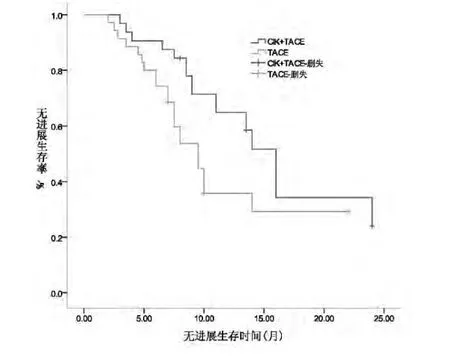
图1 联合治疗组与对照组无进展生存曲线比较 联合治疗组中位无进展生存期明显长于对照组(P<0.05)
2.5 CIK细胞治疗的安全性 在32例联合治疗患者中,所有患者共接受90次CIK治疗。在细胞回输后的观察期间,共有4例次(4.4%)出现发热,有1例(1.1%)出现轻度过敏反应,经过物理降温、抗过敏等对症治疗后,恢复正常,无其他不适反应出现。
3 讨论
研究表明[6~9]肝癌的发生、发展与机体的免疫功能状态密切相关。肝癌患者在免疫应答和启动免疫应答方面存在缺陷。原发性肝癌患者自身免疫调节机制紊乱,主要表现是细胞免疫功能被抑制[10~13]。T淋巴细胞介导的细胞免疫在机体抗肿瘤免疫中起重要作用。因此,检测T细胞亚群的分布可以反映机体抗肿瘤免疫的功能状况。CD3+CD4+T细胞为辅助性T细胞,CD3+CD8+T细胞为抑制性T细胞,CD3+CD8+和CD3+CD4+之间应处于动态平衡,CD4+/CD8+比值的下降意味着免疫功能处于抑制状态。本研究对患者TACE术前与术后第7天T细胞亚群进行分析,发现TACE术后CD3+、CD4+细胞百分率和C4+/CD8+比值有所上升,CD8+细胞百分率下降,这种差异虽无统计学意义,但仍提示肝癌患者基础免疫状态及应答能力低下。本研究同时发现CIK细胞治疗后患者外周血CD3+、CD4+细胞百分率、CD4+/CD8+比值明显高于TACE术后(P<0.05)。研究结果与佟立权等[14]报道相符,说明TACE术后联合应用CIK细胞治疗可以明显改善机体的免疫功能,有助于提高机体的抗肿瘤免疫效应。
目前认为,CIK细胞具有清除患者体内微小残留病灶、降低肿瘤复发率、延长患者生存期的作用[15~17]。Kim HM et al[18]发现CIK细胞在体内及体外均可发挥较强的杀伤肝癌细胞作用。在本研究中,联合治疗组部分缓解17例(53.1%),高于对照组的42.9%,但无显著性差异(P<0.05),提示在缩小肿瘤病灶方面,CIK细胞免疫疗法联合TACE术与单纯TACE组相比无显著优势,但联合治疗组患者的中位PFS明显长于对照组,且差异具有统计学意义(P<0.05)。由于本研究随访时间小于5年,未对总生存期进行分析,因此不能推断CIK细胞联合TACE治疗是否能延长患者总生存期。
对于不能彻底根治的恶性肿瘤,理想的治疗目标是减轻患者痛苦、提高生活质量。中晚期肝癌患者往往有腹水、疼痛、食欲不振、乏力、消瘦等症状,严重降低患者的生活质量。本研究发现经CIK细胞治疗后患者自觉症状改善,尤其食欲、体力好转较为明显,治疗后KPS评分显著提高,而单纯TACE治疗,治疗后KPS评分与术前比虽有提高但无显著性差异,与文献报道的结果相似[14,19],提示CIK细胞疗法联合TACE治疗能够更有效地改善患者的生活质量。
CIK治疗最常见的副反应是发热。有研究认为,生物治疗中患者中度发热是机体免疫功能正常反应的结果,该反应对治疗有益[20]。本研究中联合治疗组32例患者共接受了90次CIK治疗,其中4例次出现发热、1例次出现轻度过敏反应,副作用发生率低且严重程度轻,经对症处理后即可恢复正常,提示CIK细胞联合TACE治疗原发性肝癌是安全的。
CIK细胞免疫疗法联合TACE术与单纯TACE术相比,可以提高肝癌患者的细胞免疫功能,有助于延缓肿瘤进展,改善患者的生存质量,且治疗安全。但如何建立规范的CIK细胞免疫疗法及与TACE治疗相匹配的方案,降低治疗费用,是亟需解决的问题。
[1]Ferenci P,Fried M,Labrecque D,et al.World Gastroenterology Organisation Guideline.Hepatocellular carcinoma(HCC):a global perspective.J Gastrointest Liver,2010,19(3):311-317.
[2]Mesiano G,Todorovic M,Gammatoni L,et al.Cytokine-induced killer(CIK)cells as feasible and effective adoptive immunotherapy for the treatment of solid tumors.Expert Opinion Biol Ther,2012,12(6):673-684.
[3]Llovet JM,Bruix J.Molecular targeted therapies in hepatocellular carcinoma.Hepatology,2008,48(4):1312–1327.
[4]杨秉辉,丛文铭,周晓军,等.原发性肝癌规范化诊治的专家共识.实用肝脏病杂志.2009,12(5):321-328.
[5]Kim MN,Kim BK,Han KH,et al.Evolution from WHO to EASL and mRECIST for hepatocellular carcinoma:considerations for tumor response assessment.Expert Rev Gastroenterol Hepatol,2015,9(3):335-348.
[6]Spangenberg HC,Thimme R,Blum HE.Serum markers of hepatocellular carcinoma.Semin Liver Dis,2006,26(4):385-390.
[7]Firouznia K,Ghanaati H,Alavian SM,et al.Transcatheter arterial chemoembolization therapy for patients with unresectable hepatocellular carcinoma.Hepat Mon,2014,14(12):e25792.
[8]Gadaleta CD,Ranieri G.Trans-arterial chemoembolization as a therapy for liver tumors:New clinical developments and suggestions for combination with angiogenesis inhibitors.Crit Rev Oncol Hematol,2011,80(1):40–53.
[9]Imai N,Ishigami M,Ishizu Y,et al.Transarterial chemoembolization for hepatocellular carcinoma:A review of techniques.World J Hepatol,2014,6(12):844-850.
[10]Cheng HY,Wang XY,Zhao GL,et al.Imaging findings and transcatheter arterial chemoembolization of hepatic malignancy with right atrial embolus in 46 patients.World J Gastroenterol,2008,14(22):3563-3568.
[11]Greten TF,Wang XW,Korangy F.Current concepts of immune based treatments for patients with HCC:from basic science to novel treatment approaches.Gut,2015,64(5):842-848.
[12]Grivennikov SI,Greten FR,Karin M.Immunity,inflammation,and cancer.Cell,2010,140(6):883-899.
[13]Breous E,Thimme R.Potential of immunotherapy for hepatocellular carcinoma.J Hepatol,2011,54(4):830-834.
[14]佟立权,赵海峰,尤立光,等.TACE术联合自体CIK细胞治疗原发性肝癌的临床研究.中国普通外科杂志,2013,5(7):876-879.
[15]Cui JW,Wang NY,Zhao HJ,et al.Combination of radiofrequency ablation and sequential cellular immunotherapy improves progression-free survival for patients with hepatocellular carcinoma.Int J Cancer,2014,134(2):342-351.
[16]Huang ZM,Li W,Gao F,et al.Cytokine-induced killer cells in combination with transcatheter arterial chemoembolization and radiofrequency ablation for hepatocellular carcinoma patients.J Immunother,2013,36(5):287-293.
[17]Yu X,Zhao H,Liu L,et al.A randomized phase II study of autologous cytokine-induced killer cells in treatment of hepatocellular carcinoma.JClin Immunol,2014,34(2):194-203.
[18]Kim HM,Lim J,Yoon YD,et al.Anti-tumor activity of ex vivo expanded cytokine-induced killer cells against human hepatocellular carcinoma.Int Immunopharmacol,2007,7(13):1793-801.
[19]王春花,胡冰.CIK免疫治疗对肿瘤患者生活质量影响的观察.安徽医药,2013,17(3):406-408.
[20]Hui D,Qiang L,Jian W,et al.A randomized,controlled trial of postoperative adjuvant cytokine-induced killer cells immunotherapy after radical resection of hepatocellular carcinoma.Dig Liver Dis,2009,41(1):36-41.
