黄曲霉毒素B1及其吸附剂对断奶仔猪生长性能和空肠消化酶活性的影响
2015-03-14李建功陈代文毛湘冰萍王曲圆王慧芬罗钧秋
李建功 陈代文 余 冰 何 军 毛湘冰 虞 洁 郑 萍王曲圆 王慧芬 曾 珠 罗钧秋
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,雅安 625014)
黄曲霉毒素(aflatoxin,AF)是一类由黄曲霉和寄生曲霉等产毒真菌通过聚酮途径所产生的一类真菌次级代谢产物,在1961年英国发生的10万只火鸡突发性死亡事件首次被发现[1]。随着对AF的深入研究发现,AF尤其是黄曲霉毒素B1(aflatoxin B1,AFB1)具有很强致癌和致畸作用。AFB1在机体内代谢主要经肠道吸收,在肝脏内经羟基化、去甲基和环氧化作用后发挥其基因毒性和细胞毒性。大量研究证实AFB1可通过降低肝脏抗氧化水平,诱发氧化应激,抑制免疫系统激活,降低动物采食量、日增重和饲料转化效率,影响动物生长性能[2]。肠道作为最早接触毒素的部位,同时作为消化吸收的主要场所,与动物的生长性能存在直接关系,但目前AFB1对断奶仔猪肠道消化吸收功能的研究尚不明朗。因此,本试验旨在以断奶仔猪为模型,通过在霉变饲粮中添加外源性AFB1,研究以AFB1为主的作用因素对断奶仔猪生长性能和空肠消化酶活性的影响,同时评价吸附剂的吸附效果,为其在生产实践中的推广应用提供理论支持。
1 材料与方法
1.1 试验材料
AFB1吸附剂主要成分为蒙脱石。
饲粮中AFB1来源于低含量的霉变玉米和本实验室利用产毒菌株通过发酵技术发酵而来。经检测,AFB1组和AFB1+吸附剂组AFB1含量分别为288和290μg/kg。
AFB1含量采用GB/T 17480—2008中的酶联免疫法(ELISA)测得[3]。
1.2 试验设计
试验采用2×2因子设计,分为4个组。选取28日龄的“杜×长×大”三元杂交断奶仔猪72头,依体重相近、公母各占1/2的原则,分为对照组(基础饲粮)、吸附剂组(基础饲粮+0.25%吸附剂)、AFB1组(霉变玉米饲粮,AFB1预期含量为300μg/kg)和AFB1+吸附剂组(霉变玉米饲粮+0.25%吸附剂),每组6个重复,每个重复3头仔猪,试验期35 d,于试验第22~28天进行消化代谢试验。霉变玉米饲粮为霉变玉米100%替代基础饲粮中正常玉米的饲粮。
1.3 基础饲粮
基础饲粮营养水平参照NRC(2012)仔猪营养需要标准并结合生产实际配制,其组成及营养水平见表1。饲粮形态为粉料。
1.4 饲养管理
饲养管理在四川农业大学动物营养研究所试验基地进行。试验期间,温湿度适宜,自由采食、饮水,日喂 4 次(08:00、12:00、16:00、20:00),每次喂料量以饱食后料槽内略有剩余为度,每天详细记录各圈猪的采食量,其余管理按常规进行。分别于试验的第15天和试验结束日早上空腹称重。于试验期第22~28天进行消化试验。
1.5 样品采集与处理
血样:试验第36天08:00,对空腹12 h的试验猪只进行空腹称重后,每重复选1头接近平均体重的仔猪,前腔静脉采血10 m L,静置30 m in后,3 000 r/m in离心10 m in,分离血清,-20℃保存待测。
组织样品:猪只采血完毕后,耳缘静脉注射盐酸-氯丙嗪(3 mg/kg BW)麻醉处死,打开腹腔,分离肝脏和空肠,迅速采集肝脏左叶部分样品固定于10%福尔马林溶液中,用于制作病理切片。取空肠中段刮取黏膜,装于冻存管内,-70℃保存待测。
粪样收集:采用部分收粪法连续收集4 d的粪样。每天结束后将收集的粪样称重,按每100 g加10%H2SO45 m L进行固氮处理,数滴甲苯防腐,混匀粪样,置于-20℃的冰箱中。试验期结束后,将4 d收集到同一重复猪的粪样混匀,烘干、粉碎、过筛,制得风干样,-20℃保存。
1.6 测定指标及方法
1.6.1 生长性能
于试验起始和结束时08:00空腹称重,计算平均日增重(average daily gain,ADG)、平均日采食量(average daily feed intake,ADFI)和料重比(feed/gain,F/G)。
1.6.2 养分表观消化率
采用内源性指示剂测定饲粮常规养分表观消化率。饲粮和粪样的粗灰分(ash)、粗蛋白质(CP)、消化能(DE)、钙(Ca)和磷(P)含量的测定参照张丽英[4]主编的《饲料分析及饲料质量检测技术》中的常规方法进行,内源性指示剂含量采用GB/T 23742—2009[5]方法测定。
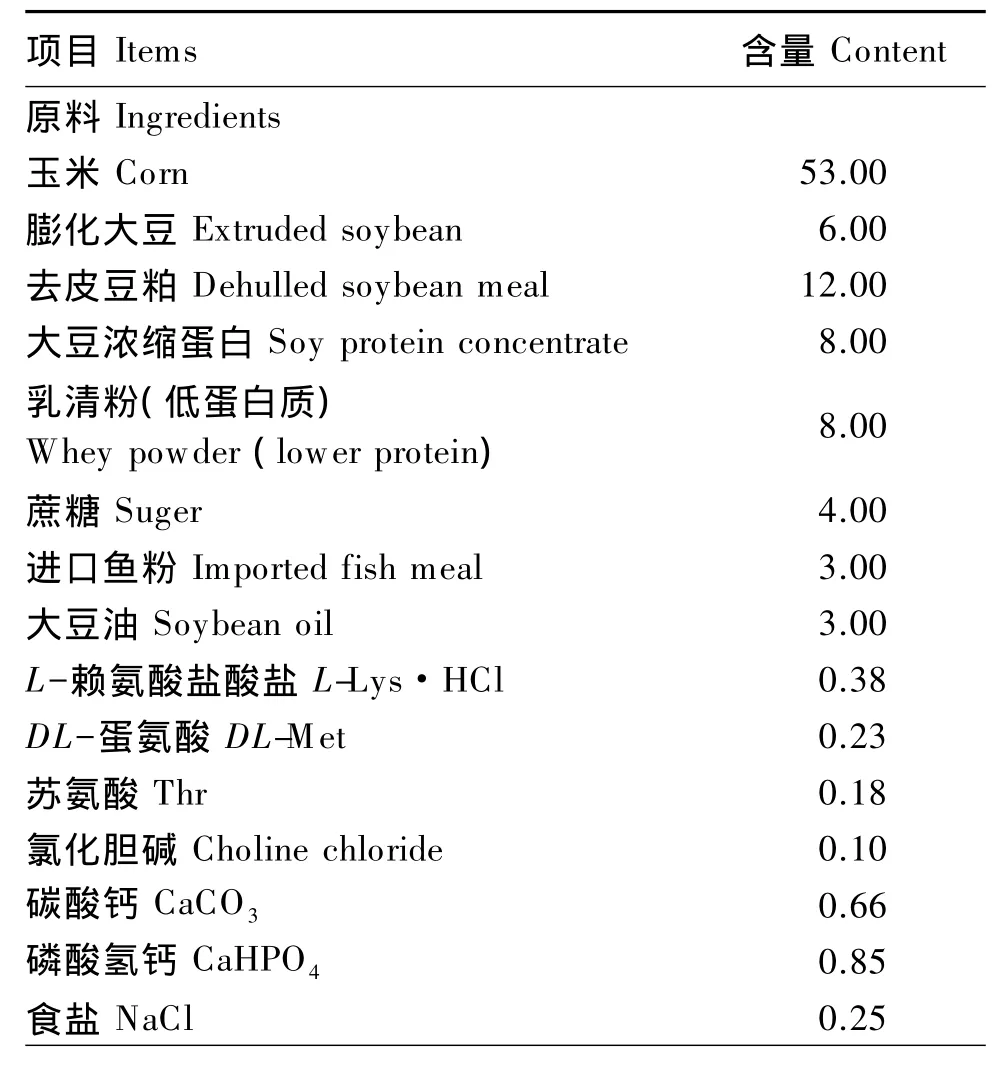
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
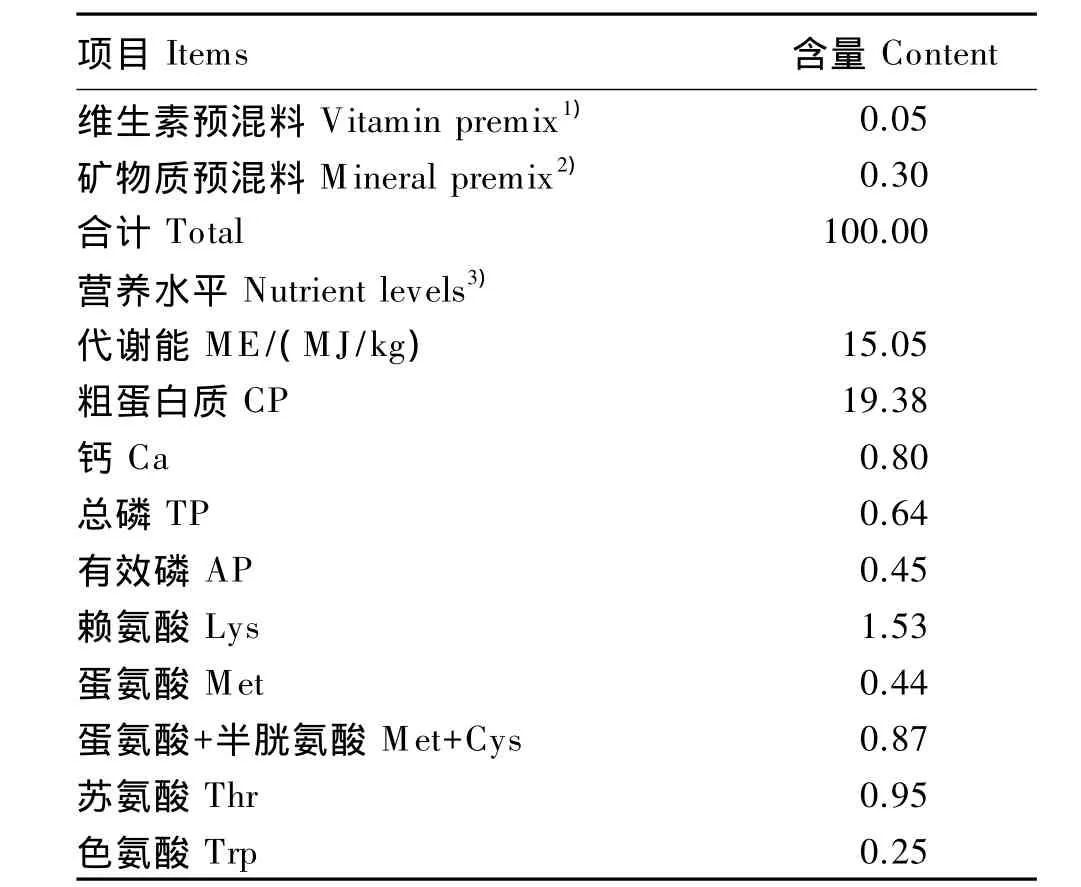
续表1
1.6.3 肝脏组织病理变化
对固定于10%甲醛固定液中的肝脏组织块经修理、包埋、切片等处理,制成6μm的切片,苏木精-伊红(HE)染色,光学显微镜下进行组织病理学观察。
1.6.4 血清生化指标
血清总蛋白(total protein,TP)、白蛋白(album in,ALB)、和尿素氮(urea nitrogen,UN)含量采用南京建成生物工程研究所试剂盒测定,然后计算球蛋白(globulin,GLB)含量,计算公式如下:
GLB=TP-ALB。
1.6.5 空肠黏膜消化酶活性
二糖酶:蔗糖酶、麦芽糖酶、乳糖酶的活性采用南京建成生物工程研究所试剂盒测定。
寡肽酶:羧肽酶A(carboxypeptidase A,CPA)、二肽基肽酶Ⅳ(dipeptidyl peptidase,DPP-Ⅳ)、氨肽酶(am inopeptidase,APN)、γ-谷氨酰转移酶(γglutamyltransferase,GGT)活性采用酶联免疫法测定,试剂盒来自Rapidbio Biosource R&D(美国)。
1.7 数据统计分析
采用Excel 2010整理,以重复为单位统计分析,数据采用SAS 9.0统计软件中的一般线性模型(GLM)程序对数据进行2×2两因子方差分析,并用Duncan氏法进行多重比较,模型主效应包括AFB1(0或300 μg/kg)、吸附剂(0或 0.25%)以及二者之间的互作,以P<0.05为差异显著,结果以平均值±标准差表示。
2 结果
2.1 AFB1及其吸附剂对断奶仔猪生长性能的影响
由表2可知,AFB1及其吸附剂对断奶仔猪ADG、ADFI和 F/G 无显著影响(P>0.05),且二者无显著交互作用(P>0.05)。
2.2 AFB1及其吸附剂对断奶仔猪养分表观消化率的影响
由表3可知,AFB1及其吸附剂对断奶仔猪饲粮CP、ash、DE、P和Ca的表观消化率无显著影响(P>0.05),且二者对 CP、ash、DE、P 的表观消化率无显著的交互作用(P>0.05),对Ca的表观消化率有交互作用的趋势(P=0.05)。
2.3 AFB1及其吸附剂对断奶仔猪血清生化指标的影响
由表4可知,AFB1及其吸附剂对断奶仔猪血清TP、ALB、GLB和 UN含量无显著影响(P>0.05),且二者无显著交互作用(P>0.05)。
2.4 AFB1及其吸附剂对断奶仔猪肝脏组织结构的影响
由图1可知,对照组和吸附剂组断奶仔猪肝脏组织形态结构正常,肝索和肝窦均较清晰,而AFB1组肝细胞肿胀,肝索排列紊乱,细胞结构模糊,胞浆内见有形态不规则的空泡。AFB1+吸附剂组病变程度相对较轻,肝组织病理学变化主要以肝细胞轻度萎缩,肝细胞以颗粒变性为主。
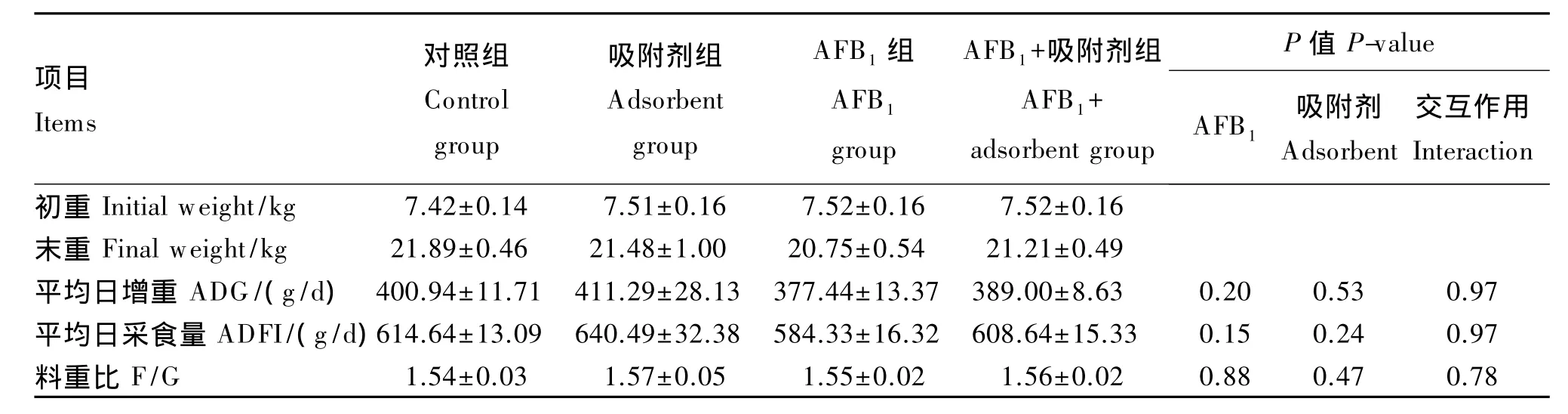
表2 AFB1及其吸附剂对断奶仔猪生长性能的影响Table 2 Effects of AFB1 and adsorbent on grow th performance of weaned piglets
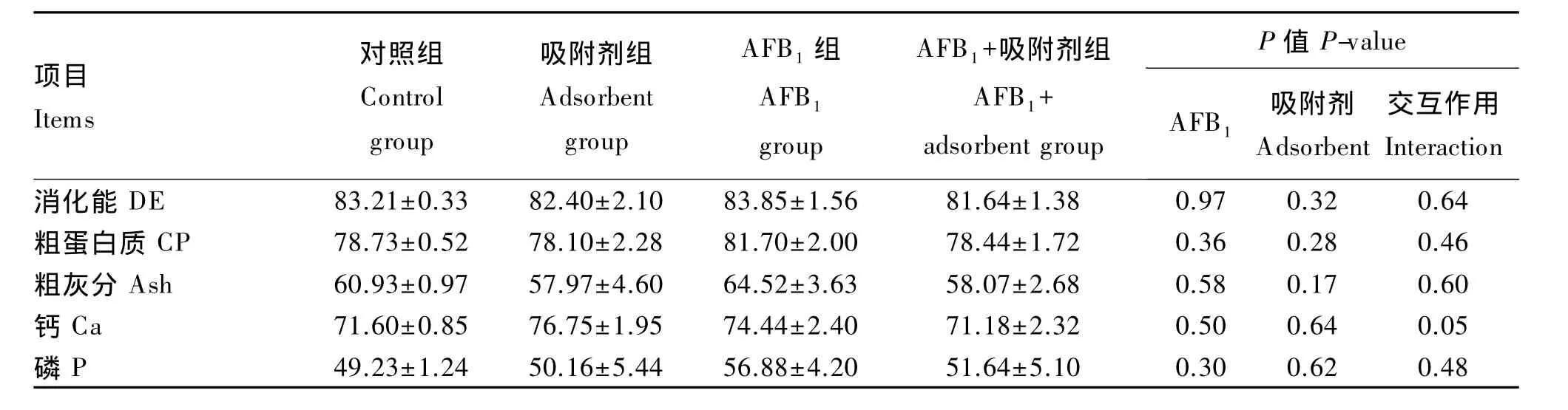
表3 AFB1及其吸附剂对断奶仔猪养分表观消化率的影响Table 3 Effects of AFB1 and adsorbent on nutrient apparent digestibility of weaned piglets
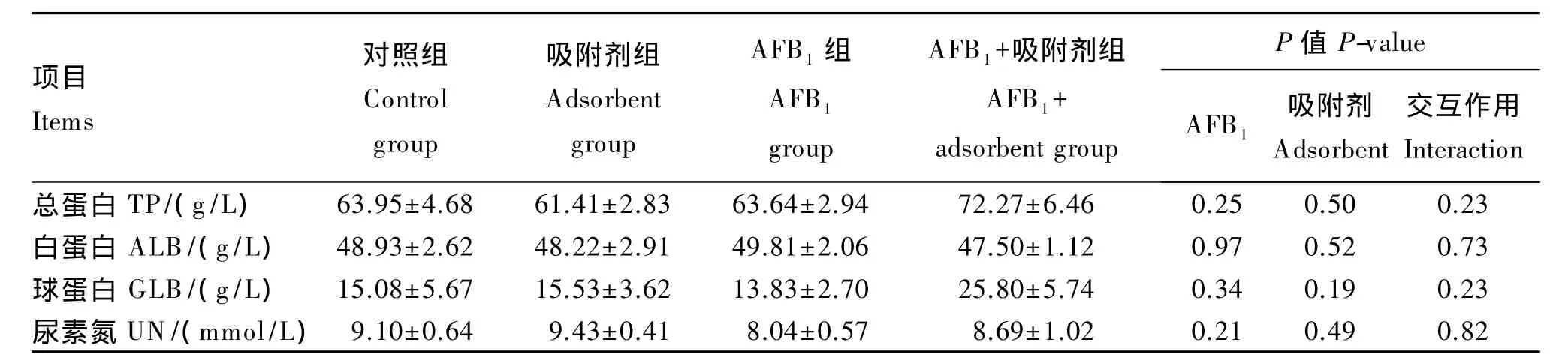
表4 AFB1及其吸附剂对断奶仔猪血清生化指标的影响Table 4 Effects of AFB1 and adsorbent on serum biochem ical parameters of weaned piglets
2.5 AFB1及其吸附剂对断奶仔猪空肠消化酶活性的影响
由表5可知,AFB1对断奶仔猪空肠黏膜二糖酶和寡肽酶活性影响不显著(P>0.05)。与对照组相比,吸附剂显著降低了蔗糖酶和乳糖酶的活性(P<0.05),对麦芽糖酶活性有降低的趋势(P=0.07)。AFB1和吸附剂二者对2类消化酶活性的影响均无显著交互作用(P>0.05)。
3 讨论
3.1 AFB1及其吸附剂对断奶仔猪生长性能的影响
AFB1作为一种剧毒物质,高剂量极易造成死亡,低剂量则会由于累积效应导致动物慢性中毒[2]。虽然AFB1在各年全国饲料抽检中均有发现,但含量总体不高,因此在生产中多表现慢性中毒现象。于会民等[6]研究报道,断奶仔猪饲粮中添加 100μg/kg的 AFB1,饲喂 30 d后,ADG和ADFI下降了 6.41%和 3.45%。史莹华等[7]报道,AF能显著降低猪的生长性能,ADG降低了12.90%,F/G 升高了 7.54%。张玲等[8]用 AFB1含量216μg/kg的自然霉变玉米代替正常玉米饲喂断奶仔猪21 d后也发现,自然霉变组猪只的ADG和ADFI均显著降低。本研究采用AFB1300μg/kg剂量,属于中低剂量水平,试验结果表明,AFB1组仔猪ADG和ADFI分别降低了5.75%和4.93%,F/G无显著变化。添加吸附剂后仔猪ADG 和 ADFI提高了 3.00%和 4.00%,这与前人研究结果一致,说明AFB1可能会通过抑制仔猪的ADFI降低 ADG,从而影响生长性能。雷晓娅[9]试验发现AFB1霉变饲粮可通过降低采食量抑制生长,并且在相同采食水平下,AFB1霉变饲粮与正常饲粮组相比,可改善仔猪的生长效应。当添加AFB1吸附剂后,由于对毒素的吸附作用,一定程度上减缓了AFB1进入机体的速度,从而在ADG和ADFI略有改善。
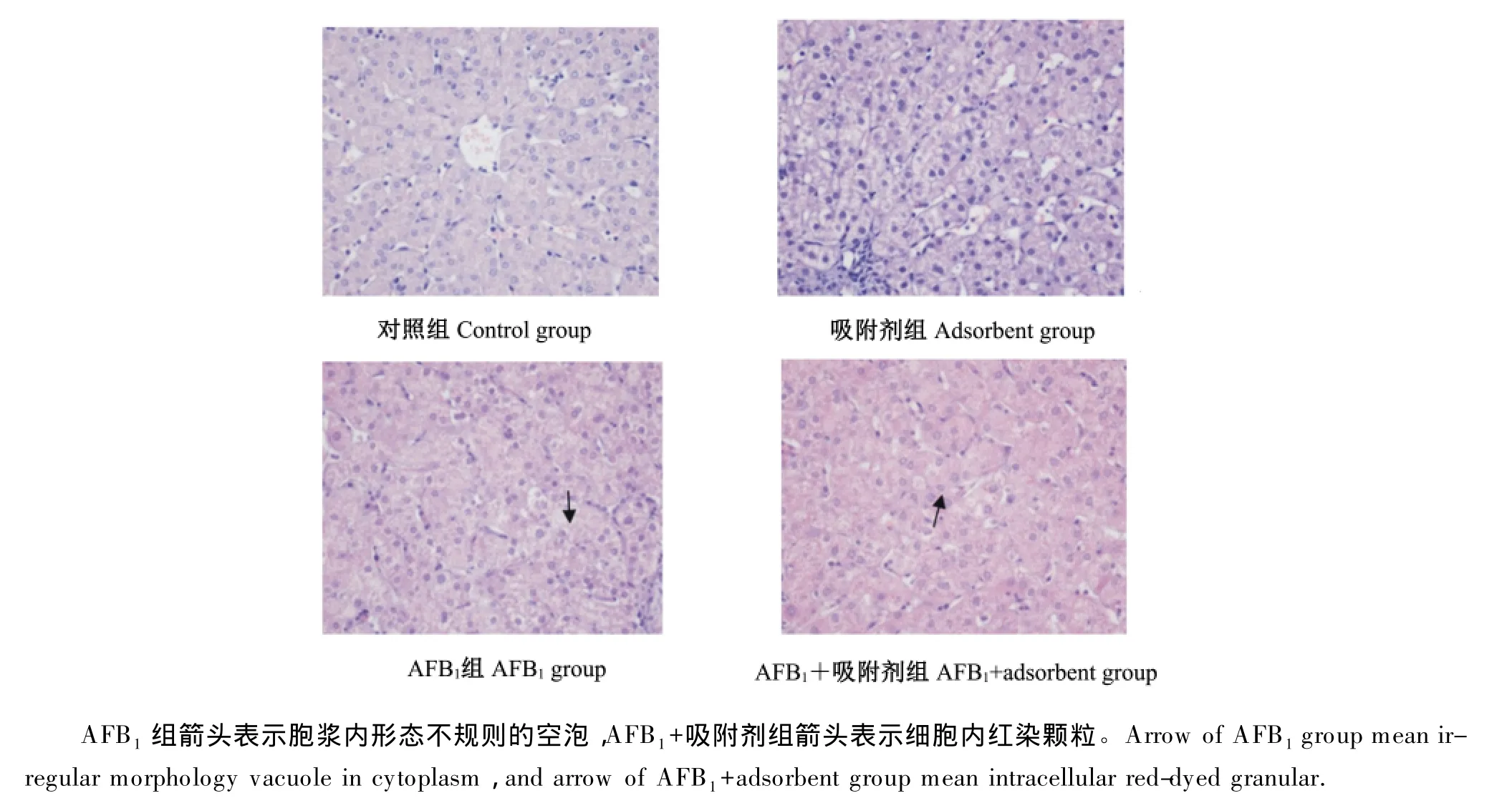
图1 AFB1及其吸附剂对断奶仔猪肝脏组织结构的影响Fig.1 Effects of AFB1 and adsorbent on the organizational structure of liver of weaned piglets
3.2 AFB1及其吸附剂对断奶仔猪血清生化指标的影响
血清TP、ALB、GLB和UN含量可在一定程度上反映动物肝脏和肾脏的健康状态。Denli等[10]在肉鸡饲粮中添加1 mg/kg的AFB1可显著降低血清TP和ALB的含量。Marin等[11]研究发现,断奶仔猪饲粮中添加140、280μg/kg AFB1后,血清TP、ALB和GLB含量并没有发生显著性改变。姚丽欣[12]在育肥猪饲粮中添加 300、600μg/kg的AFB1饲喂10周后发现,各组和各时间段猪血清UN的含量均无显著性变化。Lindemann 等[13]和 Harvey 等[14]在育肥猪饲粮中分别添加2 500和800μg/kg的AFB1也发现试验组血清中的UN含量无显著变化。上述各位作者的结论与本试验研究结果相一致,说明AFB1在低剂量和短期时间内,对机体蛋白质合成代谢影响不显著,其原因可能是断奶仔猪肝脏组织细胞较强的再生功能,使得虽然有一部分肝脏细胞发生病变但肝脏总的的合成代谢功能影响不显著。
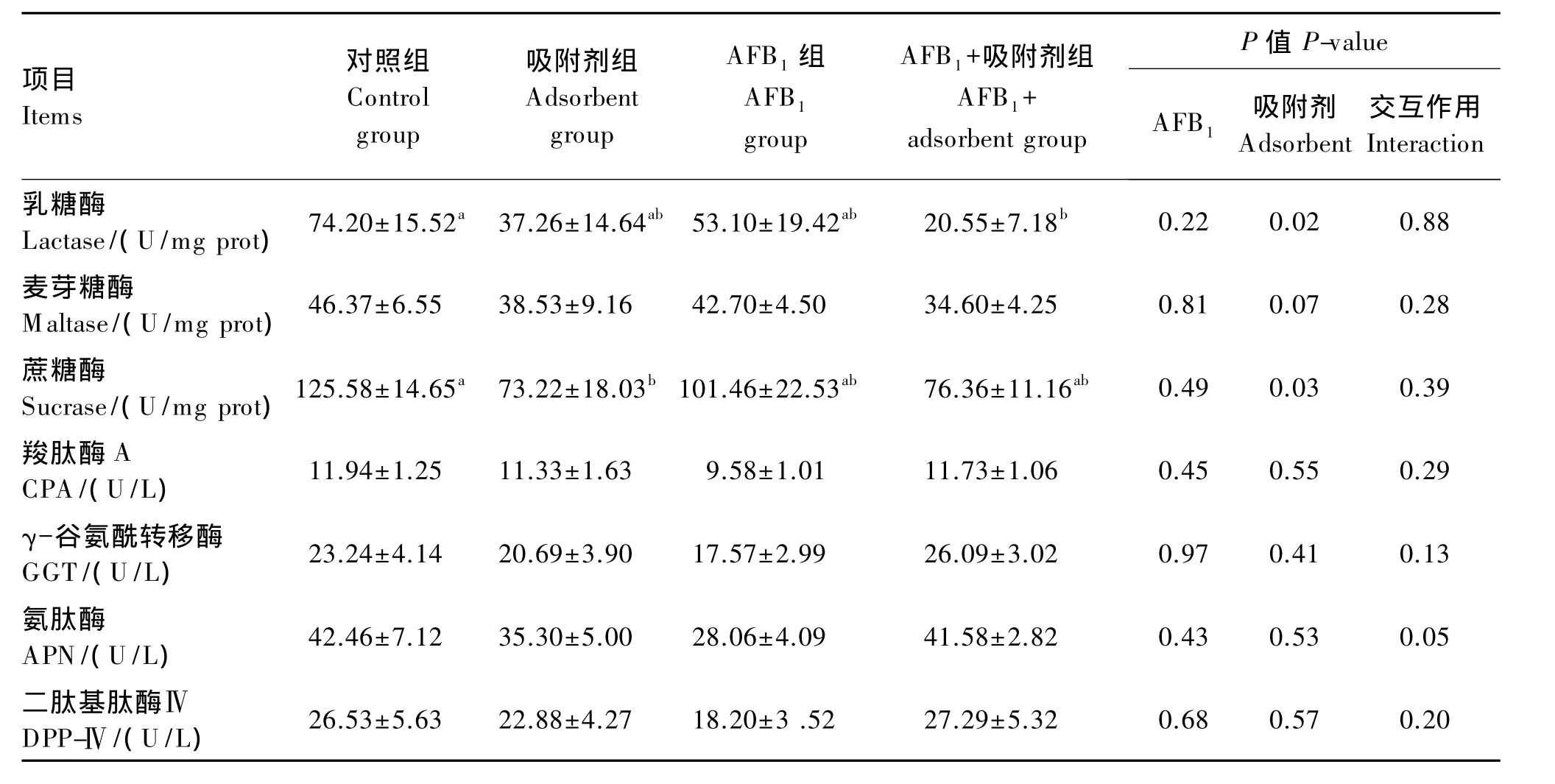
表5 AFB1及其吸附剂对断奶仔猪空肠消化酶活性的影响Table 5 Effects of AFB1 and adsorbent on the jejunum activities of digestive enzymes of weaned piglets
3.3 AFB1及其吸附剂对断奶仔猪肝脏组织结构的影响
肝脏作为动物机体主要的代谢器官,具有很强的生物转化功能和解毒功能,也是AFB1进入机体后攻击的主要器官。AFB1进入机体后形成的高活性分子形式AFB1-exo-8,9-环氧化合物,极易以共价键与酶蛋白分子结合,使酶蛋白失活,降低肝脏抗氧化酶活性,导致体内产生的过量的自由基和活性氧,破坏氧化-应激系统,引发氧化应激,进而造成肝脏损伤,严重的会引发原发性肝癌。有研究表明,AFB1高污染地区肝癌的发生过程中,发现凋亡蛋白抑制因子(inhibitor of apoptosis proteins,IAP)家族的Survivin mRNA表达显著上调,而Survivin可能通过促进细胞增殖、抑制细胞凋亡等途径引发肝癌[15]。史莹华等[7]等在生长肥育猪饲粮中添加100μg/kg的AFB1后,过氧化氢酶和谷胱甘肽过氧化物酶活性显著降低。吕武兴等[16]在饲粮中添加AFB1纯品饲喂肉鸭后发现,低剂量AFB1导致肝小叶形态模糊,少量肝细胞坏死;高剂量AFB1导致肝组织出现大量的颗粒变性和水泡变性,同时伴有纤维结蹄组织增生和胆管增生。本研究室张玲等[8]研究也表明,AFB1组仔猪肝脏总抗氧化能力降低15%,丙二醛含量增加7.4%,同时肝脏病理切片显示肝索排列紊乱,肝细胞质溶解、消失,细胞核固缩或消失,肝细胞发生严重的颗粒变性和空泡变性,这与本试验的结果一致,说明AFB1造成了断奶仔猪肝细胞正常结构的损伤。
3.4 AFB1及其吸附剂对断奶仔猪饲粮养分表观消化率和空肠消化酶活性的影响
小肠黏膜不仅是机体消化吸收养分的场所,也是抵御外界致病微生物和毒素入侵的最后一道防线,其健康状态与养分消化吸收紧密相关。研究表明饲粮中的霉菌毒素能破坏猪小肠黏膜形态结构,如肠绒毛变短、隐窝变深、黏膜厚度减少,此种损伤可能导致养分吸收不良。目前在仔猪上关于AFB1影响表观消化率和消化吸收方面的报道很少,但从家禽的研究报道来看,摄食AFB1后,在一定程度上会降低动物的消化吸收功能。Verma等[17]研究发现肉鸭饲喂含AF 2 mg/kg的饲粮代谢能显著下降,TP的利用率降低了50.97%,同时对CP净利用率随AF添加量的增多而下降。Ostrowski-Meissner等[18]研究发现污染了AF的饲粮会造成肉鸭氮沉积和血浆总氨基酸含量降低,回肠消化率降低。当饲粮AF达到210μg/kg时,会降低CP利用率。上述研究表明,动物摄入AFB1后,能影响饲料的利用率,降低养分尤其是CP利用率。冯光德等[19]在肉鸭饲粮中添加AFB1后发现,霉变组的空肠黏膜碱性磷酸酶、麦芽糖酶、蔗糖酶活性与对照组相比都有所升高。本试验发现AFB1组与对照组相比,养分表观消化率变化不显著,二糖酶活性均有所降低,这与以上结果不一致。这可能是由于AFB1的添加剂量、物种耐受程度和作用时间的差异,也有可能是全身代谢和激素分泌异常引起的[20-21]。Applegate 等[22]等在肉鸡饲粮中添加 0.6、1.2 和 2.5 mg/kg AFB1时,中等剂量组麦芽糖酶的活性增加,最高剂量组麦芽糖酶的活性降低,3个组对干物质和氮的利用率无显著影响。添加吸附剂后,二糖酶活性没有显著地改善,原因可能是吸附剂除了能够吸附毒素外,还会吸附相应的养分,尤其是水分和纤维,这二者是维持胃肠排空关键的养分。同时吸附剂的吸附效应是一个吸附—解析的动态过程,当胃肠排空速度减慢,意味毒素与肠道黏膜的接触时间相对增加。
4 结论
饲粮中AFB1超标(AFB1含量290μg/kg)可显著降低断奶仔猪仔猪空肠消化酶活性,导致肝脏出现组织病变,一定程度的降低断奶仔猪生长性能;添加吸附剂后可在一定程度上缓解AFB1造成的肝脏毒性和对生长性能的负面影响。
[1] BLOUNT W P.Turkey‘X’disease[J].Turkeys,1961,9:52-54.
[2] YUNUS A W,RAZZAZI-FAZELIE,BOHM J.A flatoxin B1in affecting broiler’s performance,immunity,and gastrointestinal tract:a review of history and contemporary issues[J].Toxins,2011,3(6):566 -590.
[3] 国家技术监督局.GB/T 17480—2008饲料中黄曲霉毒素B1的测定酶联免疫吸附法[S].北京:中国标准出版社,2009.
[4] 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007:25-135.
[5] 国家技术监督局.GB/T 23742—2009饲料中盐酸不溶灰分的测定[S].北京:中国标准出版社,2010.
[6] 于会民,梁陈冲,陈宝江,等.黄曲霉毒素解毒酶制剂对饲喂黄曲霉毒素B1饲粮的断奶仔猪生长性能及肝脏生化指标的影响[J].动物营养学报,2013,25(4):805-811.
[7] 史莹华,方丽云,孙宇,等.黄曲霉毒素对猪生长性能及肝脏功能的影响[J].西北农林科技大学学报:自然科学版,2007,35(6):55-59.
[8] 张玲,陈代文,雷晓娅,等.自然霉变玉米及添加甘露寡糖对断奶仔猪肝脏结构与功能的影响[J].中国畜牧杂志,2012,48(11):36-41.
[9] 雷晓娅.自然霉变玉米及甘露寡糖对仔猪生长性能和肠道健康的影响[D].硕士学位论文.雅安:四川农业大学,2011.
[10] DENLIM,BLANDON J C,GUYNOT M E,et al.Effects of dietary A flaDetox on performance,serum biochem istry,histopathological changes,and aflatoxin residues in broilers exposed to aflatoxin B1[J].Poultry Science,2009,88(7):1444-1451.
[11] MARIN D E,TARANU I,BUNACIU R P,et al.Changes in performance,blood parameters,humoral and cellular immune responses in weanling piglets exposed to low doses of aflatoxin[J].Journal of Animal Science,2002,80(5):1250-1257.
[12] 姚丽欣.黄曲霉毒素对生长育肥猪的生产性能和健康状况的影响研究[J].饲料广角,2011(24):33-35.
[13] LINDEMANN M D,BLODGETT D J,KORNEGAY E T,et al.Potential ameliorators of aflatoxicosis in weanling/grow ing sw ine[J].Journal of Animal Science,1993,71(1):171-178.
[14] HARVEY R B,KUBENA L F,ELISSALDE M H,et al.Cocontam ination of sw ine diets by aflatoxin and diacetoxyscirpenol[J].Journal of Veterinary Diagnostic Investigation,1991,3(2):155-160.
[15] 班克臣,曹骥,杨春,等.Survivin在 AFB1高暴露地区肝细胞癌中的表达及其临床意义[J].中国肿瘤临床,2005,32(11):614-617.
[16] 吕武兴,贺建华,宋洪国,等.黄曲霉毒素B1对肉鸭生长、肝组织结构及免疫相关基因表达的影响[J].动物营养学报,2013,25(4):812-818.
[17] VERMA J,JOHRI T S,SWAIN B K,et al.Effect of graded levels of aflatoxin,ochratoxin and their combinations on the performance and immune response of broilers[J].British Poultry Science,2004,45(4):512-518.
[18] OSTROWSKI-MEISSNER H T.Effect of dietary aflatoxins on protein and energy utilization by two Indonesian breeds of ducklings(A labio and Tegal)[J].Poultry Science,1983,62(4):599-607.
[19] 冯光德,陈代文,何健,等.自然霉变玉米对肉鸭生产性能和养分消化率的影响[J].中国畜牧杂志,2011,47(17):17-21.
[20] VERMA J,SWAIN B K,JOHRIT S.Effectof various levels of aflatoxin and ochratoxin A and combinations there of on protein and energy utilisation in broilers[J].Journal of the Science of Food and Agriculture,2002,82(12):1412-1417.
[21] VERMA J,JOHRI T S,SWAIN B K.Effect of aflatoxin,ochratoxin and their combination on protein and energy utilisation in white leghorn laying hens[J].Journal of the Science of Food and Agriculture,2007,87(5):760-764.
[22] APPLEGATE T J,SCHATZMAYR G,PRICKET K,et al.Effect of aflatoxin culture on intestinal function and nutrient loss in laying hens[J].Poultry Science,2009,88(6):1235-1241.
