FDA cGMP 483解析
2015-03-14苏丽花上海东富龙科技股份有限公司上海201108
苏丽花(上海东富龙科技股份有限公司,上海 201108)
FDA cGMP 483解析
苏丽花
(上海东富龙科技股份有限公司,上海201108)
摘 要FDA 483报告,也称现场检查报告,是美国FDA检查人员根据美国现行法律法规,对企业进行现场检查,对不符合cGMP的地方进行总结并发给企业。企业需立即针对不符合项进行整改,并在收到483报告后15个工作日内向FDA相关部门回复483中不符合项的整改情况。若FDA认定企业的答复妥当,并符合现行法律法规的要求,那么企业就避免收到FDA警告信。FDA每个财政年都会统计、总结并发布483表格,其在官网上公布。通过对2010年~2014年FDA官网发布的483数据进行简要分析,并着重对FDA cGMP 483进行说明和简要分析,旨在为制药企业完善内部管理体系提供一定的借鉴作用。
关键词FDA;483;cGMP
1 数据概览
1.1483数据概况
FDA(食品药品监督管理局)监管的范围覆盖了食品、各种类型的药品、医疗器械等行业,表1列出了2010~2014财政年各个领域的检查总结情况[1-5]。
纵观各个领域的483数据,食品483比重最大,约占总数的一半。药品483比重从2010至2014财政年分别为11.9 %、10.5 %、12.3 %、13.2 %、12.7 %。本文主要对药品483进行分析。
1.2药品483概况
药品483涉及FDA颁发的联邦法规第21章药品相关法规和法律,包括成品药良好生产管理规范、PET药品良好生产管理规范、新药、联邦食品药品化妆品法律等。表2列出了2010~2014财政年各法规出现不符合项的频次[1-5]。
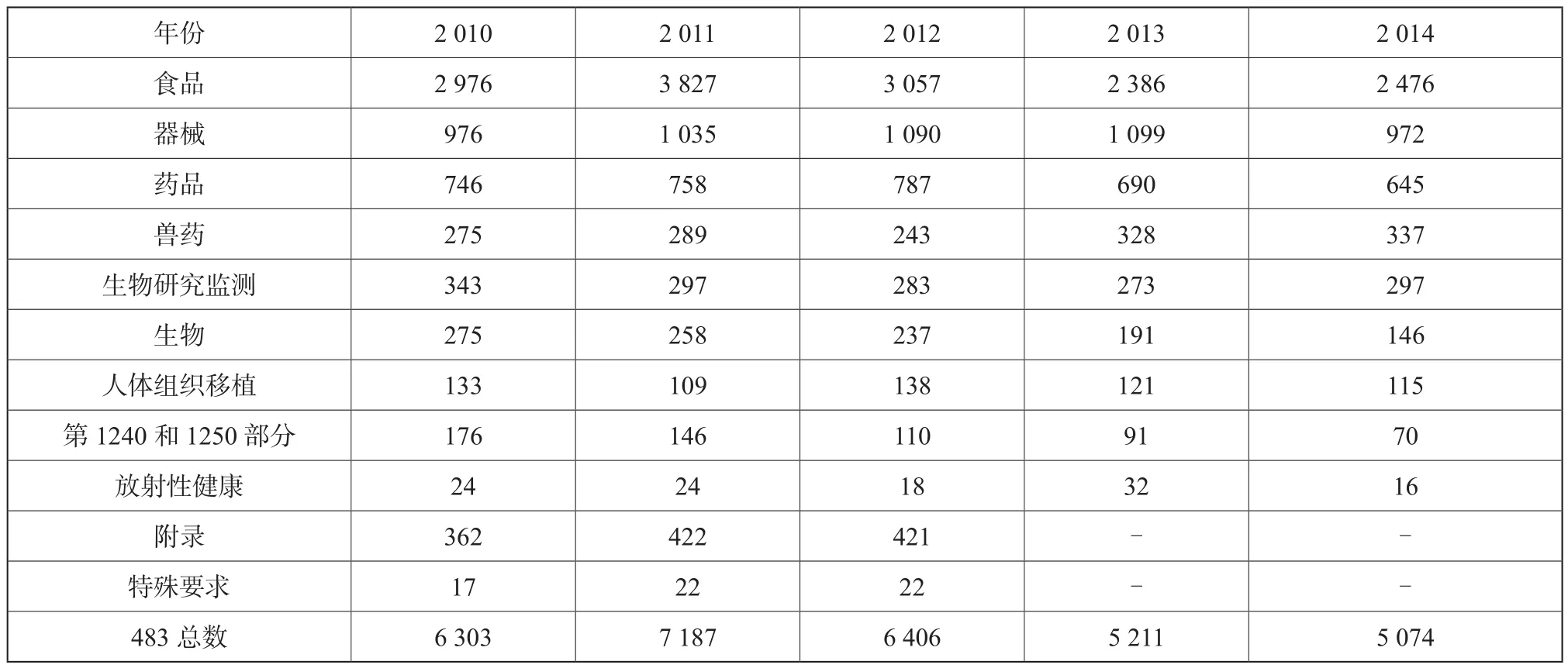
表1 2010~2014财政年发布的483份数Tab. 1 483s issued for fiscal year 2010~2014
其中,21 CFR第211部是成品药良好生产管理规范(现行版本生效日期为2014年4月1日),21 CFR第212部是PET药品良好生产管理规范(现行版本生效日期为2014年4月1日),21 CFR第310部是新药(现行版本生效日期为2014年4月1日),21CFR第314部是新药上市FDA批准申请(现行版本生效日期为2014年4月1日);21CFR 第316部为认为安全、有效、未贴假商标的处方药:调查用药(现行版本生效日期为2014年4月1日);FDCA501:联邦食品、药品和化妆品法501;FDCA760:联邦食品、药品和化妆品法760。
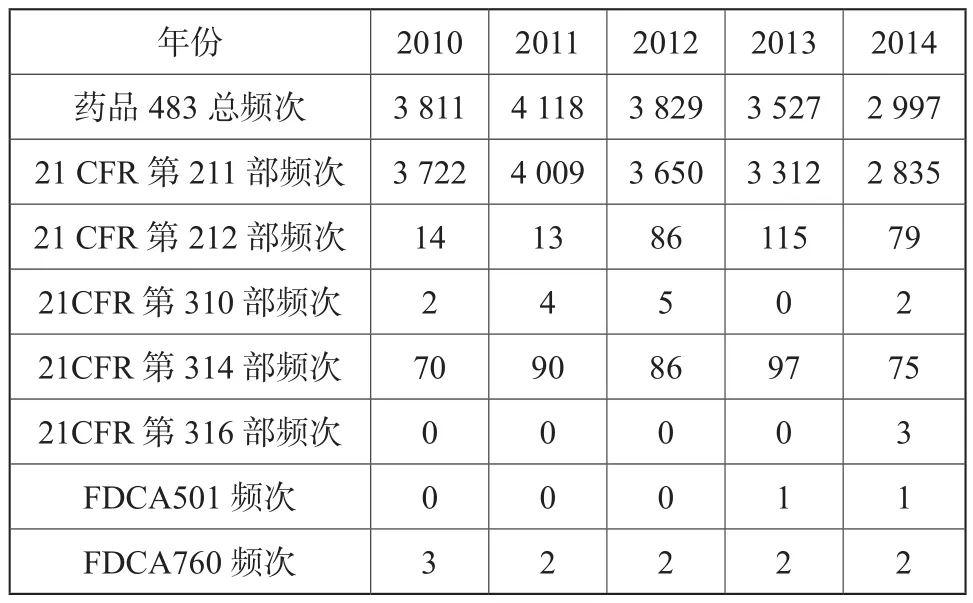
表2 2010~2014财政年各法规出现不符合项的频次Tab. 2 Regulation non-conformity frequency for fiscal year 2010~2014
从表2的数据可知,21CFR第211部收到483报告的频次最多,分别占药品483总频次97.7 %、97.4 %、95.3 %、93.9 %、94.6 %。而21CFR第211部是美国FDA对药品生产的基本要求,是FDA检查人员检查药企遵循的重要准则。
1.3FDA cGMP 483数据概况
FDA cGMP即21CFR第211部。表3按照六大体系展示不符合项的分布情况[1-5]。

表3 483分布(按照六大体系划分)Tab. 3 483s distribution (by six systems)
表3数据显示,在六大体系中,质量体系出现不符合项的次数最多,大约占cGMP不符合项总数2/5;实验室检验系统次之,比重大约为cGMP不符合项总数1/6;厂房设施与设备系统和生产系统基本并列第三,约占cGMP不符合项总数1/7。
2 六大体系483情况
2.1质量体系483情况
根据表3的数据计算,2010~2014财政年质量体系出现不符合项占cGMP不符合项总数分别为40.8%、40.6 %、40.4 %、37.2 %、37.2 %,逐年减少。表4汇总了质量体系出现缺陷的部分情况[1-6]。
质量管理体系出现很多不合规的现象,主要表现于质量体系不健全,缺乏书面的质量管理规程或没有充分遵守已经制订的规程,包括QC/QA管理规程、员工培训规程、入库规程、发运规程以及各种记录。另外,人员教育、培训及实际经验缺乏也是常见的缺陷项。
制药企业的质量体系水平在一定程度上体现了企业的质量文化水平,而实际上质量体系缺陷是一个国际性问题,其不仅出现在FDA 483中,也是EudraGMDP不符合项报告的常客。制药企业应该提高质量文化的建设,建立完善的质量体系,并定期评估质量体系运行的有效性。
2.2实验室检验系统483
2010~2014财政年实验室检验系统不符合项出现概率分别占16.6 %、17.3 %、18.1 %、19.6 %、19.6 %。以下就实验室检验系统不符合项进行部分汇总[1-6]。
实验室检验系统缺陷主要体现在质量标准、取样计划、检验规程、实验室控制机制相关规程未建立、未充分遵循以及未及时记录,特别是实验室控制规程,包括实验室数据完整性、真实性、准确性,是频发的不合规问题。当下制药行业再次热议数据完整性这一话题,不管是手工记录还是电子记录,均应以诚信为基石。制药企业可通过完善数据与记录管理的技术基础、完善记录管理程序、完善记录文件、建立计算机化系统管理系统或高素质的员工培训来确保数据的完整性。
2.3厂房设施与设备系统483情况
2010~2014财政年厂房设施与设备系统不符合项出现概率分别占15.8 %、15.3 %、15.0 %、16.9 %、19.3 %。表6就厂房设施与设备系统不符合项进行部分汇总[1-6]。
在厂房设施与设备系统中,预防交叉污染、混淆和差错不充分,设计、布局不合理,不利于操作、清洁和维护是主要的缺陷项目。自动化设备或仪器没有进行准确性确认、校准或控制,也时常被发现。
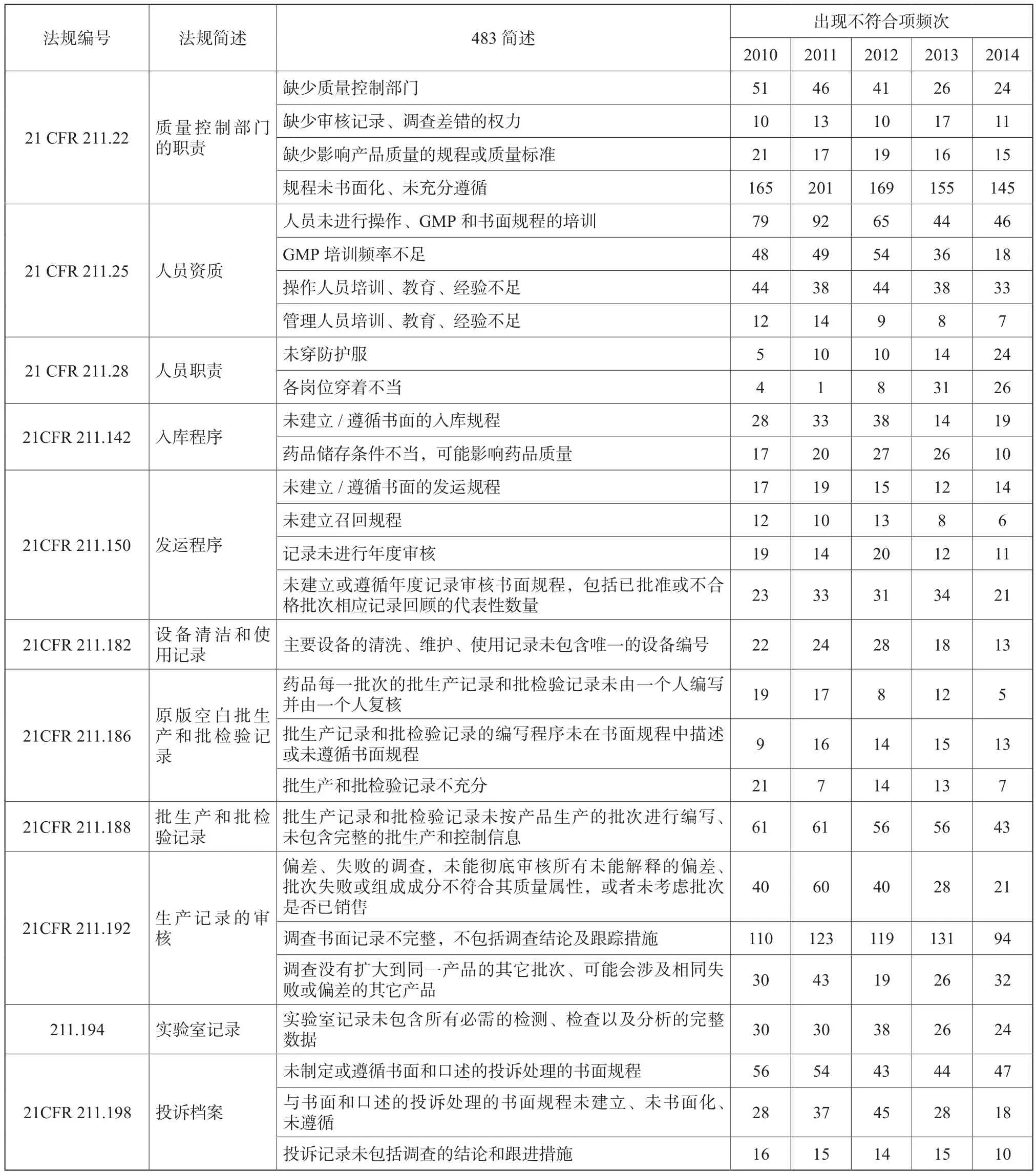
表4 质量体系不符合项部分汇总Tab. 4 Non-conformity for quality system part summary
交叉污染是GMP的三大核心之一,制药企业应详细评估车间布局的可行性,并进行严格的验证活动,避免挑战法规的要求。自动化设备则应按照相关法规进行验证,如CFDA最新颁布的GMP附录,计算机化系统[7]。
2.4生产系统483情况
2010~2014财政年生产系统不符合项出现概率分别占15.2 %、14.5 %、15.1 %、15.9 %、15.2 %。以下就生产系统不符合项进行部分列表[1-6]。
生产系统常见的不合规项主要是缺少生产和工
艺控制、微生物污染控制书面规程、未遵循书面规程、未及时记录,未对每一步骤进行产量计算以及未进行灭菌工艺验证。值得一提的是,国内制药企业通常会忽略除热原工艺验证,这在FDA认证中将成为严重缺陷。工艺验证按照2011版FDA行业指南——工艺验证的一般原则和规范[8]提供的方法进行。
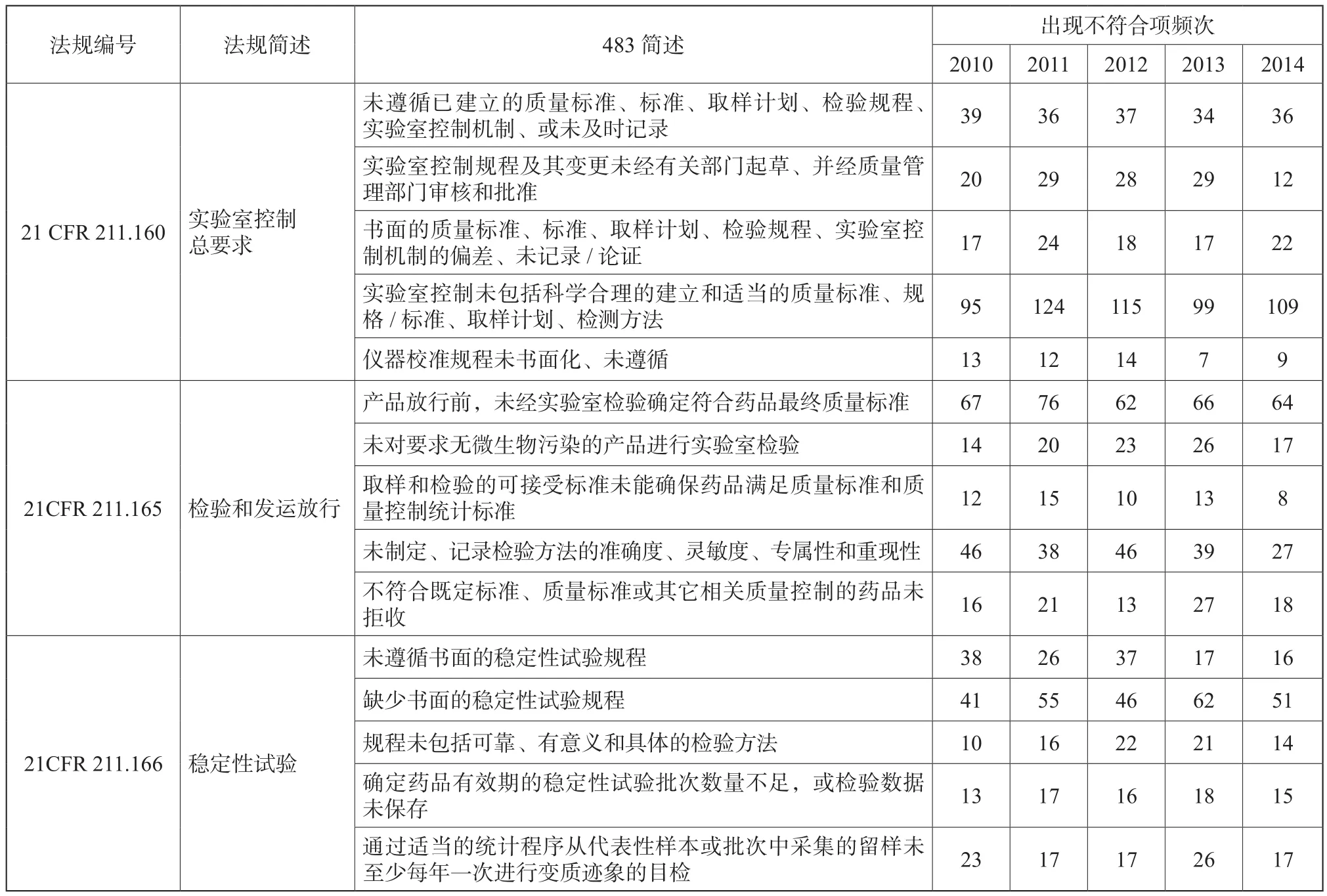
表5 实验室检验系统不符合项部分汇总Tab. 5 Non-conformity for laboratory test system part summary

表6 厂房设施与设备系统不符合项部分汇总Tab. 6 Non-conformity for facility and equipment system part summary
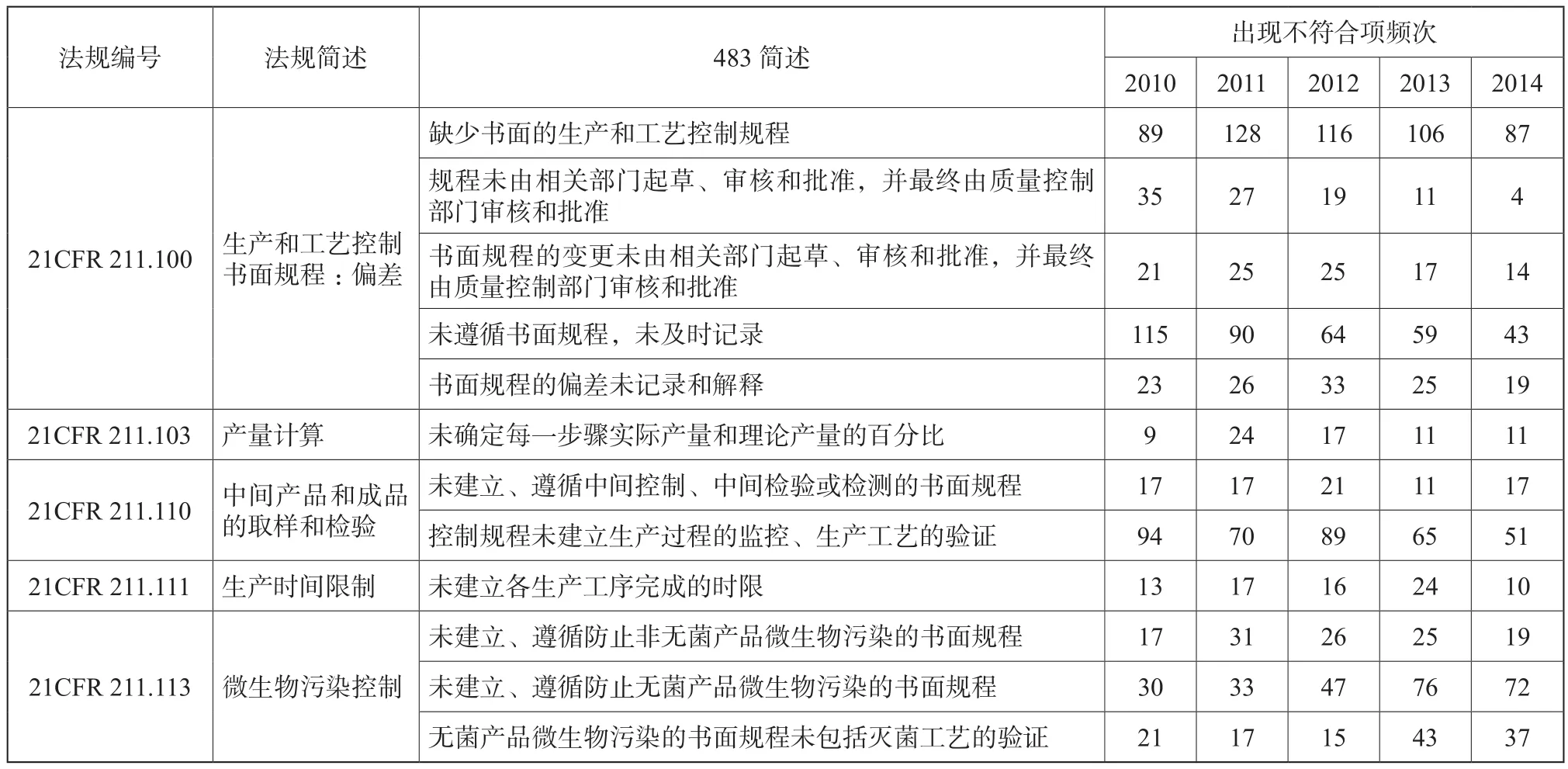
表7 生产系统不符合项部分汇总Tab. 7 Non-conformity for manufacture system part summary
2.5物料系统483情况
2010~2014财政年物料系统不符合项出现概率分别占7.0 %、7.1 %、7.2 %、6.7 %、5.5 %。以下就物料系统不符合项进行部分列表[1-6]。
物料系统出现违规项目主要是书面规程不足、物料检验过分依赖供应商检验报告而未进行检验。从严格意义上来说,表8列举的缺陷项属于质量体系的一部分,这就需要制药企业提高质量的意识,从各个环节严格把控药品生产的质量。

表8 物料系统不符合项部分汇总Tab. 8 Non-conformity for material system part summary
2.6包装和贴签系统483情况
2010~2014财政年包装和贴签系统不符合项出现概率分别占4.7 %、5.3 %、4.2 %、3.8 %、3.0 %。表9汇总了包装和贴签系统出现不符合项的部分情况[1-6]。
包装和贴签系统依旧存在规程未书面化或没有充分遵循的情况,此外有效期的确定不够科学。同样地,包装和贴签系统的缺陷项在一定程度上也体现为质量管理体系的不足。

表9 包装和贴签系统不符合项部分汇总Tab. 9 Non-conformity for packaging and labeling system part summary
3 结束语
随着国内制药企业水平的不断提高,不少企业欲向欧美市场进军,通过FDA cGMP是最低门槛,本文信息仅作为制药企业对照现有的质量保证体系是否存在违反FDA cGMP的参考。特别是在规程书面化、完整化以及充分遵循化方面,不管是在质量体系还是包装贴签体系,对出现的违规现象应该引起广大制药企业的深思和警醒。
参考文献
[1] FDA, Inspection Observations: FY 2010 Inspectional Observation Summaries. http:// www.fda.gov/ICECI/Inspections/ucm255532.htm
[2] FDA, Inspection Observations: FY 2011 Inspectional Observation Summaries. http:// www.fda.gov/ICECI/Inspections/ucm327135.htm.
[3] FDA, Inspection Observations: FY 2012 Inspectional Observation Summaries. http:// www.fda.gov/ICECI/Inspections/ucm326984.htm.
[4] FDA, Inspection Observations: FY 2012 Inspectional Observation Summaries. http:// www.fda.gov/ICECI/Inspections/ucm381526.htm.
[5] FDA, Inspection Observations: FY 2012 Inspectional Observation Summaries. http:// www.fda.gov/ICECI/Inspections/ucm424098.htm.
[6] FDA, 21 CFR Part211: CURRENT GOOD MANUFACTURING PRACTICE FOR FINISHED PHARMACEUTICAL[S], 2014.
[7] CFDA, 计算机化系统[S], 2015.
[8] FDA, Guidance for Industry, Process Validation: General Principles and Practices[S], 2011.
Analysis and Explanation of FDA cGMP 483
Su Lihua
(Shanghai Tofflon Science & Technology Co., Ltd, Shanghai 201108)
Abstract:FDA 483 report, which is known as site inspection report, is produced by U.S. FDA inspectors in site inspection according to U.S. current laws and regulations for summarizing the cGMP non-compliance and presenting to the relative enterprise. This enterprise must take corrective action for non-compliance immediately, and reply the 483 rectification to FDA regulatory department in 15 working days after receiving the 483 report. If FDA aware of the reply properly and meeting the requirements of current laws and regulations, the enterprise will avoid receiving FDA warning letter. FDA will summarize and publish 483 table every fiscal year, which is issued in the FDA official website. In this article, with the brief analysis of 483 data in 2010~2014 years issued in FDA official website, FDA cGMP 483 was emphatically explained. It was hoped to provide some references for the improvements of internal management system in pharmaceutical plants.
Keywords:FDA; 483; cGMP
作者简介:苏丽花(1990—),女,工程师,从事验证法规研究工作。
收稿日期:2015-04-25
中图分类号:R 951
文献标识码:A
文章编号:2095-817X(2015)06-0034-000
