多西环素对哮喘大鼠血管内皮生长因子、基质金属蛋白酶9的作用及血管重塑的影响
2015-03-14韩雪娇杨红申侯宏伟李亚妹李香兰
韩雪娇,王 亮,杨红申,侯宏伟,李亚妹,李香兰
(1.河北省邢台市第三医院呼吸科,河北 邢台054099;2.河北省胸科医院呼吸科,河北 石家庄050041;3.河北医科大学第二医院呼吸科,河北 石家庄050000;4.河北省胸科医院感染科,河北 石家庄050041;5.河北省胸科医院护理部,河北 石家庄050041;6.河北省胸科医院急诊科,河北 石家庄050041)
支气管哮喘是一种慢性呼吸道炎症性疾病,主要特征是气道炎症、气道高反应性和气道重塑。其中上皮细胞的脱落、基底膜的增厚、胶原的沉积、血管的扩张和增殖、气道平滑肌细胞的增殖、黏液腺和杯状细胞的增生等,称为气道重塑[1]。而气道重塑是难治性哮喘的主要原因。在哮喘的血管生成和重塑中,有多种细胞及细胞因子等参与这一过程,而血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶9(matrix metalloproteinases-9,MMP-9)是其中2个重要因子。近来研究表明,多西环素可抑制VEGF诱导人脐静脉内皮细胞的增殖,并可降低VEGF诱导的角膜新生血管形成的长度与面积;多西环素具有强大的抑制MMP-9作用。本研究在成功建立了大鼠哮喘模型的基础上,采用多西环素作为干预措施,通过检测VEGF、MMP-9的变化及肺组织内血管密度等的变化,探讨多西环素抑制气道重塑的可能机制,旨在为难治性哮喘提供新的治疗方法。
1 材料与方法
1.1 实验动物 清洁级SD大鼠33只(雄性,6周龄,体质量50~100g,购于河北省实验动物中心),
给予自由饮食(标准日粮和无菌饮用水,饲料购于河北省实验动物中心)清洁级饲养,3d后进行实验;实验场所在河北医科大学第二医院动物实验室和呼吸内科实验室。
1.2 仪器设备和试剂 高速冷冻离心机(1-15K,美国Sigma),酶联免疫检测仪(MK3,芬兰雷勃),石蜡切片机(LEICA RM2125,莱卡上海分公司),Motic 6.0数码医学图像分析系统(厦门麦克奥迪仪器仪表有限公司)。氢氧化铝(美国sigma),氢氧化铝(天津永大化学试剂开发中心),盐酸多西环素片(江苏瑞年前进制药有限公司),VEGF ELISA试剂盒(上海森熊科技实业有限公司),MMP-9兔抗IgG多克隆抗体(武汉博士德生物技术有限公司),DAB显色剂及SP9001试剂盒(北京中山生物技术有限公司)。
1.3 实验方法 将33只清洁级SD大鼠随机分成对照组、哮喘组和多西环素组各11只。其中哮喘组和多西环环素组分别于实验第1、8天向大鼠腹腔注射卵蛋白100mg和氢氧化铝100mg(混于生理盐水2mL中)进行致敏,第15天起将大鼠置于自制的非完全密闭雾化吸入箱内,给予卵蛋白溶液5mL雾化吸入,隔日1次,每次30min,共激发20次,根据激发效果调整给药浓度,1~4次为1%,5~8次为1.5%,9~12次为2%,13~16次为2.5%,17~20次为3%。当大鼠出现烦躁、呛咳、呼吸急促、活动量下降等典型的哮喘发作的表现时为激发成功。而多西环素组则在每次卵蛋白雾化吸入前30min按30mg/kg经口腔灌服方式给予多西环素[2],对照组以生理盐水代替卵蛋白;以上2组致敏和激发方法与哮喘组相同。在最后一次激发24h后,将大鼠以1%戊巴比妥钠麻醉,沿胸腔正中线打开胸腔,游离后暴露肺组织,结扎右主支气管后,取右肺下叶以4%甲醛溶液浸泡固定,待行病理及免疫组织化学;左肺行肺泡灌洗,回收肺泡灌洗液(bronchoalveolar lavage fluid,BLAF),以1 000r/min离心10min,取其沉淀进行细胞分类和计数。
1.4 BLAF细胞计数和分类 BLAF离心后,在其细胞沉渣中加入200μL 0.9%生理盐水,混匀后取20μL混悬液,在其中加入380μL冰醋酸;之后吸出20μL混悬液在显微镜下用血细胞计数板计数细胞总数。细胞沉淀甩片2张,染色(采用瑞氏-吉姆萨法染色)后行细胞分类计数,每个标本在高倍显微镜下计数至少400个有核细胞(除红细胞和上皮细胞外)总数,分别计数其中的中性粒细胞、淋巴细胞和嗜酸性粒细胞,从而获得各类细胞的百分比,并由此计算出其绝对值。以上细胞计数均采用单盲法。
1.5 病理分析 ①HE染色:打开大鼠胸腔,取右肺下叶,并将所取右肺下叶浸泡于4%甲醛溶液中固定,石蜡包埋,切取5μm厚的截面标本,行常规HE染色,用中性树胶封片,在光镜下观察病理改变。②免疫组织化学法检测肺组织MMP-9及VEGF的表达:将石蜡切片脱蜡水化,反复以磷酸缓冲盐溶液清洗,以过氧化氢室温下孵育,再以山羊血清温箱湿盒内孵育,再次依次给予一抗、二抗后孵育,显色,经梯度酒精逐级脱水,最后以中性树胶封固。阴性对照以磷酸缓冲盐溶液替代一抗,余步骤同上。肺组织MMP-9及VEGF的表达以平均光密度值来表示。
1.6 图像分析 于光学显微镜下找到完整支气管,切片,在光学显微镜下(放大100倍)随机选取完整的支气管横切面(中气道,内周径1 500~2 000 μm),使用病理图像采集系统采集图片。然后采用真彩色医学图像分析软件进行测量分析,测量完整的无软骨支气管横断面的支气管壁内周长(perimeter bronchial basement membrane,Pbm)、管壁面积(airway wall area,WAt)及血管密度,并计算标化测量值(WAt/Pbm)表示气道壁厚度。
1.7 ELISA法测定血清中VEGF含量 建立标准曲线。待测品孔中每孔各加入待测样品100μL,将反应板置于37℃120min。用洗涤液将反应板充分洗涤4~6次,每孔中加入第一抗体工作液50μL,将反应板充分混匀后置于37℃60min。用洗涤液将反应板充分洗涤4~6次。每孔加酶标抗体工作液100μL,将反应板置于37℃60min。用洗涤液将反应板充分洗涤4~6次,向滤纸上印干每孔加入底物液100μL,置于37℃暗处反应5~10min。每孔加入50μL终止液混匀。在450nm处测吸光值。以标准品3 200、1 600、800、400、200、100、50、0ng/L之吸光值在半对数纸上作图,画出标准曲线,将浓度作为X轴(对数轴),吸光值作为Y轴(线性轴)。曲线应为一光滑曲线,根据样品吸光值OD值在该曲线图上查出相应大鼠VEGF含量。
1.8 统计学方法 应用SPSS13.0统计学软件进行数据分析。计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 动物行为 哮喘组与多西环素组大鼠在激发过程中均出现呼吸急促、口唇发绀、烦躁不安等表现,实验过程中出现毛色晦暗、反应迟钝、精神萎靡、体质量较正常组下降等情况。而对照组大鼠在实验过程中均未出现呼吸、精神、行为、饮食等方面的明显变化。
2.2 各组细胞数比较 哮喘组BALF中的细胞总数、中性粒细胞数、淋巴细胞数、嗜酸性细胞数明显高于对照组(P<0.01);多西环素组细胞总数、中性粒细胞数、淋巴细胞数、嗜酸性细胞数明显少于哮喘组(P<0.01),但仍多于对照组(P<0.01)。见表1。
表1 3组BALF中细胞总数、中性粒细胞数、淋巴细胞数及嗜酸性粒细胞比较Table 1 The numbers of total cells,neutrophils,lymphocytes and eosinophils in BALF among three groups(n=11,±s,×106/L)
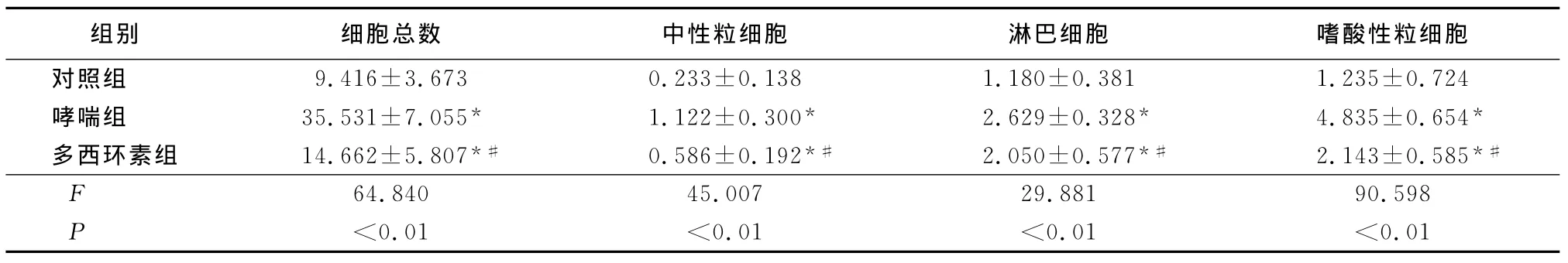
表1 3组BALF中细胞总数、中性粒细胞数、淋巴细胞数及嗜酸性粒细胞比较Table 1 The numbers of total cells,neutrophils,lymphocytes and eosinophils in BALF among three groups(n=11,±s,×106/L)
*P<0.01与对照组比较 #P<0.01与哮喘组比较(SNK-q检验)
?
2.3 肺组织切片HE染色 对照组大鼠肺组织病理切片可见支气管黏膜上皮、黏膜肌层、肺组织结构完整,支气管管腔规则,偶可见炎性细胞(图1A)。哮喘组大鼠肺组织病理切片可见支气管黏膜增厚,气道平滑肌明显增厚、血管增生、血管壁增厚,支气管黏膜下、肺泡间质可见大量炎性细胞浸润(图1B)。多西环素组支气管壁增厚程度、血管增生及炎性细胞浸润等均较哮喘组减轻(图1C)。
2.4 各组MMP-9、VEGF的表达 哮喘组肺组织中MMP-9的表达明显多于对照组(P<0.01);多西环素组较哮喘组有明显降低(P<0.01),但仍高于对照组(P<0.01)。哮喘组肺组织中和血清中的VEGF表达水平均明显高于对照组(P<0.01);而多西环素组则明显低于哮喘组(P<0.01),但仍高于对照组(P<0.01)。见表2,图2A~C。
2.5 各组 Wat/Pbm及血管密度比较 哮喘组WAt/Pbm和血管密度均高于对照组(P<0.01);多西环素组 WAt/Pbm和血管密度明显低于哮喘组(P<0.01),但仍高于对照组(P<0.01)。见表3,图3A~C。
表2 3组MMP-9、VEGF表达比较Table 2 MMP-9and VEGF expression in lung tissues among three groups(n=11,±s)

表2 3组MMP-9、VEGF表达比较Table 2 MMP-9and VEGF expression in lung tissues among three groups(n=11,±s)
*P<0.01与对照组比较 #P<0.01与哮喘组比较(SNK-q检验)
?
表3 3组WAt/Pbm及血管密度比较Table 3 The airway wall thickness and vasculardensity among three groups(n=11±s)
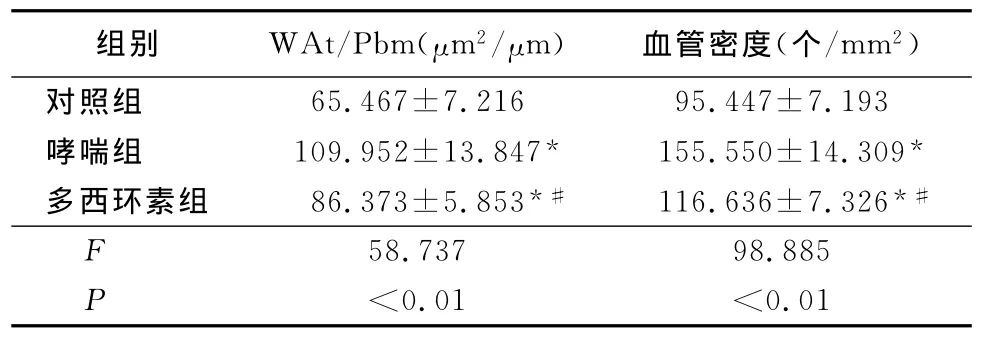
表3 3组WAt/Pbm及血管密度比较Table 3 The airway wall thickness and vasculardensity among three groups(n=11±s)
*P<0.01与对照组比较 #P<0.01与哮喘组比较(SNK-q检验)
?
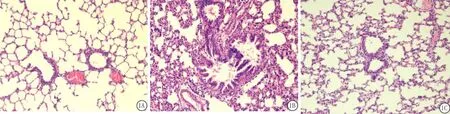
图1 3组肺组织的HE染色(HE×100)A.对照组;B.哮喘组;C.多西环素组Figure 1 HE staining of lung tissue among three groups(HE×100)

图2 3组肺组织中VEGF的表达(免疫组织化学 ×100)A.对照组;B.哮喘组;C.多西环素组Figure 2 The expression level of VEGF in lung tissue of three groups(SP×100)
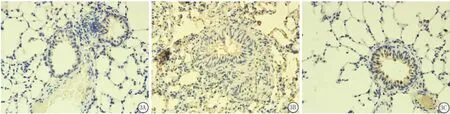
图3 3组肺组织中MMP-9的表达(免疫组织化学 ×100)A.对照组;B.哮喘组;C.多西环素组Figure 3 MMP-9expression in lung tissue of three groups(SP×100)
3 讨 论
3.1 哮喘患者VEGF、MMP-9表达水平的变化目前研究认为,气道炎症、气道高反应性和气道重塑是支气管哮喘的主要病理生理特征,其中气道重塑则是导致难治性哮喘的主要原因。而血管重塑是气道重塑的前提和重要组成部分。多种细胞因子、炎性介质等参与了哮喘气道重塑过程。而VEGF和MMP-9则是其中2种参与气道重塑、血管重塑的重要因子[3-5]。近年来世界范围内哮喘患病率明显升高,在不同国家或同一国家不同地区间存在差异。哮喘病呈愈来愈高发的趋势,但控制状况欠佳,在国内能够完善控制哮喘的患者不足3%。因此,对哮喘控制治疗药物的研制一直都是目前研究的重点。
本实验通过以卵蛋白致敏激发来制备大鼠哮喘模型,检测哮喘组大鼠BALF中细胞总数及中性粒细胞、淋巴细胞、嗜酸性粒细胞均明显高于对照组,说明哮喘大鼠存在气道高反应性及气道炎性细胞浸润;而在哮喘组大鼠肺组织病理中可见显著的支气管黏膜、气道平滑肌增厚、腺体增生、血管壁增厚和血管增生等,符合哮喘病理学特点的病理改变,说明哮喘大鼠模型建立成功。借助图像分析软件测量得出其WAt/Pbm及血管密度均高于对照组,结果显示哮喘大鼠存在气道重塑和血管重塑。同时,应用免疫组织化学及ELISA法检测大鼠肺组织和血清中的MMP-9和VEGF的表达水平,哮喘组大鼠肺组织中的MMP-9和VEGF的表达水平及血清中的VEGF含量较正常对照组均明显升高,且差异有统计学意义。表明哮喘大鼠MMP-9和VEGF的表达水平升高与其气道炎症、气道高反应性及血管重塑、气道重塑的发生有关。
3.2 多西环素对VEGF、MMP-9表达水平的调节
多西环素是一种用途广泛的抗生素[6],是四环素的衍生物。最近研究发现,四环素可以抑制基质金属蛋白酶的合成并广谱抑制基质金属蛋白酶的活性,尤其是对MMP-2和MMP-9抑制作用更为显著[7-8]。
Lee等[2]研究了多西环素对哮喘小鼠气道炎症和气道高反应性的作用,选择以多西环素对进行干预,发现多西环素可以减少气道内中性粒细胞、淋巴细胞和嗜酸性粒细胞的数量,并降低气道高反应性,同时降低MMP-9mRNA和蛋白的水平。
而在新生血管形成的各种因子中VEGF起着核心作用。VEGF通过与内皮细胞表面的特异性受体相结合,不仅可以促进内皮细胞增殖、增加血管通透性、促进新生血管生成,还能促进MMP的分泌。同时从哮喘的发病机制上分析,VEGF与 MMP-9尚存在潜在的关联性。目前有研究证实,哮喘患者痰液中的VEGF和MMP-9水平明显高于正常人,且二者存在相关性。在本实验中通过免疫组织化学测定肺组织中MMP-9、VEGF的表达水平,同样发现哮喘组大鼠MMP-9、VEGF的表达水平均明显高于对照组。有学者研究发现在特发性肺间质纤维化患者BALF中MMP-9、VEGF的水平较正常人显著升高,而经多西环素干预后以上指标的水平则可接近正常[9]。本实验也证实经多西环素干预后,MMP-9和VEGF水平较哮喘组均明显下降。
本实验模型建立成功后,通过免疫组织化学及ELISA法测定MMP-9和VEGF表达水平,结果显示哮喘组MMP-9和VEGF表达水平明显升高,应用多西环素干预后MMP-9和VEGF表达水平较对照组稍高,但较哮喘组明显降低,且差异有统计学意义。说明多西环素对降低MMP-9和VEGF的表达水平具有显著作用,并由此减轻哮喘气道重塑及血管重塑程度。这也为哮喘治疗提供了新的思路。
综上所述,气道炎症是哮喘的特征之一,血管重塑是气道重塑的重要部分。MMP-9、VEGF与哮喘炎症、气道重塑、血管重塑密切相关[10],二者又可相互调节。多西环素可降低MMP-9、VEGF的表达水平,具有减轻气道炎症气道重塑、血管重塑的作用。关于MMP-9、VEGF对哮喘血管重塑作用机制及多西环素对其作用的深入研究也为治疗哮喘开辟了新的途径。
[1] Warner SM,Knight DA.Airway modeling and remodeling in the pathogenesis of asthma[J].Curr Opin Allergy Clin Immunol,2008,8(1):44-48.
[2] Lee KS,Jin SM,Kim SS,et al.Doxycycline reduces airway inflammation and hyperresponsiveness in a murine model of toluene diisocyanate-induced asthma[J].J Allergy Clin Immuol,2004,113(5):902-909.
[3] Lee YC,Kwak YJ,Song CH.Contribution of vascular endothelial growth factor to airway hyperresponsiveness and inflammation in a marine model of toluene diisocyanateinduced asthma[J].J Immunol,2002,168(7):3595-3600.
[4] Cucina A,Borrelli V,Randone B,et al.Vascular endothelial growth factor increases the migration and proliferation of smooth muscle cells through the mediation of growth factors released by endothelial cells[J].J Surg Res,2003,109(1):16-23.
[5] Brown KR,England KM,Goss KL,et al.VEGF induces airway epithelial cell proliferation in human fetal lung in vitro[J].Am J Physiol Lung Cell Mol Physiol,2001,281(4):L1001-1010.
[6] Rempe S,Hayden JM,Robbins RA,et al.Tetracyclines and pulmonary inflammation[J].Endocr Metab Immune Disord Drug Targets,2007,7(4):232-236.
[7] Lalu MM,Gao CQ,Schulz R,et al.Matrix metalloproteinase inhibitors attenuate endotoxemia induced cardiac dysfunction:apotential role for MMP-9[J].Mol Cell Biochem,2003,25l(1/2):61-66.
[8] Benjamin MM,Khalil RA.Matrix metalloproteinase inhibitors as investigative tools in the pathogenesis and management of vascular disease[J].EXS,2012,103:209-279.
[9] Mishra A,Bhattacharya P,Paul R,et al.An alternative therapy for idiopathic pulmonary fibrosis by doxycycline through matrix metalloproteinase inhibition[J].Lung India,2011,28(3):174-179.
[10] Nör JE,Christensen J,Mooney DJ,et al.Vascular endothelial growth factor(VEGF)-mediated angiogenesis is associated with enhanced endothelial cell survival and induction of Bcl-2 expression[J].Am J Pathol,1999,154(2):375-384.
