基于QbD理念的口服固体制剂仿制药的研发思路探析
2015-03-13王旭明林淘曦苏娜谭国英
王旭明 林淘曦 苏娜 谭国英
(广东东阳光药业有限公司,广东东莞523871)
基于QbD理念的口服固体制剂仿制药的研发思路探析
王旭明 林淘曦 苏娜 谭国英
(广东东阳光药业有限公司,广东东莞523871)
重点解读了ICH Q8(药物研发)、Q9(质量风险管理)和Q10(药品质量系统)指南的核心内容,结合国内外QbD应用实例,阐述了如何运用QbD理念进行口服固体制剂仿制药的研发,以期为国内的仿制药研发工作提供借鉴。
质量源于设计;质量风险管理;药品质量系统;仿制药研发
0 引言
近年来,随着药品生产企业的不断发展,人们对药品质量进行科学监管的呼声不断高涨,在美国食品药品监督管理局(FDA)和人用药品注册技术要求国际协调会(ICH)的相关质量指南不断出台的推动下,“质量源于设计”(QbD)的理念已逐渐成为制药界的共识。
本文将重点解读ICH Q8(药物研发)、Q9(质量风险管理)和Q10(药品质量系统)指南的核心内容,并结合国内外QbD的应用实例来阐述如何运用QbD理念进行口服固体制剂仿制药的研发,为国内的仿制药研发工作提供借鉴。
1 “质量源于设计”(QbD)理念简介
“质量源于设计”(Quality by design,QbD)是一种科学的、基于风险分析的药物研发方法,其是以预先设定的目标产品质量为研发起点,在了解关键物料属性的基础上,通过实验设计、数据分析,找出影响产品质量的关键因素,确定关键工艺参数,在物料特性、工艺环境等多个影响因素下,建立工艺稳定且能满足产品性能的设计空间,并根据设计空间,建立质量风险管理,确立药品质量控制策略和质量控制体系。
QbD理念是将药品质量控制的基础管理点更进一步前移至药品的设计与研发阶段,消除因药品及其生产工艺设计不合理而可能对产品带来的不利影响。根据这一模式,在药品的设计与研发阶段,首先要进行全面的考虑,综合确定目标药品,然后通过充分的优化、筛选、验证,确定合理可行的生产工艺,最终根据生产过程中的有效控制和质量保证进行生产与检验,从而比较全面地控制药品质量。其总体思路如图1所示。
2 QbD理念的运用思路
在口服固体制剂仿制药的研发过程中,运用QbD理念,可获得对产品和工艺的系统性的理解,从而更好地控制产品质量。
QbD理念运用于仿制药研发的总体思路如图2所示。
2.1 参比制剂的研究
仿制药研发必须参考原研参比制剂,且需保持与参比有相同的活性成分、剂型、规格、给药途径和适应症,最终证明与原研参比的药学等效。因此,研发前期需对官方指定的参比制剂有全面深入的了解,根据参比标签中的信息和对参比的考察,了解其临床、药代动力学、理化性质、组成成分等方面的信息,为后续开发仿制药并使其与参比制剂药学等效提供基础。

图1 “质量源于设计”(QbD)理念的总体思路
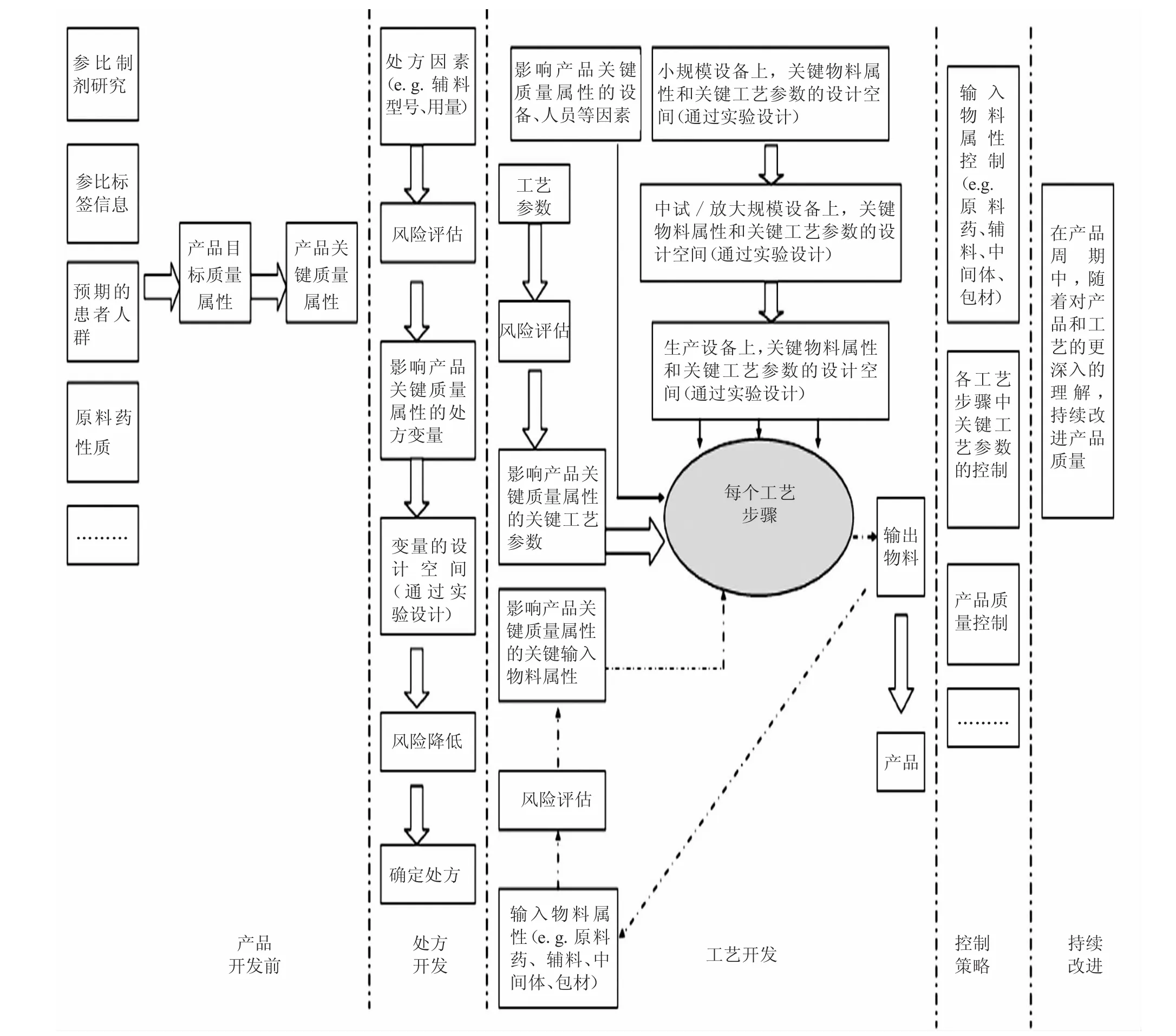
图2 QbD运用于仿制药研发的总体思路
2.2 产品目标质量属性的确定
基于前期对参比制剂和原料药性质等全面深入的了解,考虑到产品的安全性和有效性,从理论上对药品质量特性进行前瞻性总结,定义成品的目标质量属性(如剂型、作用机制、给药途径、规格、稳定性、含量、有关物质、溶出、溶残、微生物、包装系统等),以保证仿制药与参比制剂具有等效的安全性和有效性。
2.3 产品关键质量属性的确定
基于风险评估,考虑到可能会对患者造成的伤害程度(安全性和疗效),确定成品关键质量属性。对不受处方和工艺变量影响的关键工艺参数,在后续研发中可不予考虑。反之,则需考虑。
对于固体制剂来讲,一般是将影响成品纯度、疗效、药物释放和成品稳定性的属性定义为物料的关键质量属性。产品关键质量属性的确定思路如图3所示。
2.4 确定可能影响产品关键质量属性的处方和工艺因素
在质量风险管理过程中,使用正式的风险管理过程(认可的方法和/或内部程序,如标准操作程序)并非总是合适或必要的。使用非正式的风险管理过程(基于先前经验和/或内部程序)也可视为可接受的。
实施质量风险管理时应考虑两个主要原则:(1)质量风险的评估应基于科学知识,并最终与保护患者相联系;(2)质量风险管理过程投入的努力程度、管理的正式程度及文件管理水平应与风险水平相一致。
首先,运用风险评估工具(如故障模式影响分析、故障树形图分析、危害分析与关键控制点、危害性与可操作性研究、统计工具)或先前的经验,确定可能对产品关键质量属性有影响的处方因素(如原料药性质、辅料型号、性质、用量),并对其进行风险排序(低、中、高)。基于先前经验或通过后续实验设计,降低其中高风险的因素风险,从而得到最终处方。基于QbD的处方因素风险评估举例如图4所示。

图3 产品关键质量属性的确定思路
确定了产品的最终处方后,对整个药品生产工艺进行风险评估,确定可能影响最终产品关键质量属性的工艺步骤。随后,对每个有风险的工艺步骤进行详细评估,确定每个工艺步骤中可能会影响输出物料属性的关键性因素(如输入物料关键质量属性、关键工艺参数、人员和设备等),并对这些高风险的关键性因素通过实验设计考察降低其风险,得到最终的产品工艺。
图5为基于QbD理念的湿法制粒工艺风险评估举例,以上处方和工艺因素的风险评估总体思路如图6(鱼骨图)所示。
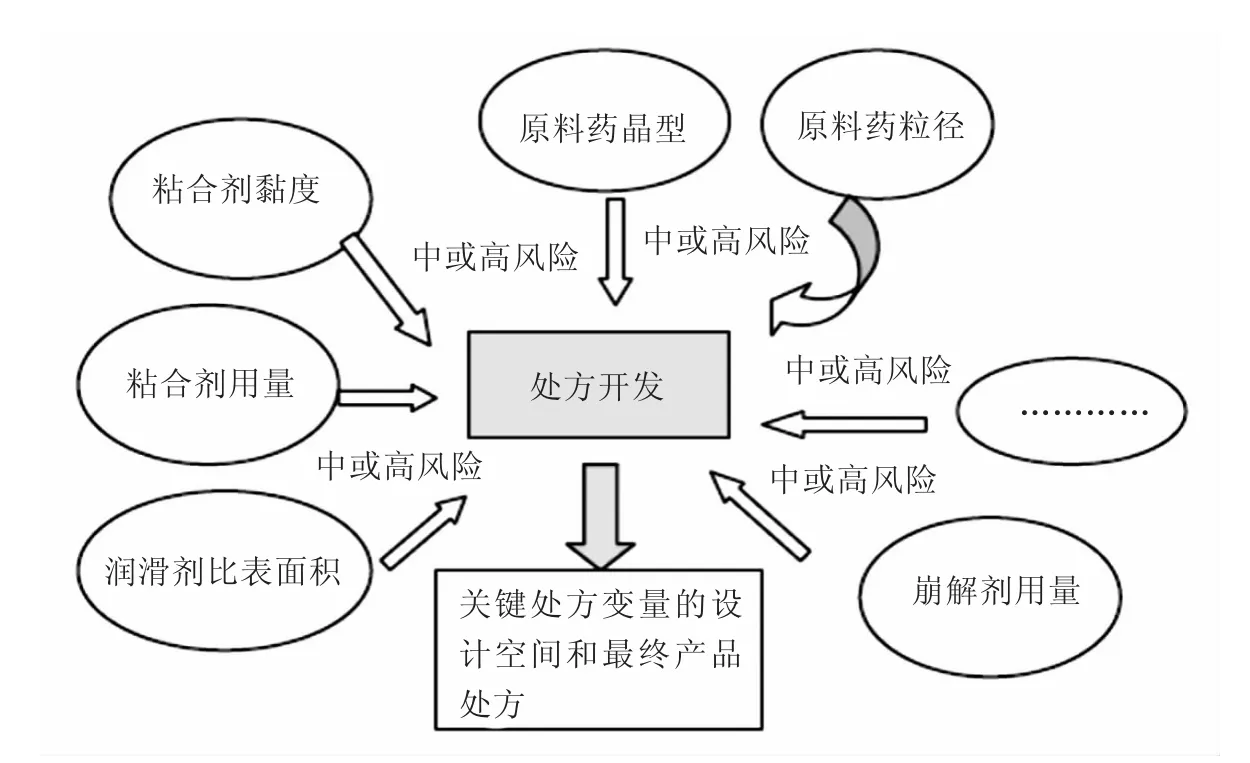
图4 基于QbD的处方因素风险评估举例
2.5 实验设计,建立高风险因素的设计空间
在处方和工艺开发中,通过实验设计,建立高风险因素的设计空间。在设计空间内,变量或属性参数的变化将不会对产品质量产生影响,通过对产品和工艺的进一步理解,可基于设计空间将其控制在更窄范围内,更好地保证最终产品的质量。对设计空间的理解如图7所示。
另外,工艺参数的设计空间可能会受规模设备的影响,还需考虑在不同规模设备下(小试、中试、放大、生产规模等)工艺参数设计空间之间的联系,确定产品最终生产规模下的工艺参数。
2.6 控制策略

图5 基于QbD理念的湿法制粒工艺风险评估举例
基于以上对产品和工艺的理解(从小试到放大到生产规模),获得产品质量的控制策略。控制策略包括:物料(如原料药、辅料、包材)质量属性的控制、各关键工艺参数的控制、各工艺步骤的中控措施等。
通过控制策略,对产品生产过程进行有效控制,从而比较全面地控制药品的质量。
2.7 产品生命周期的管理和持续改进
在产品生命周期内,随着对产品和工艺的深入理解,持续改进产品质量。

图6 风险评估思路示例(湿法制粒工艺)

图7 对设计空间的理解
3 结语
随着药品生产企业的生产经验日益丰富,将QbD运用于药物研发是一种必然趋势,也是更有效地保证最终产品质量和用药安全性的一种方法和手段。实施QbD理念,将对药品的控制系统地贯彻到药品的设计、生产和检验的全过程,有助于全面提高我国药品生产水平和质量,并利于企业获得国际商机。
2015-11-24
王旭明(1979—),男,甘肃天水人,工程师,研究方向:药物制剂学。
