关于“化学计量”的几点思考与建议
2015-03-13孙永辉刘江田
孙永辉 刘江田
(1 江苏省高淳高级中学 江苏 南京 211300;2 江苏省南京市教研室 江苏 南京 210001)
以物质的量为中心的化学计量是整个高中化学计算的核心 (如图1 所示)。学好各种化学计量的概念、熟练应用相关计算公式是学好高中化学计算的基础和关键。

笔者在多年的一线教学实践中发现,学生在“化学计量” 的学习中存在着诸多学习障碍点或难点。造成这些障碍点或难点的原因不完全是老师讲的不清楚、强调的不够,笔者认为可能还有学生的前概念造成误导、教材概念表述不清、公式表示不统一等原因。下面是笔者的一些思考与建议,希望能抛砖引玉,与化学界同仁进行一些交流与讨论。
一、阿伏加德罗常数
阿伏加德罗常数是将物质的量与微观粒子数联系起来的桥梁(n=N/NA)。三种不同版本教材对阿伏加德罗常数的相关描述如表1 所示。
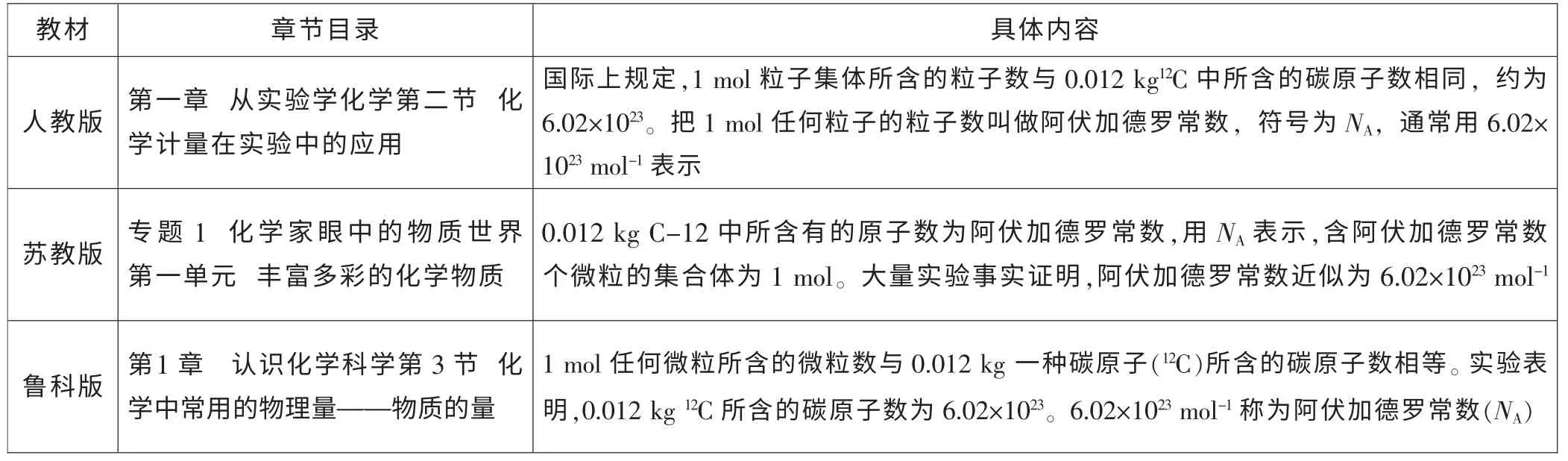
表1 三种教材“阿伏加德罗常数”内容的编写比较[1] [2] [3]
1.阿伏加德罗常数的单位
实际教学中, 阿伏加德罗常数的单位总是令很多学生难以理解。根据人教版“把1 mol 任何粒子的粒子数叫做阿伏加德罗常数”和苏教版“0.012 kg C-12 中所含有的原子数为阿伏加德罗常数”理解,阿伏加德罗常数应约为6.02×1023或6.02×1023个,三种教材最终又认为阿伏加德罗常数为(或近似为)6.02×1023mol-1。
笔者认为,“单位物质的量的任何粒子的粒子数叫做阿伏加德罗常数”[4], 阿伏加德罗常数约为6.02×1023个/摩尔,其中文单位为“个/摩尔”或“个/摩”。在英文中,“1 个原子”说成“an atom”,“2 个原子”说成“two atoms”;由于英文对个数的表示习惯,使得“个”在英文中无法体现,故阿伏加德罗常数用英文表示时,只能写成“6.02×1023mol-1”,单位只能是“mol-1”。
2.阿伏加德罗常数还是阿伏加德罗常量
根据三种教材知,阿伏加德罗常数NA≈6.02×1023mol-1。在近年高考试题或练习中,经常出现“阿伏加德罗常数”表述令学生难以理解的情况。以2014年各地高考试题为例,试题中关于“阿伏加德罗常数”的表述如表2 所示。

表2 2014年各地高考试题中关于“阿伏加德罗常数”表述比较
常数顾名思义, 即固定不变的数值, 如圆周率π≈3.14159……[5];中国科学院科技名词审定委员会建议,凡有单位的常数应改称“常量”[6]。故笔者认为,高中三种必修1 教材中所提到的 “阿伏加德罗常数”应改为“阿伏加德罗常量”[大学《无机化学》(上册)(三所师范大学编,第四版)中已表述为“阿伏加德罗常量”], 即阿伏加德罗常量NA≈6.02×1023mol-1;0.012 kg12C 所含碳原子数只能叫做 “阿伏加德罗数”[6],其值约为6.02×1023,量纲为1[6]。
表2 中“全国大纲卷”、“四川卷”、“江苏卷”想表达的是“用NA表示阿伏加德罗数”。笔者认为,NA就是阿伏加德罗常量,当然也不能“设NA为阿伏加德罗常数的值”;如用0.2NA来表示微粒个数,学生可能理解微粒个数为0.2×6.02×1023mol-1或0.2×6.02×1023个/摩,显然会给学生带来很大困惑和不解。值得借鉴的是,2011~2014年广东省高考化学试题一直用 “设nA为阿伏加德罗常数的数值。下列说法正确的是”表述,这种表述比较科学,不会引起歧义。
综上所述,笔者建议:“阿伏加德罗常数”改为“阿伏加德罗常量”,符号仍为NA,阿伏加德罗数可用nA表示,则有NA=nAmol-1≈6.02×1023mol-1。
二、化学计量公式
以物质的量为中心的计算是整个高中化学计算的基础。正确理解公式中各物理量及其符号的含义、规范灵活地用好公式,是学好化学计算的基本功。
1.物质的量浓度公式中的符号
以物质的量为中心的计算公式中,每个物理量的符号都应有一定的出处, 如N 是数目的英文number的首字母,m 是质量的英文mass 的首字母等。三种教材中,物质的量浓度的公式均可表示为(其中cB表示溶质B 的物质的量浓度,nB表示溶质B 的物质的量,V 表示溶液的体积)。浓度的英文单词为concentration,体积的英文单词为volume,故分别用英文单词的首字母c 表示浓度、V 表示溶液体积无可厚非; 而溶质的英文单词为solute[7],用B 表示溶质就不好理解了,所以笔者建议用S 表示溶质。
2.化学计量公式的表示
三种教材在公式的应用方面,都通过例题进行了很好的示范。笔者将实际教学中学生不规范问题与教材解题示范对比如表3 所示。

表3 三种教材“解题示范”与学生常见问题对比[1] [2] [3]
可见,学生的不规范问题主要表现为,公式中不注明具体的物质或注明的方式不规范。究其形成原因,除学生本身习惯、教师讲解等因素外,笔者认为还有两个重要原因。
为解决学生的这些不规范问题,笔者在教学中除做好示范、强调规范外,还对公式进行了改进(以人教版公式为例改进),如表4 所示。

表4 “化学计量”公式改进前后对比
笔者用改进后的公式进行了实际教学测试, 发现绝大多数学生都能够在公式中注明指定化学物质,规范意识大为提升。这是一次颇为有意义的尝试。
希望有关专家或部门在修订教材或重新编写教材时,能够兼顾学生学习的实际,做出一些合理的改变或优化,以期达到方便学生学习、帮助学生养成书写规范的目的。
[1]宋心琦主编.普通高中课程标准实验教科书:化学1(必修)[M].北京:人民教育出版社,2014
[2]王祖浩主编.普通高中课程标准实验教科书:化学1(必修[M]).南京:江苏教育出版社,2005
[3]王磊主编.普通高中课程标准实验教科书:化学1(必修)[M].济南:山东科学技术出版社,2011
[4]陈廷俊.关于规范使用“阿伏加德罗常数”的思考[J].中学化学教学参考,2012,(4):43~44
[5]常量与常数的区别[J].青海大学学报:自然科学版,2008,(6):43
[6]北京师范大学,华中师范大学,南京师范大学无机化学教研室.无机化学(上册)[M].北京:高等教育出版社,2006
[7]南京大学化学系.物理化学词典[M].北京:科学出版社,1988:80
