TS蛋白表达在培美曲塞治疗晚期肺腺癌患者疗效的意义
2015-03-13杨海劲黄国庆
田 丹 王 军 程 越 杨海劲 吴 剑 黄国庆
(1河源市人民医院肿瘤科,2河源市人民医院病理科,广东 河源 517000)
·临床实践·
TS蛋白表达在培美曲塞治疗晚期肺腺癌患者疗效的意义
田 丹1王 军2程 越1杨海劲1吴 剑1黄国庆1
(1河源市人民医院肿瘤科,2河源市人民医院病理科,广东 河源 517000)
目的:探讨胸苷酸合成酶(TS)表达水平在培美曲塞治疗晚期肺腺癌患者疗效的意义。方法:回顾性分析30例接受培美曲塞联合顺铂化疗的ⅢB/Ⅳ期肺腺癌患者,运用免疫组织化学方法检测患者癌组织中TS蛋白表达,并随访1年,对化疗疗效进行分析。结果:30例患者中,TS阳性表达率为23.33%,TS表达与患者的性别、年龄及临床分期无关(P>0.05)。TS表达阴性患者客观缓解率(RR)为43.48%,而TS表达阳性患者RR为14.29%,差异无统计学意义(P=0.215>0.05);TS蛋白表达阴性患者疾病控制率(DCR)为91.30%,TS蛋白表达阳性患者DCR为42.86%,差异有统计学意义(P=0.016<0.05)。Kaplan-Meier生存曲线显示:TS蛋白阴性表达者1年DFS高于阳性表达者,差异有统计学意义(P=0.047<0.05)。结论:TS可作为预测肺腺癌患者对培美曲塞的敏感性的指标,TS表达阴性肺腺癌患者可以从含培美曲塞的化疗方案中获益。
胸苷酸合成酶;培美曲塞;肺腺癌;疗效
肺癌是目前全球患病率及死亡率最高的恶性肿瘤,其中约80%的肺癌为非小细胞肺癌(NSCLC),由于缺乏早期特异性的临床表现及诊疗技术的局限性,大多数患者确诊时已属晚期,化疗是其主要治疗手段,以铂类为基础的两药联合方案是目前治疗NSCLC的标准化疗方案[1]。培美曲塞是一种多靶点抗叶酸制剂,其与顺铂联合化疗于2008年9月被美国食品药品管理局(FDA)批准用于晚期非鳞状NSCLC的一线治疗。胸苷酸合成酶(TS)是提供细胞内胸苷的唯一来源,参与DNA的合成与修复,是一种叶酸依赖性酶,也是培美曲塞作用的主要靶点之一。本文回顾性分析30例ⅢB/Ⅳ期肺腺癌患者肿瘤组织中的TS表达,探讨其表达与培美曲塞化疗疗效的关系。
1 材料与方法
1.1 研究对象
收集河源市人民医院2011年1月-2013年6月治疗的NSCLC患者30例,入组条件:⑴均经组织学病理确诊为肺腺癌。⑵根据美国癌症联合会(American Joint Committee on Cancer, AJCC)第6版肺癌TNM分期标准为ⅢB期、Ⅳ期的初治患者。⑶有符合RECIST标准的可测量病灶。⑷预计生存期>3个月。⑸体力状况(ECOG)评分≤2分。⑹血常规、肝肾功能及心电图检查基本正常,无化疗禁忌。⑺患者自愿签署知情同意书。其中男性18人,女性12人,年龄32~70岁,中位年龄50岁,ⅢB期患者8人,Ⅳ期患者22人。
1.2 治疗方案
化疗方案为培美曲塞+顺铂:培美曲塞500 mg/m2,d1;顺铂75 mg/m2,d1;21 d为1周期,至少连续用药2周期后评价疗效,化疗后每3个月复查1次,共随访1年,直至患者疾病进展或死亡,若末次随访仍然存活则定为截尾值。随访截止时间2014年6月。首次培美曲塞用药前1周肌注维生素B12注射液1 mg,以后每3周期(9周)1次;用药前口服叶酸片0.4 mg,1次/d,至少服用5次日用量,并服用整个治疗周期,至末次给药后21天结束;给药前1天、当天和给药后1天口服地塞米松3.75 mg,2次/d。
1.3 TS蛋白表达的检测
采用免疫组化SP法检测肺腺癌患者肿瘤组织中TS蛋白表达。鼠抗单克隆TS抗体及SP免疫组化试剂盒均购自Zymed公司。标本用4%甲醛固定,石蜡包埋、切片,厚度4 μm,常规脱蜡、水化,热修复组织玻片,3%H2O2灭活内源性过氧化物酶,一抗室温孵育1 h,TBS冲洗5 min,共3次;二抗室温孵育30 min,TBS冲洗5 min,共3次;DAB显色,苏木精对比染色,常规脱水透明后中性树脂封固,显微镜下观察。已知阳性切片作为阳性对照,以PBS代替一抗作阴性对照。
1.4 结果判定
采用显微图象分析仪对每张肿瘤切片进行图象分析,TS蛋白以细胞浆有棕黄色颗粒为阳性。参照H-评分法,根据阳性着色细胞所占百分数与细胞着色程度乘积判定阳性结果。
1.5 疗效评价
采用RECIST 1.1标准对疗效进行评价,分为CR(完全缓解),PR(部分缓解),SD(疾病稳定),PD(疾病进展)。CR+PR=RR为客观缓解率,CR+PR+SD=DCR为疾病控制率。无进展生存时间(DFS)为治疗开始至肿瘤复发或进展的时间。
1.6 统计学处理
采用SPSS13.0统计软件包对数据进行分析,计数资料采用Fisher精确检验,采用Kaplan-Meier方法进行无进展生存时间的分析,生存率比较用log-rank检验。
2 结 果
2.1 TS蛋白在肺腺癌组织中的表达及与临床特征的关系
在30例肺腺癌患者中,TS蛋白阴性23例(76.67%),阳性7例(23.33%)。TS蛋白表达在不同性别、年龄、临床分期的患者间差异无统计学意义(P>0.05),见表1。
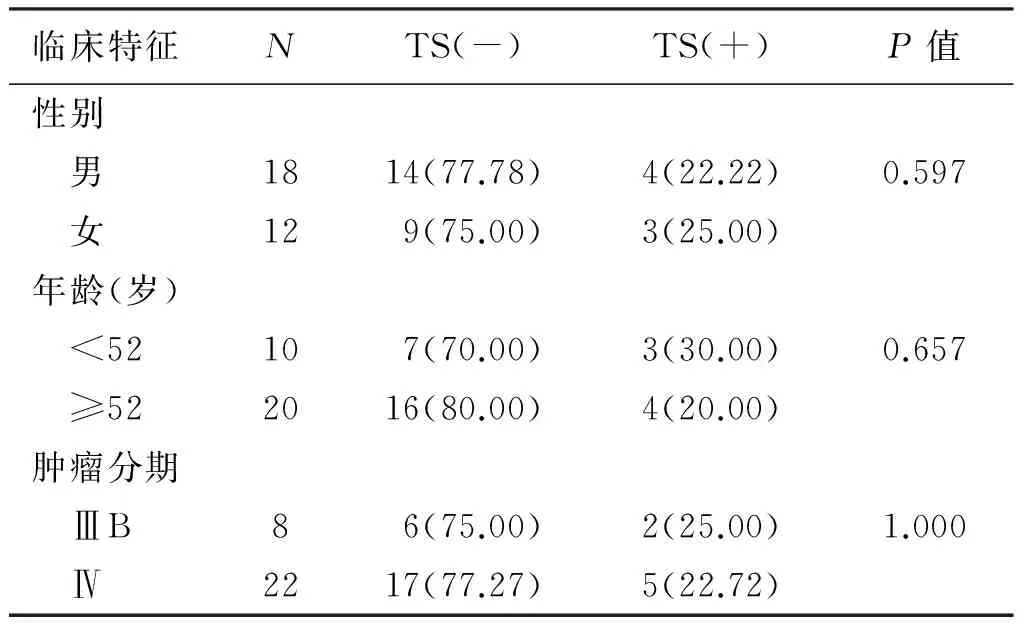
表1 TS蛋白表达与临床特征的关系 n(%)
2.2 疗效分析
在30例晚期肺腺癌患者中,1例CR(3.33%),10例PR(33.33%),13例SD(43.33%),客观缓解率(RR)为36.67%,疾病控制率(DCR)为80%。TS蛋白表达阴性患者客观缓解率为43.48%,TS蛋白表达阳性患者客观缓解率为14.29%,差异无统计学意义(P=0.215>0.05);TS蛋白表达阴性患者疾病控制率为91.30%,TS蛋白表达阳性患者疾病控制率为42.86%,差异有统计学意义(P=0.016<0.05)。TS蛋白表达阳性患者DFS为3个月(95%CI:1.075-4.925),而TS蛋白表达阴性患者DFS为10个月(95%CI:8.645-11.335)。Kaplan-Meier生存曲线显示:TS蛋白阴性表达者1年DFS百分比高于阳性表达者,差异有统计学意义(P=0.047<0.05),图1。

图1 TS蛋白表达与肺腺癌患者无疾病进展时间之间的关系
3 讨 论
对于局部晚期及晚期肺癌患者,大多数失去手术机会,化疗为其主要治疗手段。虽然目前治疗取得一些进展,但是化疗有效率仍较低,在20%-40%左右,中位生存时间仅8-10个月[2]。肿瘤分子基因表达谱的显著差异是导致化疗疗效不尽相同的主要因素,因此针对肺癌特异的分子靶点选择药物治疗是肿瘤化疗的研究热点。
胸苷酸合成酶(TS)广泛存在于人类的细胞质中,定位于人类第18号染色体上,由两个相同的单位组成二聚体,每个亚单位36 kpa,长16 kbp。在DNA合成、复制和修复中起着极其重要的作用,是已知抗肿瘤药物重要的靶点之一,能够导致DNA断裂从而引起细胞死亡[3]。Nakagawa[4]通过免疫组化检测NSCLC患者术后肿瘤组织中TS活性水平发现,肿瘤组织中TS活性水平越高,癌细胞增殖活性越高。临床前研究表明TS的活性水平影响着抗TS药物对肿瘤的敏感性,其表达水平可能作为TS特异性抑制剂临床疗效的预测指标[5]。
培美曲塞是一种新的、多靶位叶酸拮抗剂,通过同时抑制叶酸代谢过程中的3个关键酶:胸苷酸合成酶(TS)、二氢叶酸还原酶(DHFR)和甘氨酰胺核苷甲酰基转移酶(GARFT)的活性,直接抑制嘧啶和嘌呤的合成,从而影响肿瘤细胞DNA及RNA的合成,抑制细胞增殖[6]。数个大型临床研究亚组分析显示,培美曲塞治疗腺癌的效果优于鳞癌[7,8]。而郭惠琴等[9]通过检测111例NSCLC患者的肿瘤标本TS表达情况发现,TS表达水平在鳞癌患者的肿瘤组织中较其他组织学类型高。因此,有学者认为TS表达水平高低是导致培美曲塞耐药的关键因素。
我们通过检测30例肺腺癌患者中TS蛋白表达发现,TS蛋白表达阳性率为23.33%,其表达与患者性别、年龄及肿瘤分期无关(P>0.05)。经培美曲塞一线治疗后,TS表达阴性患者客观缓解率(RR)与TS表达阳性患者比较差异无统计学意义(P>0.05);TS蛋白表达阴性患者疾病控制率(DCR)与TS蛋白表达阳性患者比较差异有统计学意义(P<0.05)。TS蛋白表达阳性患者DFS为3个月,而TS蛋白表达阴性患者DFS为10个月。Kaplan-Meier生存曲线显示:TS蛋白阴性表达者1年DFS百分比高于阳性表达者,差异有统计学意义(P<0.05)。以上结果表明,培美曲塞治疗的晚期肺腺癌患者中TS蛋白表达阴性的患者在疾病控制率及DFS方面明显优于表达阳性患者。王治宽[10]等通过RT-PCR检测培美曲塞一线治疗晚期肺腺癌患者肿瘤组织中TS的表达发现,TS低表达的患者DCR高于高表达患者。邓燕明[11]等研究显示,培美曲塞对晚期肺腺癌TS低表达患者的DCR明显高于高表达者,PFS亦较高表达者延长。上述研究与本研究结果一致。因此,我们认为TS蛋白表达可作为预测肺腺癌患者对培美曲塞的敏感性的指标,TS表达阴性肺腺癌患者可以从含培美曲塞的化疗方案中获益。
[1] Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J]. N Engl J Med, 2002, 346(2):92-98.
[2] Goffin J,Lacchetti C,Ellis PM,et al. First-line systemic chemotherapy in the treatment of advanced non-small cell lung cancer:a systematic review[J].J Thorac Oncol, 2010,5(2):260-274.
[3] 李 培, 康晓征, 陈克能. ERCC1、RRM1和TS在非小细胞肺癌中的临床意义[J].中国肺癌杂志,2014,6(17):496-500.
[4] Nakagawa T, Tanaka F, Otake Y, et al. Prognostic value of thymidylate synthase expression in patients with p-stage I adenocarcinoma of the lung[J].Lung Cancer, 2002, 35(2): 165-170.
[5] Hashimoto H, Ozeki Y, Stato M, et al. Signicance of thymidylate synthase gene expression level in patient with adenocarcinoma of the lung[J].Cancer,2006,106(7):1555-1561.
[6] Sorensen JB. Pharmacokinetic evaluation of pemetrexed[J].Expert Opin Drug Metab Toxicol, 2011, 7(7): 919-928.
[7] Ciuleanu T,Brodowicz T,Zielinski C,et al. Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer: a randomized,double-blind,phase 3 study[J].Lancet,2009,374:1432-1440.
[8] Scagliotti G,Hanna N,Fossella F,et al.The differential efficacy of pemetrexed according to NSCLC histology: a review of two Phase Ⅲ studies[J.Oncologist,2009(14):253-263.
[9] 郭惠琴, 赵 宇, 陆江阳, 等. TS在非小细胞肺癌组织中表达的临床病理特征[J].癌症进展, 2011,9(5): 585-587.
[10] 王治宽,胡毅,赵宏,等.晚期肺腺癌胸苷酸合成酶和培美曲塞疗效分析[J]. 南方医科大学学报, 2010,30(5): 978-980.
[11] 邓燕明,梁剑苗,冯卫能,等.非小细胞肺癌组织TS表达与培美曲塞治疗疗效相关性的研究[J].中华肿瘤防治杂志, 2012,19(21): 1636-1639.
(本文编辑:郑颖)
Clinical study on the thymidylate synthase expression and therapeutic effect of pemetrexed in advanced lung adenocarcinoma
TianDan1,WangJun2,ChengYue1,YangHaijing1,WuJian1,HuangGuoqing1(1DepartmentofOncology,2Departmentofpathology,HeyuanPeople′sHospital,Heyuan,Guangdong517000,China)
Objective:To investigate the expression of thymidylate synthase (TS) in patients with advanced lung adenocarcinoma and its relation with the therapeutic effect of pemetrexed. Methods:The clinicopathological data of 30 patients with stage IIIIB/IV lung adenocarcinoma receiving pemetrexed treatment were retrospectively analyzed. The tumor samples of the patients were collected for detecting TS expression using immunohistochemistry, and the therapeutic effect of the treatment was analyzed. Results:TS positivity was found in 23.33% of the patients. TS positivity was not correlated to gender,age or TNM stage. The response rate(RR) of pemetrexed treatment was 43.48% in TS-negative patients,as compared to 14.29% in the positive patients ,the difference was no statistically significant(P=0.215>0.05). Patients with negative TS expression had significantly higher disease control rate(DCR) by pemetrexed treatment than those with TS positive expression(91.30%vs 42.86%,P=0.016<0.05).Kaplan-Meier survival curves show: the negative expression of TS 1years DFS is better than that of the positive expression, the difference was statistically significant (P=0.047<0.05).Conclusion:TS expression may serve as an indicator to predict the sensitivity of chemosensitivity to pemetrexed in patients with advanced lung adenocarcinoma.The negative expression of TS can benefit from chemotherapy with pemetrexed in.
thymidylate synthase; pemetrexed; lung adenocarcinoma; therapeutic effect
10.3969/j.issn.2095-9664.2015.02.029
田 丹(1982-),女,主治医师,硕士研究生。
R734.2
A
2095-9664(2015)02-0094-03
2014-11-05)
研究方向:恶性肿瘤的内科治疗。
