肉桂酸对黄瓜的化感效应研究
2015-03-13王茹华浦洪欣
王茹华,浦洪欣
(黑龙江八一农垦大学农学院,大庆 163319)
化感作用(Allelopathy)是指由各种植物或微生物释放的化学物质所引起的生化相生或相克作用[1]。许多学者前期研究发现,肉桂酸是茄子根系分泌物中的主要化感物质之一[2],茄子在经过多年的连作后,会导致其土壤中包括肉桂酸在内的许多化感物质进行大量积累[3]。而这些物质可能对下茬蔬菜作物的生长发育产生影响。研究以肉桂酸作为茄子根系分泌的代表性化感物质,以黄瓜作为受体,研究模拟化感物质肉桂酸对黄瓜发芽和生理特性的影响,初步揭示出茄子根系分泌物中的化感物质对其下茬作物黄瓜生长的作用效果,为指导果菜类生产实践提供了一定理论方面依据。
1 材料与方法
1.1 供试材料
齐研绿星黄瓜品种为试材。
1.2 试验方法
1.2.1 肉桂酸溶液的配置
将肉桂酸按试验要求分别配成0(CK)、0.1、0.5、1.0、4.0 mmol·L-1共计5个浓度[2]。肉桂酸溶液配制时先用少量乙醇溶解,再加入蒸馏水,调节各溶液中乙醇的含量达到1.5%。
1.2.2 发芽试验
采用滤纸培养皿法[4]。从种子发芽开始,连续7 d观察并记载发芽率,计算得出发芽速度指数(I)[5]。I=2×(7X1+6X2+5X3+4X4+3X5+2X6+X7),其中X表示每间隔24 h发芽的种子数,X1表示24 h后的发芽数,X2表示48 h后的发芽数,后面依次类推。培养7 d后调查黄瓜胚根长度、幼芽长度、幼芽干质量和鲜质量。胚根长度和幼芽长度用直尺测量;干、鲜质量则用千分之一天平测量。每个处理设置3次重复。
1.2.3 幼苗试验
选择籽粒饱满、大小一致的黄瓜种子,消毒后将其放入28℃的温箱中进行催芽,待种子露白后播种于10×10 cm营养钵中,每处理进行3次重复,每重复播种10株幼苗。待黄瓜幼苗长到两叶一心时,分别施用配制好的不同浓度的肉桂酸溶液,进行灌根处理,每株施100 mL,均匀浇灌在营养钵中,共处理1次[4]。处理后进行常规管理,如浇水等。培养20 d后取样调查叶片的细胞膜透性和丙二醛(MDA)含量[6]。
2 结果与分析
2.1 肉桂酸对黄瓜种子发芽率的影响
从表1可以看出,各浓度处理黄瓜种子的发芽率整体变化趋势基本一致,从第1 d到第2 d发芽率急剧增加,之后变化速度又趋于平缓。第1 d时,4.0 mmol·L-1浓度处理的黄瓜种子发芽率显著低于CK处理,其余几个处理黄瓜发芽率虽比CK低,但差异没有达到显著水平;在第2 d时,0.1 mmol·L-1处理的黄瓜发芽率略高于CK;其余几天基本上各处理发芽率都小于或等与CK,但差异均未达到显著水平。总体来说,各浓度肉桂酸处理对黄瓜的发芽率影响不大,这可能与每皿只加入5 mL处理液,肉桂酸量较少有关。
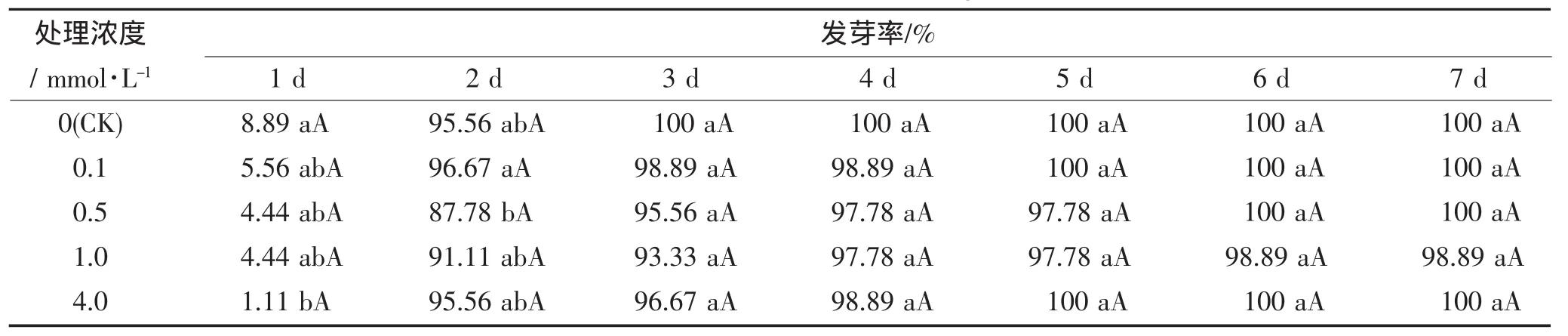
表1 肉桂酸对黄瓜发芽率的影响Table 1 Effects of cinnamic acid on cucumber germination rate
2.2 肉桂酸对黄瓜发芽速度和芽生长的影响
从表2可以看出,经肉桂酸作用后黄瓜的发芽速度减缓,表现为I值都低于CK,降低幅度达到0.74%~3.68%,除了0.1 mmol·L-1处理与CK差异没有达到显著水平外,其余几个浓度处理与CK差异都达到了显著水平。肉桂酸对黄瓜芽长、胚根长也起到了负面影响,当处理浓度是4.0 mmol·L-1时,肉桂酸对黄瓜芽长、胚根长的抑制作用最大,与CK相比差异达到了极显著水平;其余几个浓度处理也都不同程度的抑制了黄瓜芽的生长,但与CK差异没有达到显著水平。并且当肉桂酸处理浓度为4.0 mmol·L-1时,黄瓜幼苗的鲜重极显著低于CK。其余几个浓度处理与CK差异不显著,其中,0.1 mmol·L-1和0.5 mmol·L-1两个低浓度的肉桂酸溶液处理在一定程度上明显增加了黄瓜幼苗的鲜重,增幅为6.82%~24.09%,而1.0 mmol·L-1相对较高浓度的处理则抑制了黄瓜幼苗鲜重的增加,抑制率为3.78%。而经不同浓度肉桂酸处理的黄瓜幼苗干重都有所增加,增幅为0.37%~4.49%,但与CK相比差异没有达到显著水平。总体来说,除4.0 mmol·L-1处理外,其余几个浓度处理对黄瓜的芽生长影响不大,至于1~4 mmol·L-1各浓度对黄瓜芽生长的作用效果还有待于进一步研究。
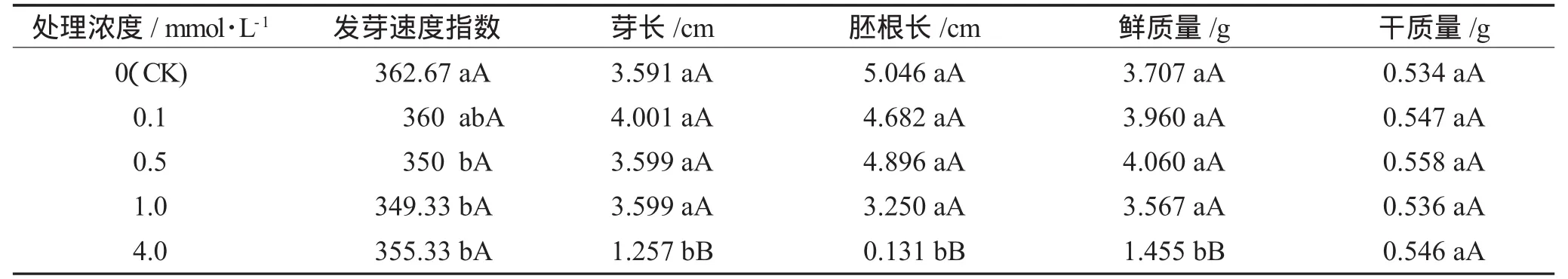
表2 肉桂酸对黄瓜种子发芽速度和芽生长的影响Table 2 Effects of cinnamic acid on germinating and sprout growth rate of cucumber seeds
2.3 肉桂酸对黄瓜幼苗丙二醛含量和细胞膜透性的影响
逆境条件下会造成植物器官的衰老,而此过程中往往会发生膜脂过氧化作用,其产物丙二醛(MDA)会严重损伤生物膜理化性质。所以,通常利用丙二醛含量变化作为脂质过氧化指标,表示其在逆境条件下细胞膜脂过氧化程度和植物衰老指标反应强弱。MDA含量能直接反映膜脂过氧化作用的大小,研究显示,在MDA含量大时,膜脂过氧化作用就大,相对应细胞受伤害程度也就越大[6],反之亦然。从表3可以看出,不同浓度肉桂酸处理的黄瓜叶片中MDA的含量均有所增加,并且0.1 mmol·L-1和4.0 mmol·L-1两个浓度与CK处理差异均达到了极显著水平。
在受到各种外界逆境危害时,首先植物本身细胞膜的结构和功能受到伤害,导致细胞膜透性增大[7]。因此,外部不良环境对植物细胞的伤害程度往往用细胞膜透性的变化来反映,同时细胞膜在逆境下的稳定性也可以体现植物抗逆性的高低。从表3可以看出,4种浓度肉桂酸处理均导致细胞膜透性的增大,尤其是在4.0 mmol·L-1的浓度处理条件下,细胞膜相对透性达到最大,增幅为70.92%,与CK差异达到了显著水平。

表3 肉桂酸对黄瓜幼苗丙二醛含量和细胞膜透性的影响Table 3 Effects of cinnamic acid on cucumber MDA and cell membrane relative permeability
3 结论与讨论
化感物质对受体的显著作用特征之一为浓度效应。王茹华等[2]研究发现,茄子根系分泌物中普遍存在的化感物质为肉桂酸,其对茄子种子萌发的化感效应表现为“低促高抑”,即低浓度时促进、高浓度时抑制的作用特点。耿广东等[7]在对莴苣的研究也发现,低浓度的肉桂酸促进莴苣生理生化代谢及生长,而高浓度时则出现抑制作用。李夏等[5]在对自毒物研究时也发现,茄子自毒物质肉桂酸和香草醛对辣椒种子萌发也表现出低浓度促进,高浓度抑制的化感效应,同时随着自毒物质浓度的增大抑制作用不断增强。陈龙等[8]在对大豆化感作用研究中发现,肉桂酸对大豆种子萌发的抑制作用最强,香草酸最弱。
试验研究发现,不同浓度的肉桂酸能从一定程度上抑制黄瓜种子的萌发,表现为I值、发芽率降低,并且在向高浓度条件下这种抑制作用表现更明显,4.0 mmol·L-1肉桂酸处理能极显著的抑制黄瓜芽鲜重增加及伸长生长。试验进一步研究发现,肉桂酸处理对黄瓜幼苗的生理代谢产生了负面影响,尤其是在4.0 mmol·L-1的浓度条件下,黄瓜叶片中细胞膜透性、丙二醛含量与CK差异均达到显著水平。毋庸置疑,土壤中肉桂酸等化感物质随着连作时间年限的增长必然会大量积累,当其中化感物质含量超过土壤自身的调节能力时,必然会对其播种的下茬作物生长及生理特性造成较大影响,如何消除化感作用对作物自身带来的这种不利影响已成为生产中有待解决的一个重大问题。
自毒是一种发生在植物种内的生长抑制作用。现已研究证实,番茄、西瓜、茄子、甜瓜和黄瓜等作物极易产生自毒作用。目前许多学者已在黄瓜、番茄和辣椒等设施园艺作物的根系分泌物及组织中分离出包括肉桂酸、苯甲酸和水杨酸在内的十余种植物自毒物质。这些植物自毒物质往往通过影响离子吸收[9]、光合作用[10]、水分吸收[11]、蛋白质和DNA合成[12]等多种方式来影响植物生长发育及生理特性。土壤的吸附以及微生物作用,这些物质可能发生数量和结构的变化而加剧或缓解自毒作用[10]。试验在论证肉桂酸对黄瓜化感作用影响过程中,未排除黄瓜自毒现象,今后试验还需进一步深入研究黄瓜自毒物质在根际中的消长变化规律。
[1] 张启发,王茹华,范明珠.茄子自毒作用及控制途径的初步研究[J].黑龙江八一农垦大学学报,2007,19(5):12-15.
[2] 王茹华,周宝利,张启发,等.茄子根系分泌物中香草醛和肉桂酸对黄萎菌的化感效应[J].生态学报,2006,26(9):3152-3155.
[3] 陈绍莉,周宝利,尹玉玲,等.茄子自毒物质胁迫下嫁接对其生长及土壤生化特性的影响[J].园艺学报,2010,37(6):906-914.
[4] 王茹华,曲光峰,张启发,等.肉桂酸对番茄的化感效应研究[J].中国蔬菜,2014(3):29-32.
[5] 李夏,周宝利,陈绍莉,等.茄子自毒物质对辣椒种子萌发及枯萎菌的化感效应[J].生态学报,2009,29(2):960-965.
[6] 邹琦.植物生理生化实验指导[M].北京:中国农业出版社,1995.
[7] 赵秋月,张广臣.盐胁迫下番茄种子萌发及抗逆机理的研究[J].安徽农业科学,2013,41(33):12835.
[8] 陈龙,李建东,王国骄,等.几种酚酸对大豆种子萌发的化感效应[J].种子,2011,30(5):83-86.
[9] Yu J Q,Matsui Y.Effects of root exudates of cucumber(Cueumis sativus) and allelochemicals on uptake by cucumber seedlings[J].Chem.Ecol,1997,23:817-827.
[10] Koitabashi R,Suzuki T,Kawazu T,et al.1,8-Cincole inhibits root growth and DNA synthesis in the root apical meristem of Brassica campestris L[J].J Plant Res,1997,110:1-6.
[11] Blum U,Shafer,Lehmen M E.Evidence for inhibitory allelopathic interactions including phenolic acids in field soils[J].Concept VS.An experimental model,Crit.Rev.in PlantSc,1999,18:673-693.
[12] Friebe A,Roth U,Kfiek P,et al.Effects of DIBOA OH the activity of plasma memberane H+-ATPase[J].Phytochemistry,1997,44:979-983.
