Beclin—1、细胞周期蛋白D1在腮腺肿瘤组织中的表达及临床意义
2015-03-13田希存刘江
田希存++++++刘江
[摘要] 目的 观察Beclin-1、细胞周期蛋白D1(cyclin D1)在良恶性腮腺肿瘤组织中的表达,探讨其与肿瘤发生、发展的关系。 方法 对30例腮腺多形性腺瘤、41例癌在多形性腺瘤中患者的病理标本进行免疫组织化学SP法染色。观察Beclin-1、cyclinD1的阳性表达。并取腺瘤旁组织21例作为对照。 结果 癌在多形性腺瘤中、腮腺多形性腺瘤、腺瘤旁组织中Beclin-1的阳性率分别为58.5%、93.3%、95.2%。腮腺多形性腺瘤、腺瘤旁组织的Beclin-1的阳性率与癌在多形性腺瘤中比较差异均有统计学意义(均P < 0.05),腮腺多形性腺瘤、腺瘤旁组织的Beclin-1的阳性率比较差异无统计学意义(P > 0.05)。癌在多形性腺瘤中、腮腺多形性腺瘤、腺瘤旁组织中cyclin D1的阳性率分别为80.5%、50.0%、19.0%,腮腺多形性腺瘤、腺瘤旁组织的cyclin D1的阳性率与癌在多形性腺瘤中比较差异均有统计学意义(均P < 0.05),腮腺多形性腺瘤组织与腺瘤旁比较差异有统计学意义(P < 0.05)。癌在多形性腺瘤中组织的Beclin-1、cyclin D1的表达与年龄、性别、肿瘤直径无关(均P > 0.05);与TNM分期及淋巴结是否转移有关(均P < 0.05)。 结论 良、恶性腮腺肿瘤组织Beclin-1、cyclin D1均有不同的表达,表明Beclin-1、cyclin D1与腮腺肿瘤的发生、发展密切相关。
[关键词] 腮腺多形性腺瘤;癌在多形性腺瘤中;Beclin-1;细胞周期蛋白D1
[中图分类号] R737.33 [文献标识码] A [文章编号] 1673-7210(2015)02(c)-0004-04
腮腺多形性腺瘤是腮腺区最常见的良性肿瘤,在临床上有2%~3%的复发率,并且可以癌变[1]。因此了解多形性腺瘤和癌在多形性腺瘤中的发生发展机制对肿瘤的预防、早期诊断和治疗都有着非常重要的意义。近年研究表明,Beclin-1、细胞周期蛋白D1(cyclin D1)与肿瘤的发生、发展密切相关[1-2]。在腮腺肿瘤,尤其是腮腺多形性腺瘤及癌在多形性腺瘤中组织的Beclin-1、cyclin D1表达有关报道较少。现对河北省唐山市中医医院(以下简称“我院”)2009年10月~2014年10月住院治疗的71例腮腺肿瘤患者的临床资料进行分析,旨在探讨Beclin-1、cyclin D1在良恶性腮腺肿瘤组织中的表达,为临床的诊断、治疗及预后提供理论依据。
1 资料与方法
1.1 一般资料
收集2009年10月~2014年10月来我院住院治疗的腮腺肿瘤患者71例,均经手术病理证实。其中,腮腺多形性腺瘤30例,癌在多形性腺瘤中41例。并取腺瘤旁组织21例作为对照。71例中男31例,女40例;年龄23~72岁,平均(40.1±5.2)岁。所有病例术前均未进行任何抗肿瘤治疗。本研究经医院伦理委员会通过,患者均知情同意并签署知情同意书。
1.2 方法
1.2.1 主要试剂与仪器 Beclin-1单克隆抗体为美国Santa Cruze公司产品。即用型鼠抗人cyclin D1单克隆抗体与试剂盒购自北京中山生物技术有限公司。高清晰度彩色图文分析系统购自武汉千屏影像技术有限公司。
1.2.2 免疫组织化学SP法 病理组织以10%福尔马林固定,常规石蜡包埋,4 μm连续切片。对标本行免疫组织化学SP法染色。以乳腺癌组织切片作为阳性对照,以PBS替代一抗作为阴性对照。
1.2.3 阳性判定标准 Beclin-1阳性判定标准:细胞质内出现棕黄色颗粒为阳性细胞。判断标准:随机观察10个高倍视野,每个视野计数100个细胞,根据阳性细胞的比率和染色深度进行综合评定。阳性细胞计数评分标准:1分:阳性细胞数占总细胞数<10%;2分:阳性细胞数占总细胞数10%~50%;3分:阳性细胞数占总细胞数>50%。染色深度评分标准:0分:无染色;1分:淡黄色:2分:黄色;3分:棕黄色。总评分为2项评分相乘。0~3分为阴性,4分及以上为阳性。cyclin D1免疫组化阳性判定标准:细胞核出现棕色小颗粒为阳性细胞。阳性细胞与总细胞数的比值>10%为阳性表达,反之为阴性表达。
1.3 统计学方法
采用SPSS 13.0统计软件进行数据分析,计数资料采用χ2检验或精确概率法,P < 0.05为差异有统计学意义。
2 结果
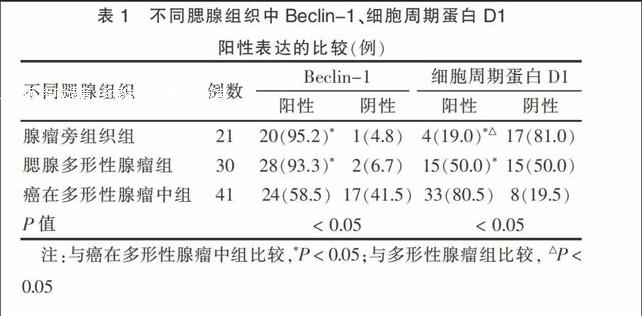
2.1 不同腮腺组织中Beclin-1、cyclin D1的阳性表达
Beclin-1阳性定位于细胞质中,细胞质内可见棕黄色颗粒。癌在多形性腺瘤中、腮腺多形性腺瘤、腺瘤旁组织中Beclin-1的阳性率分别为58.5%、93.3%、95.2%。腮腺多形性腺瘤、腺瘤旁组织的Beclin-1的阳性率与癌在多形性腺瘤中比较差异均有统计学意义(均P < 0.05),腮腺多形性腺瘤、腺瘤旁组织的Beclin-1的阳性率比较差异无统计学意义(P > 0.05)。cyclin D1阳性定位于细胞核,细胞核中出现棕色小颗粒。癌在多形性腺瘤中、腮腺多形性腺瘤、腺瘤旁组织中cyclin D1的阳性率分别为80.5%、50.0%、19.0%,腮腺多形性腺瘤、腺瘤旁组织的cyclin D1的阳性率与癌在多形性腺瘤中比较差异均有统计学意义(均P < 0.05),腮腺多形性腺瘤组织与腺瘤旁比较差异有统计学意义(P < 0.05)。见表1。
表1 不同腮腺组织中Beclin-1、细胞周期蛋白D1
阳性表达的比较(例)
注:与癌在多形性腺瘤中组比较,*P < 0.05;与多形性腺瘤组比较, △P < 0.05
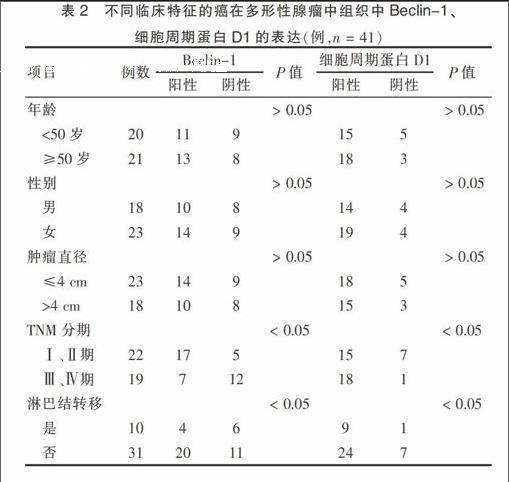
2.2 Beclin-1、cyclin D1在癌在多形性腺瘤中不同临床特征的表达
Beclin-1、cyclin D1的表达与年龄、性别、肿瘤直径无关(P > 0.05);与TNM分期及淋巴结是否转移有关(P < 0.05)。见表2。
3 讨论
多形性腺瘤又名混合瘤,是腮腺常见的良性肿瘤,其生长缓慢,呈膨胀性生长,影响容貌,术后容易复发,多次复发有恶变可能,可危及患者生命。近年来自噬与肿瘤的关系逐渐被人们所重视。研究发现,肿瘤患者体内存在自噬活性的改变[3],因此,推测自噬活性的改变与肿瘤的发生、发展密切相关。自从酵母模型建立以来,发现自噬的调节是一个非常复杂的过程,需要多种分子的参与,其中Beclin-1是酵母自噬相关基因ATG6的哺乳动物同源基因,是一种双等位抑癌基因[4],Beclin-1含有12个外显子,编码450个氨基酸。Beclin-1基因定位于染色体17q21,是自噬的执行者。研究表明,Beclin-1参与了自噬体的形成,并促进其成熟,具有促进肿瘤细胞凋亡,抑制肿瘤增殖的功能[4]。多项研究表明,Beclin-1在多种恶性肿瘤中缺失,如卵巢癌、乳腺癌及前列腺癌等[5]。也有学者实验证明,在敲除小鼠的Beclin-1等位基因后,小鼠恶性肿瘤的发病率明显高于正常小鼠[6]。李磊等[7]研究表明,Beclin-1在正常腮腺组织、腮腺多形性腺瘤、癌在多形性腺瘤中的阳性率分别为100%、92%、63%;Beclin-1在腮腺多形性腺瘤及癌在多形性腺瘤中表达下调,自噬功能改变可能在腮腺肿瘤形成中具有一定作用。本研究结果表明,癌在多形性腺瘤中、腮腺多形性腺瘤、腺瘤旁组织中Beclin-1的阳性率分别为58.5%、93.3%、95.2%。与腮腺多形性腺瘤、腺瘤旁组织比较,癌在多形性腺瘤中组织中Beclin-1的表达下降,差异有统计学意义(P < 0.05);而腮腺多形性腺瘤、腺瘤旁组织中Beclin-1的表达比较差异无统计学意义(P > 0.05)。淋巴结转移及TNM分期与Beclin-1的表达有关(均P < 0.05)。本研究结果与上述研究结果大致相符。
cyclin D1是细胞周期的正调节因子,是CDK4/6的活化因子,与其结合后共同促进细胞周期。研究表明过度表达的蛋白加速了细胞周期转化,导致细胞异常增殖[8-11]。在食管、肺、结肠、肝和胰腺等各种肿瘤中均发现了cyclin D1异常表达。Pignataro等[12]于1998年第1次报道腺样囊性癌中cyclin D1基因的改变,21.4%的腺样囊性癌组织出现过表达。向国林等[1]研究表明,cyclin D1在正常腮腺组织、多形性腺瘤初发瘤、多形性腺瘤复发瘤及癌在多形性腺瘤中的阳性表达率分别为0%、38%、50%、75%,多形性腺瘤与癌在多形性腺瘤中比较有显著性差异(P < 0.05),多形性腺瘤复发瘤中阳性表达率高于多形性腺瘤初发瘤,但无显著性差异(P > 0.05)。本研究结果表明,癌在多形性腺瘤中、腮腺多形性腺瘤、腺瘤旁组织中cyclin D1的阳性率分别为80.5%、50.0%、19.0%,腮腺多形性腺瘤、腺瘤旁组织的cyclin D1的阳性率与癌在多形性腺瘤中比较差异均有统计学意义(均P < 0.05),腮腺多形性腺瘤组织与腺瘤旁比较差异有统计学意义(P < 0.05)。本研究结果与上述研究结果大致相同。本研究结果表明,淋巴结转移及TNM分期与cyclin D1的表达有关(P < 0.05)。
综上所述,不同性质的腮腺肿瘤组织Beclin-1、cyclin D1均有不同的表达,表明Beclin-1、cyclin D1与腮腺肿瘤的发生、发展密切相关,随着对其致病机制不断深入的研究,通过调节肿瘤细胞的自噬活性,诱导肿瘤细胞自噬性死亡,使其在肿瘤治疗领域具有广泛的应用前景。
[参考文献]
[1] 向国林,朱声荣,陈卫民,等.COX-2、cyclinD1在多形性腺瘤和癌在多形性腺瘤中的表达及意义[J].临床口腔医学杂志,2007,23(3):131-134.
[2] 李冉,李磊,刘江,等.Beclin1与LC3蛋白在腮腺多形性腺瘤及腮腺癌在多形性腺瘤中的表达和意义[J].第三军医大学学报,2012,34(13):1293-1296.
[3] Liang XH,Jackson S,Seaman M,et al. Induction of autophagy and inhibition of tumorigenesis by beclin 1[J]. Nature,1999,402(6762):672-676.
[4] Takahashi Y, Coppola D,Matsushita N,et al. Bif-1 interacts with Beclin1 through UVRAG and regulates autophagy and tumorigenesis [J]. Nat Cell Biol,2007,9(10):1142-1151.
[5] Mizushima N,Levine B,Cuervvo MA,et al. Autophagy fights disease through cellularself-digestion [J]. Nature,2008, 451(7182):1069-1075.
[6] Brech A,Ahlquist T,Lothe RA,et al. Autophagy in tumour suppression and promotion [J]. Mol Oncol,2009,3(4):366-375.
[7] 李磊,李冉,刘江,等.Beclin1和LC3在腮腺多形性腺瘤及癌在多形性腺瘤中的表达和意义[J].实用口腔医学杂志,2012,28(5):585-588.
[8] Diehl JA. Cycling to cancer with cyclinD1 [J]. Cancer Biol Ther,2002,1(3):226-231.
[9] Serrano M,Hannon GJ,Beach D. A new regulatory monmual-cycle control causing specific inhibition Cyclin D/ CDK4 [J]. Nature,1993,366(6456):704-707.
[10] Zheng Y,Shen H,Sturgis EM,et al. CyclinD1 Polymorphism and risk for sguamous cell carcinoma of head and neck:acasecontral study [J]. Carcinogenesis,2001, 22(8):1195-1199.
[11] 汤国雄,朱声荣,陈卫民,等.β–连环蛋白、细胞周期蛋白D1在涎腺多形性腺瘤及其恶变中表达的研究[J].临床口腔医学杂志,2006,21(11):648-651.
[12] Pinnataro L,Capaaaio P,Carboni N,et al. p53 and cyclinD1 protein expression in carcinoma of parotid gland [J]. Anticancer Res,1998,18(2B):1287-1290.
(收稿日期:2014-11-25 本文编辑:卫 轲)