早产儿动脉导管未闭超声参数预测早期自然关闭的价值*
2015-03-12杨正春冉素真沈红霞黄泽君
杨正春,冉素真,沈红霞,魏 俊,张 焜,黄泽君
(1.重庆市妇幼保健院超声科 400013;2.重庆市肿瘤研究所超声科 400030)
近年来,国外报道早产儿的发生率呈持续上升趋势,美国发生率为12%~13%,欧洲等其他发达国家为5%~9%[1]。随着新生儿重症监护及治疗技术的发展,早产儿的存活率不断提高,同时早产儿并发症的预防及治疗也已成为新生儿医学发展的重要方向。动脉导管未闭是一种较常见的先天性心脏病,约占先天性心脏病的10%~15%,早产儿发病率较成熟儿高[2]。当动脉导管左向右分流量大于体循环的50%时,可出现肺血流增多、体循环血流减少,引起体循环各脏器灌注减少,可能引发脑室内出血[3]、肺水肿[4]、坏死性小肠结肠炎、支气管及肺发育不良等[5-6],严重者可导致死亡。但药物治疗可能对早产儿的肝功能及肾功能有一定的药物不良反应[6-7]。动脉导管未闭的诊断通常为超声心动图结合临床症状,但到目前为止,仍没有预测动脉导管未闭能否自然关闭的临床或超声诊断标准[8]。故若能寻求一种无创、准确、快捷的检查方法预测早产儿动脉导管能否早期自然关闭具有重要的临床价值和广泛的应用前景。而超声心动图检查具有无创、快捷的特点,特别适合早产儿动脉导管未闭的早期诊断。本研究旨在探讨早产儿动脉导管未闭超声参数预测其早期自然关闭的价值。
1 资料与方法
1.1 一般资料 对2013年10月至2014年10月出生后24h内到重庆市妇幼保健院新生儿科住院首次检查存在动脉导管未闭的早产儿(孕周小于37周)进行前瞻性研究,不包括7d内死亡者、合并其他先天性心脏病者(除卵圆孔未闭、三尖瓣生理性反流外)及7d内因临床需要接受药物治疗者或手术关闭的动脉导管未闭治疗者,共计110名。分为动脉导管未闭组(出生后7d内动脉导管仍开放者)及对照组(7d内动脉导管自然关闭者)。动脉导管未闭组24例,男11例,女13例,出生孕周为30+2~36+6周,平均出生孕周(33.3±1.5)周,体质量(2 230.9±325.5)g;对照组86例,男42例,女44例,出生孕周为30+2~36+6周,平均出生孕周(33±1.2)周,体质量(2 246.5±306.5)g。
1.2 仪器与方法
1.2.1 仪器 GE Vividi(美国GE公司)彩色多普勒超声诊断仪,心脏探头(型号:6S;频率:3.0~7.0MHz)。
1.2.2 检查时间及图像、数据采集 出生后24h内入院,分别于1、3、7d行超声心动图检查。由同一名经验丰富的超声医师使用同一台超声诊断仪完成图像采集、数据的测量。左心室长轴切面用M型测量左心房收缩末期内径(left atrial diameter,LA)、主动脉根部内径(aortic root inside diameter,AO)。大动脉短轴切面观察动脉导管是否闭合,若未闭合则观察动脉导管分流的方向,测量彩色血流最细处宽度并于动脉导管肺动脉侧测量最大左向右分流速度。各超声参数均测3个心动周期取其平均值。
1.3 统计学处理 采用SPSS11.5软件分析数据,组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 早产儿动脉导管自然关闭的时间与例数 110名早产儿出生后3d及7d内动脉导管自然关闭率分别为70.9%(78/110)及78.2%(86/110);未关闭率分别为29.1%(32/110)及21.8%(24/110),见图1、2。

图1 动脉导管未闭超声二维图像
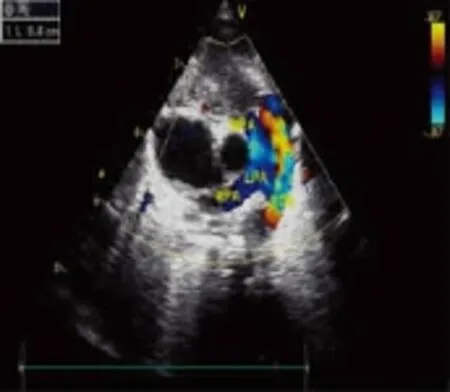
图2 动脉导管未闭超声彩色多普勒图像
2.2 首次超声检查测值比较 动脉导管未闭组的LA/AO、分流束最细处宽度均高于对照组(P<0.01),最大分流速度低于对照组(P<0.05),见表1。
2.3 出生后1d超声心动图参数ROC曲线结果比较 通过绘制ROC曲线得出动脉导管未闭早期自然关闭LA/AO、分流束导管最细处宽度及导管最大分流速的最佳临界点分别为1.32mm、2.56mm及185.5cm/s。其为临界点预测早产儿动脉导管未闭早期自然关闭的灵敏度、特异度、阳性似然比、阴性似然比,见表2。LA/AO的阳性似然比及阴性似然比分别为3.46、0.31,即当LA/AO>1.32mm时,该早产儿来自动脉导管未闭组患儿的可能性是来自对照组患儿的3.46倍,当LA/AO<1.32mm时,该早产儿来自动脉导管未闭组患儿的可能性是来自对照组患儿的约0.31倍。分流束最细处宽度的阳性似然比及阴性似然比分别为9.41、0.13,即当动脉导管内径大于2.56mm时,该早产儿来自动脉导管未闭组患儿的可能性是来自对照组患儿的9.23倍,当动脉导管内径小于2.56mm时,该早产儿来自动脉导管未闭组患儿的可能性是来自对照组患儿的约0.13倍。最大分流速度的阳性似然比及阴性似然比分别为5.40、0.23,即当最大分流速小于185.5cm/s时,该早产儿来自动脉导管未闭组患儿的可能性是来自对照组患儿的5.40倍,当最大分流速大于185.5cm/s时,该早产儿来自动脉导管未闭组患儿的可能性是来自对照组患儿的约0.23倍。
表1 出生后1d两组超声心动图参数比较(±s)

表1 出生后1d两组超声心动图参数比较(±s)
项目 对照组(n=86)动脉导管未闭组(n=24)P LA/AO 1.20±0.08 1.32±0.05 <0.01分流束最细处宽度(mm)2.10±0.40 3.50±0.60 <0.01最大分流速度(cm/s)216.36±45.13 178.76±43.25<0.05

表2 出生后1d两组超声心动图参数ROC曲线结果比较
3 讨论
动脉导管是连接于主肺动脉和左锁骨下动脉开口以远的降主动脉之间的通道[9],在胎儿时期是血液循环的主要通道。胎儿时期动脉导管呈持续开放状态是多种因素作用的结果,最主要的因素是花生四烯酸代谢产物前列腺素(prosta glandin,PG)E2与PGI2及氧分压低的作用[10]。新生儿较胎儿期氧分压突然增加,抑制平滑肌钾离子通道,导致钙离子流入,引起动脉导管管壁平滑肌的收缩导致管壁增厚、管腔闭塞。足月儿动脉导管未闭一般在出生后2d内发生完全性功能性关闭[10]。而早产儿动脉导管平滑肌发育不良,同时其平滑肌对氧分压的反应较成熟儿敏感性低,总之,胎龄越小,体质量越低,动脉导管未闭发生率越高[11]。本研究中早产儿动脉导管早期未自然关闭率为21.8%(24/110),与国内外的相关报道一致[2,11]。
早产儿动脉导管发生率高,但目前国内外尚未见超声参数预测早产儿动脉导管早期自然关闭的相关文献报道。通过本研究发现,早产儿LA/AO比值动脉导管未闭组大于对照组,差异有统计学意义(P<0.01)。究其原因与动脉导管未闭的血流动力学改变有关,动脉导管未闭引起的病理生理学改变主要是通过导管引起的分流,分流量的大小与导管的内径及主、肺动脉的压差有关。由于主动脉在收缩期和舒张期的压力均超过肺动脉压,因而有连续不断的左向右分流的血液通过未闭动脉导管,使肺循环及左心房、左心室、升主动脉的血流量增加,左心负荷加重,导致左心房扩大[12]。动脉导管未闭组经动脉导管分流量大,导致左心负荷加重,从而导致左心房增大,故LA/AO值大于对照组。反之,LA/AO值越大,早期自然关闭的可能性越小。同时发现分流束最细处的宽度动脉导管未闭组明显大于对照组,差异有统计学意义(P<0.01)。可能原因有两方面,一方面由于动脉导管未闭组动脉导管管壁平滑肌发育不良情况较对照更明显导致动脉导管内径更宽,故动脉导管管壁收缩力较差[11],从而导致早期自然关闭的可能性降低;另一方面由于动脉导管内径越宽,左向右分流量就越大,这也导致自然关闭的可能性降低。此外,本研究发现,动脉导管未闭组导管最大分流速度低于对照组,差异有统计学意义(P<0.05),原因在于动脉导管的自然关闭与导管的粗细有关,根据流体力学的原理推测,导管越粗,两端压力差越小,分流流速越低,反之分流流速越快。当肺动脉压下降后,分流束通过收缩的导管受压将产生一个左向右的快速分流束,这标志导管正处于关闭状态,故对照组分流速高于动脉导管未闭组。此外,在本研究中通过绘制ROC曲线得出LA/AO、导管最细处宽度及最大分流速度的最佳临界点分别为1.32mm、2.56mm及185.5cm/s。并得出相应的灵敏度、特异度,并测算出阳性似然比、阴性似然比。其中分流束最细处的宽度的灵敏度、特异度、阳性似然比及阴性似然比的试验指标最为理想,对临床具有重要的指导意义。若通过超声预测动脉导管自然关闭的可能性很小,临床医师将需采取干预措施[13]。
综上所述,超声心动图参数对预测早产儿动脉导管未闭早期能否自然关闭具有重要的参考价值。
[1] Goldenberg RL,Culhane JF,Iams JD,et al.Epidemiology and causes of preterm birth[J].Lancet,2008,371(966):75-84.
[2] Aranda JV,Clyman R,Cox B,et al.A randomized,Double-Blind,Placebo-Controlled trial on intravenous ibuprofen L-Lysine for the early closure of nonsymptomatic patent ductus arteriosus within 72hours of birth in extremely Low-Birth-Weight infants[J].Am J Perinatol,2009,26(3):235-245.
[3] Sehgal A,Mcnamara PJ.The ductus arteriosus:a refined approach[J].Semin Perinatol,2012,36(2):105-113.
[4] Evans N.Diagnosis of tile pretern patent ductus arteriosus:clinical signs,biomarkers,or ultrasound[J].Semin Perinatol,2012,36(2):114-122.
[5] Gournay V.The ductus arteriosus:Physiology,regulation,and functional and congenital anomalies[J].Arch Cardiovasc Dis,2011,104(11):578-585.
[6] Vieux R,Desandes R,Boubred F,et al.Ibuprofen in very preterm infants impairs renal function for the first month of Life[J].Pediatr Nephrol,2010,25(2):267-274.
[7] Hamrick SE,Hansmann G.Patent ductus arteriosus of the preterm infant[J].Pediatrics,2010,125(5):1020-1030.
[8] 陈佳,李秋平,张幸,等.早产儿动脉导管未闭高危因素分析[J].中国新生儿科杂志,2012,27(6):377-381.
[9] Hajj H,Dagle JM.Genetics of patent ductus arteriosus susceptibility and treatment[J].Semin Perinatol,2012,36(2):98-104.
[10] Obladen M.History of the ductus arteriosus:1.Anatomy and spontaneous closure[J].Neonatology,2011,99(2):83-89.
[11] Kluckow M.Oral ibupmfen and the patent ductus arteriosus:a new approach to an old problem[J].J Pediatr(Rio J),2013,89(1):4-5.
[12] 纪东露.经胸超声心动图在特发性肺动脉高压诊断中的临床价值[J].中国医药导报,2013,10(10):101-103.
[13] Ethington PN,Smith PB,Katakam LA,et al.Treatment of patent ductus arteriosus with bidirectional flow in neonates[J].Early Hum Dev,2011,87(5):381-384.
