肌动蛋白重构蛋白对瘢痕成纤维细胞增殖和分化的影响*
2015-03-12贾小丽官菊梅
贾小丽,高 锋,官菊梅
(1.四川中医药高等专科学校附属医院皮肤科,四川绵阳621000;2.成都中医药大学基础医学院,成都610075)
瘢痕是创伤修复的必然结果,组织的异常修复可形成病理性瘢痕,不但影响美容,且常有瘙痒、刺痛等症状[1],但其发病机制至今仍是医学需突破的难题。有研究显示,病理性瘢痕与成纤维细胞密不可分,细胞外基质的过度沉积与真皮成纤维细胞的异常增殖被认为是病理性瘢痕的两大特点[2];肌动蛋白重构蛋白(flightlessⅠ,FliⅠ)是创伤愈合一个重要调节因子,可以抑制细胞的增殖和移动[3],尤其对成纤维细胞和角质形成细胞的作用明显。因此,本实验选择成纤维细胞为研究对象,采用小分子RNA片段干扰和FliⅠ表达质粒转染技术研究FliⅠ对瘢痕成纤维细胞增殖和分化的影响。
1 材料与方法
1.1 一般资料 2012年1月至2014年1月于四川中医药高等专科学校附属医院行手术切除的12例住院患者的增生性瘢痕组织,年龄18~46岁,男女不限。患者发病时间均大于半年,突出于皮肤并发红,质硬,高出正常皮面1cm左右,病变部超过原损伤创面,局部皮肤无感染和溃疡;皮肤损伤局部感染、皮肤肿瘤、高血压、糖尿病等基础性疾病则排除取材[4]。取材部位无破损、感染,取材前未行特殊治疗,患者均已知情同意并签署了知情同意书[5]。
1.2 试剂 DMEM培养基(美国Gibco公司)、类标准胎牛血清(兰州民海);0.5%Ⅰ型胶原酶(Biosharp公司);EDTA螯合剂(杭州吉诺生物医药有限公司);WST-1(美国Sigma公司);Lipofectamine 2000(美国卡尔斯巴德英杰公司);FliⅠsiRNA(靶序列为5′-GCU GGA ACA CUU GUC UGU GTT-3′,广州复能基因公司);COL-1引物(上游序列5′-CCA GTG TCC ATG TCG CAG A-3′,下游序列5′-TGA GCC AGC AGA TTG AGA AC-3′);兔多克隆抗胶原(Gilbertsville,PA);鼠单克隆抗FliⅠ抗体(CA,USA);ECL Plus Western blot检测系统(GE Healthcare公司,美国);SYBR®Premix Ex TaqTMⅡ试剂盒);Opti-MEMⅠ减血清培养基、TRIzol试剂(Invitrogen公司,美国)。
1.3 仪器 CP124S电子分析天平(Sartorius);二氧化碳细胞培养箱(日本Sanyo公司);酶标定量测定仪(Thermo Multiskan AsCant公司);超净工作台(苏州安泰公司);超声破碎仪Uibra-cel(SONICS);Image Pro-Plus program(Media Cybernetics Inc,Maryland,USA);PCR凝胶成像系统(美国Transillmination公司);灰度分析软件(美国公立卫生研究院);Gene Amp PCR System 9700基因扩增仪(Applied Biosystems公司)。
1.4 人瘢痕成纤维细胞的分离与培养 将标本在无菌培养皿内PBS冲洗2~3次,剥离表皮及皮下脂肪组织,保留中间瘢痕组织,在含少量DMEM培养基的玻瓶中将瘢痕剪成1mm2碎块,加入10mL的0.5%Ⅰ型胶原酶消化,置于37℃孵箱消化3~4h,分离表皮和真皮,以PBS冲洗2~3次,Ⅰ型胶原酶再次消化1h,期间每隔20min吹打1次,1 000r/min离心5min,弃上清,加入含200U/mL双抗的完全DMEM培养基,吹打使细胞悬浮,再次1 000r/min离心5min,加入完全培养基使细胞重悬,使用吸管反复轻轻吹打2min后,经200目筛网过滤除去大块组织,将细胞接种于培养瓶中,37℃、5%CO2培养箱中孵育,24h后换液,弃去未贴壁细胞,加入完全培养基继续培养,细胞覆盖至瓶底80%即可传代,选取4~6代细胞进行实验。
1.5 FliⅠsiRNA的转染 将细胞密度调整为1×105,接种于6孔板中,细胞铺板36h后用于转染,在室温下FliⅠsiRNA(250μL;优化,以最终浓度为100nmol/L)与250μL Lipo fectamine 2000在低血清培养基(Invitrogen公司)中温育20 min,每孔加入4μL Lipofectamine 2000复合物,混合,孵育6h后换液,以含10%胎牛血清的DMEM培养基继续孵育。
1.5.1 WST-1法检测细胞增殖 将实验分为空白组、Lipo2000组、FLiⅠsiRNA组、FLiⅠcDNA组,取对数期的细胞以1×105/孔接种于96孔板中,置入37℃培养箱中孵育。24 h后按上述实验分组进行处理,每组设6个复孔,细胞接种后,分别检测在0、12、24、48h细胞增殖情况,37℃培养箱孵育4h后用酶标仪测定吸光度(A)值,测量波长450nm,记录结果。
1.5.2 RT-PCR检测FliⅠ、COL-1mRNA的表达 以TRIzol法提取成纤维细胞总RNA,使用SYBR®Premix Ex TaqTMⅡ试剂盒进行实时荧光定量PCR反应,以mRNA为模板,Random为引物,1μg RNA逆转录酶合成cDNA,cDNA连同特异性引物的最终浓度为1×SYBR Green,1×Amplitaq PCR buffer,3mmol/L MgCl2,dNTPs(200μmol/L),引物0.9 μmol(上游和下游),25μL H2O中AmpliTaq Gold DNA聚合酶1.25单位,内参NADPH的反应体系和条件同上。分别计算FliⅠ、COL-1与内参基因拷贝数的比值来反映目的基因的表达强度。
1.5.3 Westem blot法检测FliⅠ、COL-1蛋白的表达 将收集的细胞加入50mmol/L裂解液(Tris pH=7.5,1mmol/L EDTA中,50mmol/L NaCl,0.5%Triton-X-100),持续振摇30 min,离心,将上清转入4℃的离心管,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上样50μL,电泳后转移至硝酸纤维素滤膜,脱脂,根据分子量分开后分别加一抗(FliⅠ、COL-1稀释比例)及内参抗体(β-actin,1∶3 000)室温孵育2h,HRP标记二抗孵育1h后,ECL发光液发光后X光片曝光,各步骤之间样品清洗3次,扫描记录结果,Gel-analyze分析软件分析条带灰度,进行半量比较分析,以目的基因的条带灰度与内参β-actin的灰度比值表示蛋白的表达水平。
1.6 统计学处理 采用SPSS17.0软件对数据进行分析,计量资料以±s表示,各组间比较采用单因素方差分析,对于不是正态分布的数据,采用Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
2 结果
2.1 WST-1法检测细胞增殖 转染后48h,各组成纤维细胞平均A值分别为:空白组0.934±0.153,Lipo2000组0.910±0.084,FliⅠsiRNA组1.330±0.216,FliⅠcDNA组0.607±0.042,FliⅠsiRNA组细胞增殖水平明显高于其他3组(P<0.05);FliⅠcDNA组细胞增殖水平明显低于其他3组(P<0.05)。见表1。
表1 WST-1法检测瘢痕成纤维细胞活力(±s,n=6)

表1 WST-1法检测瘢痕成纤维细胞活力(±s,n=6)
a:P<0.05,与空白组比较;b:P<0.05,与Lipo2000组比较。
组别0.153 Lipo2000组 0.534±0.085 0.589±0.074 0.687±0.089 0.910±0.084 FliⅠsiRNA组 0.493±0.023 0.542±0.038 0.716±0.057 ab 1.330±0.216 ab FliⅠcDNA组 0.479±0.087 0.583±0.114 0.546±0.063 0.607±0.042 0h 12h 24h 48h空白组 0.512±0.104 0.609±0.063 0.699±0.141 0.934±ab
2.2 转染后瘢痕成纤维细胞FliⅠ、COL-1mRNA的表达RT-PCR检测结果显示,各组内参GAPDH mRNA扩增条带亮度强弱差异无统计学意义(P>0.05)。以与GAPDH同比例的模板量加入,各组FliⅠmRNA与COL-1mRNA的扩增条带亮度具有明显差异,与空白组比较,FLiⅠsiRNA组FliⅠmRNA、COL-1mRNA表达显著减弱,FLiⅠcDNA组FliⅠmRNA、COL-1mRNA表达明显增强。用Image J软件进行灰度分析,以空白组的亮度为基础标准。结果显示,FliⅠsiRNA组的FliⅠ与COL-1扩增产物条带相对灰度值分别降低至0.194±0.023和0.316±0.176,且均低于其他3组,差异有统计学意义(P<0.01);而FLiⅠcDNA组的FliⅠ与COL-1扩增产物条带相对灰度值分别升高至7.846±1.075和9.842±1.659,均高于其他3组,差异有统计学意义(P<0.01)。见表2,图1。
表2 RT-PCR检测瘢痕成纤维细胞FliⅠmRNA、COL-1mRNA的相对表达情况(±s)

表2 RT-PCR检测瘢痕成纤维细胞FliⅠmRNA、COL-1mRNA的相对表达情况(±s)
a:P<0.01,与空白组比较;b:P<0.01,与Lipo2000组比较。
组别 FliⅠ2.931±0.514 4.872±0.937转染Lipo2000组 2.524±0.742 4.167±1.130 FLiI siRNA组 0.194±0.023ab 0.316±0.176ab FLiI cDNA组 7.846±1.075ab 9.842±1.659 COL-1空白组ab

图1 FliⅠmRNA、COL-1mRNA的表达
表3 Western blot法检测瘢痕成纤维细胞FliⅠ、COL-1蛋白的相对表达情况(±s)

表3 Western blot法检测瘢痕成纤维细胞FliⅠ、COL-1蛋白的相对表达情况(±s)
a:P<0.05,b:P<0.01,与空白组比较;c:P<0.05,d:P<0.01,与Lipo2000组比较。
组别 FliⅠ0.731±0.043 0.675±0.255转染Lipo2000组 0.694±0.093 0.590±0.124 FLiI siRNA组 0.153±0.075bd 0.216±0.030bd FLiI cDNA组 1.341±0.248ac 1.142±0.391 COL-1空白组ac
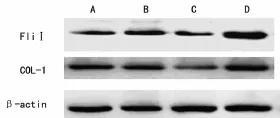
图2 FliⅠ、COL-1蛋白的表达
2.3 转染后瘢痕成纤维细胞FliⅠ、COL-1蛋白的表达Western blot检测结果显示,与空白组及Lipo2000组比较,FLiⅠsiRNA组的成纤维细胞中FliⅠ、COL-1蛋白表达显著减弱(P<0.05,P<0.01),FLiⅠcDNA组细胞中FliⅠ、COL-1蛋白表达显著增强(P<0.05,P<0.01)。见表3,图2。
3 讨论
损伤修复是高度动态的过程,需要细胞因子和蛋白质之间复杂的相互作用,肌动蛋白细胞骨架的参与是这一过程至关重要的部分。瘢痕是创伤愈合领域的常见病、多发病[3],因其破坏正常皮肤的完整性,影响美观,并伴瘙痒、疼痛等不适及继发挛缩导致表皮器官和关节畸形改变,影响功能和生活质量,给患者及家属带来严重的心理负担[6]。因此,探索瘢痕的发病机制及治疗方法具有重要的意义。瘢痕是全层缺损的创面修复过程中成纤维细胞、细胞外基质及细胞因子等相互调节失衡的结果,其主要表现为是成纤维大量增殖,细胞外基质过度沉积及细胞因子分泌失常,胶原超常合成沉积与降解减少[7]。研究表明,FliⅠ是创伤修复的重要介质,能抑制成纤维细胞的增殖和活力,在FliⅠ基因低表达的杂交小鼠中损伤修复增强,而FliⅠ基因高表达的小鼠损伤修复显著降低[8]。FliⅠ首次被定义为果蝇不规则的肌动蛋白组织和有缺陷的飞行肌的基因突变造成的[9],与人类同源的FliⅠ基因有直接关系[10],此蛋白能大大影响创伤愈合过程中细胞的增殖。研究发现,FliⅠ在小鼠体内和体外的成纤维细胞中均有发现,并且在体外能连接断裂的纤丝状肌动蛋白,因此FliⅠ对组织修复的细胞机制具有重要的生物学意义[11]。课题组前期研究表明,创面愈合FliⅠ主要表达于皮肤真皮成纤维细胞核中,随着创面逐渐愈合其表达开始减弱。Ⅰ型胶原蛋白是一种重要的基质蛋白,是瘢痕组织中胶原纤维的主要成分,是损伤产生的主要形式,参与组织纤维化和瘢痕的形成,其表达对创伤后瘢痕的形成具有重要的影响[12],且FliⅠ对COL-1的调控可能具有重要的意义[13]。
正常情况下,伤口内的胶原合成与分解呈动态平衡,在某些情况下,这种平衡被打破,导致成纤维、肌纤维母细胞合成胶原增多,而胶原纤维分解减少,胶原合成速度远大于胶原分解,最终导致了胶原沉积,从而形成瘢痕组织[14]。研究证实,FliⅠ涉及细胞的增殖和迁移,并且过程中可能通过其肌动蛋白切断功能产生负调节。本研究将小分子RNA片段和FliⅠ过表达质粒转染到培养的瘢痕成纤维细胞中,转染后48h,通过WST-1法检测发现瘢痕成纤维细胞FliⅠ沉默后,其增殖水平明显高于其他3组(P<0.05);而FliⅠcDNA组成纤维细胞增殖水平显著降低(P<0.05),说明FliⅠ缺陷能显著刺激创伤愈合过程中瘢痕成纤维细胞的增殖和活力,而FliⅠ高表达则能抑制细胞增殖,推测FliⅠ的水平在瘢痕的形成过程中具有重要作用。FliⅠ在瘢痕中的表达水平低于正常组织中的表达,成纤维细胞的主要生物学功能是合成和分泌胶原,皮肤的细胞外基质主要是Ⅰ型和Ⅲ型前胶原,在组织结构支撑中发挥重要作用,其中Ⅰ型前胶原抗张力性强,是创面早期瘢痕愈合的主要胶原类物质,其组织含量高可导致皮肤瘢痕僵硬[4]。本研究利用半定量RT-PCR检测病理性瘢痕组织中FliⅠmRNA和COL-1mRNA的表达情况,发现FLiI siRNA组FliⅠmRNA、COL-1mRNA表达较其他3组显著减弱,FLiⅠcDNA组FliⅠmRNA、COL-1mRNA表达较其他3组增强,FliⅠ缺失直接导致FliⅠ、COL-1mRNA及蛋白表达水平下降,说明FliⅠ的高表达能促进COL-1mRNA及蛋白的表达,COL-1酶的合成增加使细胞外基质-胶原的分泌减少,从而抑制病理性瘢痕组织的形成。提示转染的1型胶原基因核酶可抑制成纤维细胞合成胶原酶,导致瘢痕中胶原含量增加,产生病理性瘢痕组织。
病理性瘢痕组织中FliⅠ表达极低,低浓度的FliⅠ刺激成纤维细胞增殖,使成纤维细胞数量增加,胶原酶合成减少导致胶原等细胞外基质的分泌增加,细胞外基质沉积也增多,可能是病理性瘢痕形成的机制之一。因此,采用基因逆转录的方法得到FliⅠcDNA基因并与质粒或病毒等基因载体整合,转移至瘢痕成纤维细胞中,经过筛选、培养,得到FliⅠcDNA的克隆株,采用基因治疗为临床治愈瘢痕提供参考。
[1] 陈振雨,魏爱华,张维娜,等.病理性瘢痕组织iNOS和5-HT表达及与其增生和痛痒的关系[J].青岛大学医学院学报,2006,42(3):231-234
[2] 张曦.角质形成细胞源性蛋白因子在增生性瘢痕形成中的作用研究[D].西安:第四军医大学,2008.
[3] Kopecki,Z,Cowin AJ.FlightlessⅠ:an actin-remodelling protein and an important negative regulator of wound repair[J].Int J Biochem Cell Biol,2008,40(8):1415-1419.
[4] 刘宝珩.mac调节增生性瘢痕成纤维细胞的凋亡[D].西安:第三军医大学,2013.
[5] 林伟华,李叶扬,米兰,等.整合素连接激酶对瘢痕成纤维细胞增殖和分化的影响[J].中华整形外科杂志,2014,30(1):45-49.
[6] 周孝亮.粉防己碱对兔耳瘢痕增生组织I、III型胶原及转化生长因子-β1基因表达的调控作用[D].南昌:南昌大学,2012.
[7] 姜笃银,付小兵,盛志勇.瘢痕组织愈合中成纤维细胞凋亡抗性及其临床意义[J].中华外科杂志,2006,56(7):496-498.
[8] Adams DH.Gender specific effects on the actin-remodelling protein FlightlessⅠand TGF-1contribute to impaired wound healing in aged skin[J].Int J Biochem Cell Biol,2008,40(8):1555-1569.
[9] Campbell HD,Schimansky T,Claudianos C,et al.(1993).The Drosophilamelanogaster flightless-Ⅰgene involved in gastrulation and muscledegeneration encodes gelsolin-like and leucine-rich repeatdomains and is conserved in Caenorhabditis elegans and humans[J].Proc Natl Acad Sci USA,1993,90(23),11386-11390.
[10] Campbell HD,Fountain S,Young IG,et al.Genomic structure,evolution,and expression of human FLⅡ,agelsolin and leucine-richrepeatfamily member:overlap with LLGL[J].Genomics,1997,42(1):46-54.
[11] Davy DA,Ball EE,Matthaei KI,et al.The flightlessⅠprotein localizes to actin-based structures during embryonic development[J].Immunol Cell Biol,2000,78(4):423-429.
[12] Gowin AJ,Adams DH,Strudwick XL,et al.FlightlessⅠdeficiency enhances wound repair by increasing cell migration and proliferation[J].J Pathol,2007,211(5):572-581.
[13] Adams DH,Strudwick XL,Kopecki Z,et al.Gender specific effects on the actin-remodelling protein FlightlessⅠand TGF-beta1contribute to impaired wound healing in aged skin[J].Int J Biochem Cell Biol,2008,40(8):1555-1569.
[14] 闫贵春,裴银辉.瘢痕发生机制研究进展[J].中国美容医学,2010,19(8):1251-1255.
