内质网应激与氧化应激在百草枯致大鼠肺纤维化中的作用*
2015-03-05彭礼波董瑶瑶张志坚
彭礼波,董瑶瑶,张志坚
(重庆市巴南区人民医院重症医学科 401320)
研究表明,氧化应激、ATP耗竭及细胞内钙稳态失衡是百草枯(paraquat,PQ)中毒后脏器损伤的主要机制之一,也是常见的诱发内质网应激(endoplasmic reticulum stress,ERS)的因素[1-3]。适度的ERS有利于组织细胞恢复内环境稳态和维持细胞正常生理功能,但持续或过强的ERS则会导致组织细胞的损伤[4]。PQ 进入细胞后会引起强烈的氧化应激,因此认为PQ 可能通过氧化应激诱导ERS而在肺纤维化形成环节中发挥一定的作用。本研究旨在探讨ERS在PQ 中毒后肺纤维化形成中的作用,为PQ 中毒后肺纤维治疗提供实验依据。
1 材料与方法
1.1 主要试剂 20%百草枯溶液由上海先正达公司提供;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxidedismutase,SOD)及考马斯亮蓝试剂盒购于南京建成生物工程研究所。兔抗大鼠多克隆葡萄糖调节蛋白质78(glucose regulating protein 78,GRP78)抗体、免疫组织化学SABC 试剂盒及DAB显色剂均购于武汉博士德公司。
1.2 百草枯诱导肺损伤模型的建立及动物分组 40只清洁级sprague-dawley(SD)大鼠,体质量(220±40)g,雌雄各半。将实验动物按随机数字表法分组。对照组(n=8):给予生理盐水1mL一次性灌胃;PQ 染毒组(n=32):将20%PQ 溶液按50mg/kg用生理盐水稀释,给予1mL一次性灌胃建立中毒模型,灌胃后按不同时间分为4个亚组,每组8只大鼠。染毒组分别于灌胃后1、7、14、21d腹腔注射戊巴比妥钠(30mg/kg)麻醉,腹主动脉放血处死,取肺组织进行相应处理后备用;对照组于21d作同样处理。
1.3 肺组织标本采集 按预定时间点处死动物。分离主支气管并向下剥离后取出全肺,无菌生理盐水冲洗,滤纸吸干。取右肺中叶10%中性甲醛溶液固定48h后转移至0.1 mol/L PBS溶液中保存,待行肺组织病理学形态及免疫组织化学检测。左肺中叶取下后-80 ℃保存,待测SOD 及MDA。
1.4 肺组织GRP78蛋白免疫组织化学检测 常规切片脱蜡水化,3%H2O2处理,微波修复抗原,滴加兔抗大鼠GRP78多克隆抗体(浓度5%),4 ℃过夜后加生物素化羊抗兔IgG,在37 ℃孵育30 min,加SABC 工作液,DAB 显色,苏木素染色。阴性对照以PBS缓冲液代替一抗。每个样本随机抽取5个视野高倍镜下观察,以细胞质黄染的细胞作为GRP78阳性表达的细胞,计算出阳性表达细胞占细胞总数的百分比。阳性细胞百分率=(阳性细胞数/细胞总数)×100%。
1.5 肺组织MDA 水平及SOD 活性检测 肺组织MDA 水平及SOD 活性测定按试剂盒说明书采用比色法进行检测。
1.6 统计学处理 采用SPSS16.0软件进行数据分析,计量资料以±s表示,多组间均数比较采用单因素方差法,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 肺组织MDA 水平及SOD 活性变化 与对照组比较,染毒组MDA 水平随时间推移逐渐增加,各时间点均明显高于对照组(均P<0.05)。而SOD 活性较对照组明显降低(P<0.05,P<0.01)。见表1。
2.2 肺组织GRP78蛋白免疫组织化学结果及半定量分析 与对照组比较,染毒组1d 肺组织GRP78 表达量明显增加(P<0.01)。染毒后7d达高峰,14d明显下降,21d时与对照组无统计学差异(P>0.05)。见表1、图1。
表1 不同时间点大鼠肺组织内MDA、SOD 及GRP78 蛋白表达变化比较(±s,n=8)
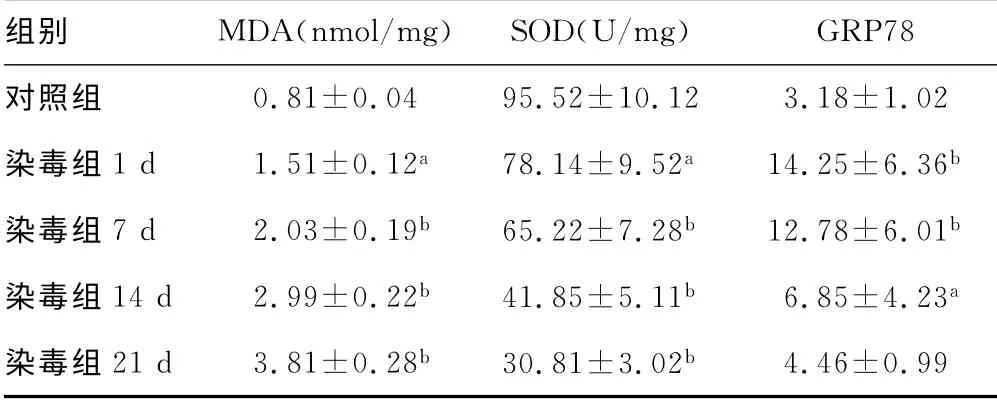
表1 不同时间点大鼠肺组织内MDA、SOD 及GRP78 蛋白表达变化比较(±s,n=8)
a:P<0.05,b:P<0.01,与对照组比较。
组别 MDA(nmol/mg) SOD(U/mg)GRP78对照组0.81±0.04 95.52±10.12 3.18±1.02染毒组1d 1.51±0.12a 78.14±9.52a 14.25±6.36b染毒组7d 2.03±0.19b 65.22±7.28b 12.78±6.01b染毒组14d 2.99±0.22b 41.85±5.11b 6.85±4.23a染毒组21d 3.81±0.28b 30.81±3.02b 4.46±0.99

图1 两组大鼠肺组织GRP78表达情况(免疫组织化学×400)
2.3 肺组织形态学变色 HE 染色光镜下对照组肺泡结构清晰,肺泡壁薄,肺泡间隔正常,肺泡腔内无炎性细胞浸润。染毒组21d肺组织内出现炎性细胞浸润,肺泡壁断裂,严重时出现弥漫性肺出血。见图2A、B。Masson染色见对照组肺泡结构正常,染毒组21d可见蓝染的胶原纤维,随时间延长,蓝染胶原纤维逐渐增多。见图2C、D。

图2 肺组织病理切片(×200)
3 讨 论
大量基础研究表明氧化应激是肺纤维化的重要发病机制之一,特别在PQ 中毒中该机制占有更加重要的作用,因此减轻PQ 中毒后氧化应激、纠正机体氧化-抗氧化失衡可明显减轻肺纤维化程度[5-8]。SOD 是机体内最主要的氧自由基清除酶,测定其活力可反应机体自由基清除能力;MDA 则是脂质过氧化产物,测定其含量可反映机体组织细胞氧化损伤的程度,对上述指标的联合检测能评价组织细胞的氧化应激水平。本研究中发现,染毒组大鼠肺组织MDA 较对照组明显升高,而SOD 则明显降低,病理切片提示肺组织受损程度随时间推移逐渐加重,说明氧化应激在PQ 中毒肺损伤中占重要地位。
内质网是哺乳动物细胞重要的Ca2+贮存器,也是蛋白质合成与翻译后修饰、多肽链正确折叠与装配、参与脂质代谢和类固醇激素合成的重要场所。研究发现,多种因素可导致内质网稳态破坏。而内质网能通过减少蛋白质翻译、分子伴侣以及相关蛋白表达上调,增加未折叠蛋白质降解等途径力图使内质网恢复稳态,这些变化统称ERS[9-10]。GRP78 是广泛分布于内质网的分子伴侣,其主要功能是协助蛋白质的折叠、装配及运输。当应激因素导致ERS 发生后,GRP78 合成显著增加,因此又称其为ERS发生的标志性蛋白[11]。越来越多的研究表明ERS参与了很多中毒相关性疾病的发生发展,如有机磷农药、重金属、乙醇及某些药物等[12-15]。近年研究表明氧化应激是ERS的重要诱因,ROS是触发ERS介导凋亡通路的上游因子。本研究结果表明染毒组大鼠肺组织中ERS标志性蛋白GRP78表达显著增加,随时间延长而逐渐增加。结果表明PQ中毒导致肺纤维化中除了氧化应激作用外,还有ERS参与,其机制可能是PQ 进入细胞后激活ROS级联反应,机体释放大量ROS,从而诱发ERS发生。但其具体机制尚需进一步研究。
[1] Klass O,Fischer UM,Antonyan A,et al.Pneumocyte apoptosis induction during cardiopulmonary bypass:effective prevention by radical scavenging using n-acetylcys-twine[J].J Invest Surg,2007,20(6):349-356.
[2] 马涛,韩璐,胡文全.内质网应激凋亡信号途径在脓毒症脾淋巴细胞凋亡中的作用研究[J].中国危重病急救医学,2009,21(1):48-50,后插二.
[3] 曹钰,董玉龙,姚尧,等.急性百草枯中毒所致急性肺损伤机制研究[J].中国呼吸与危重监护杂志,2005,4(4):303-305.
[4] Xu C,Bailly-Maitre B,Reed JC.Endoplasmic reticulum stress:cell Life and death decisions[J].J Clin Invest,2005,115(10):2656-2664.
[5] Dinis-Oliveira RJ,Duarte JA,Sánchez-Navarro A,et al.Paraquat poisonings:mechanisms of lung toxicity,clinical features,and treatment[J].Crit Rev Toxicol,2008,38(1):13-71.
[6] Li SG,Crooks PA,Wei SC,et al.Toxicity of dipyridyl compounds and related compounds[J].Crit Rev Toxicol,2004,34(5):447-460.
[7] 周从阳,谢姝,罗雅娟,等.百草枯中毒大鼠肺组织中的4-羟基壬烯醛表达和乌司他丁的影响[J].中华劳动卫生职业病杂志,2012,30(6):457-459.
[8] 贺晓艳,赵光举,卢中秋,等.急性百草枯中毒大鼠氧化应激水平及二巯丙磺钠的作用[J].中华劳动卫生职业病杂志,2009,27(8):476-479.
[9] Zhang CB,Wang GH,Zheng Z,et al.Endoplasmic reticulum-tethered transcription factor cAMP responsive element-binding protein,hepatocyte specific,regulates hepatic lipogenesis,fatty acid oxidation,and lipolysis upon metabolic stress in mice[J].Hepatology,2012,55(4):1070-1082.
[10] Satoh T,Abiru N,Kobayashi M,et al.CHOP deletion does not impact the development of diabetes but suppresses the early production of insulin autoantibody in the NOD mouse[J].Apoptosis,2011,16(4):438-448.
[11] Inokuchi Y,Nakajima Y,Shimazawa M,et al.Effect of an inducer of Bip,a molecular chaperone,on endoplasmic reticulum(ER)stress-in-duced retinal cell death[J].Invest Ophthalmol Vis Sci,2009,50(1):334-344.
[12] 刘承芸,李薇,伍一军.敌百虫诱导SH-SY5Y 细胞凋亡的研究[J].毒理学杂志,2005,19(3):280-280.
[13] Tamm C,Sabri F,Ceccatelli S.Mitochondrial-mediated apoptosis in neural stem cells exposed to manganese[J].Toxicological Sciences,2008,101(2):310-320.
[14] 张勤丽,王芳,石樱桃,等.脂质过氧化损伤及内质网应激在铝致神经细胞凋亡中的作用机制[J].中华劳动卫生职业病杂志,2008,26(3):143-146,封3.
[15] 李婷钰,王苹,杜波,等.卡那霉素对离体培养大鼠耳蜗毛细胞损害的实验研究[J].中国老年学杂志,2010,30(1):56-58.
