盐度对长牡蛎和近江牡蛎及其杂交稚贝生长和存活的影响
2015-03-11王昭萍闫喜武李冬春张跃环霍忠明苏家齐于瑞海
姚 托,王昭萍,*,闫喜武,李冬春,张跃环,霍忠明,苏家齐,于瑞海
1 中国海洋大学教育部海水养殖重点实验室, 青岛 266001 2 大连海洋大学水产与生命学院, 辽宁省贝类良种繁殖工程技术研究中心, 大连 116023 3 中国科学院南海海洋研究所, 热带海洋生物资源与生态重点实验室, 广州 510301
盐度对长牡蛎和近江牡蛎及其杂交稚贝生长和存活的影响
姚 托1,王昭萍1,*,闫喜武2,李冬春2,张跃环3,霍忠明1,苏家齐1,于瑞海1
1 中国海洋大学教育部海水养殖重点实验室, 青岛 266001 2 大连海洋大学水产与生命学院, 辽宁省贝类良种繁殖工程技术研究中心, 大连 116023 3 中国科学院南海海洋研究所, 热带海洋生物资源与生态重点实验室, 广州 510301
2011年8月以长牡蛎自繁组GG(Crassostreagigas♀ ×C.gigas♂ ),近江牡蛎自繁组AA (C.ariakensis♀ ×C.ariakensis♂)、正交组GA(Crassostreagigas♀ ×C.ariakensis♂)、反交组 AG(C.ariakensis♀ ×C.gigas♂)为实验材料,开展了稚贝对盐度的适应性研究。结果发现长牡蛎的最适生存盐度为15—35,最适生长盐度为25—35;近江牡蛎的最适生存盐度为10—25,最适生长盐度为20—25;GA的最适生存盐度为15—30,最适生长盐度为15—30,AG的最适生存盐度为20—30,最适生长盐度为20—25。GG对低盐度敏感,AA对高盐度敏感,AG具有高盐度存活的杂种优势,在盐度30时,中亲杂种优势HG×A为13.32,单亲杂种优势HGA和HAG分别为1.89和27.88,在盐度40时,HAG上升到400,GA和AG都不具有生长优势。杂种稚贝对盐度适应介于双亲之间,且表现出一定程度的父系遗传特点。
长牡蛎; 近江牡蛎; 盐度; 杂交子; 生长; 存活
远缘杂交一般是指在分类学上物种以上分类单位的个体之间交配。不同种间、属间甚至亲缘关系更远的物种之间的杂交,可以把不同种、属的特征、特性结合起来,突破种属界限,扩大遗传变异,从而创造新的变异类型或新物种。由于远缘杂交往往重演物种的进化历程,故也是研究生物进化的重要实验手段。远缘杂交一般不易成功,即使得到子代,杂种也通常不育或夭亡,杂种后代分离范围广,时间长,中间类型不稳定[1]。远缘杂交在育种上的应用主要表现在研究物种进化,创造新物种、改良旧物种、创造和利用杂种优势等几方面[1]。
在我国,主要分布着5种巨蛎属牡蛎经济种,分别为长牡蛎Crassostreagigas、葡萄牙牡蛎C.angulata、香港巨牡蛎C.hongkongensis、近江牡蛎C.ariakensis、熊本牡蛎C.siakemea。早在1882年,学者们就对牡蛎的远缘杂交进行了研究,经过100多年的发展,发现多数牡蛎种属间的杂交组合不受精[2- 3],即使能受精也很少可以获得稚贝[4- 5]。其中,近江牡蛎和长牡蛎分别是我国南北方重要的经济贝类。长牡蛎喜好低温高盐环境,主要分布在我国北方的辽宁和山东,年产量在80万t左右[6];近江牡蛎喜好高温低盐环境,主要分布在广东、广西,年产量在20—30万t[7]。先前的研究发现,这两种生态类型截然不同的牡蛎可以正常受精并获得杂交稚贝[8- 9]。但尚未见到杂种对盐度适应性的相关报道,本文研究了盐度变化对杂交稚贝生长和存活的影响,分析了不同稚贝组间的对盐度的适应策略,比较了不同盐度下种间杂种优势变化规律,旨在对杂交稚贝的盐度适应性及其生殖隔离障碍提供理论基础,也为其不同环境条件下杂种优势的利用提供实践经验。
1 材料与方法
1.1 材料
实验在大连庄河海洋育贝类育苗场中进行,长牡蛎、近江牡蛎及其杂种子代取自于2011年7月培育的稚贝,稚贝大小为500—700 μm,杂交稚贝经过分子遗传鉴定,发现为杂种两性融合杂交子[10]。
1.2 实验设计
实验设计7个盐度梯度分别为:10、15、20、25、30、35、40。正常海水为砂滤海水并经过300目筛绢网过滤;低盐度海水由正常海水兑入自来水获得,自来水经过24 h曝气,以去除其中的有效氯,经过淀粉碘化钾检验,水中完全没有余氯成分方可使用;高盐度海水由正常海水加海水晶(山东潍坊滨海经济开发区海霸王海水晶厂)配制而成,盐度按照每小时下降或上升2的方式达到预设盐度水平,为防止盐度变化不稳定,实验在60 L大白桶中进行,每个实验桶中放稚贝300个,每组设置3个重复,定期测定稚贝的壳高和成活率。
1.3 日常管理
在培育期间使用小球藻Chlorella和湛江等鞭金藻Isochrysisgalbana(体积比=1∶1)混合投喂,每天投喂3次,投饵前将饵料调整到预置盐度;每两天全量换水1次;整个实验期间微充气,保持充足的溶氧;及时挑出死亡稚贝,以保持水质清新;实验期间的温度为24.2—27.5 ℃。
1.4 指标测定
1.4.1 成活率和相对成活率的测定
成活率(Rs)=成活个体数/初始个体数×100%
相对成活率(P)=(实际观察存活数/对照组存活数)×100%
1.4.2 杂种优势的测定
杂种优势的计算方法采用Zheng等[11- 12]:
中亲杂种优势
HG×A(%)=[(GA+AG)-(GG+AA)]×100/(GG+AA)
正交组单亲杂种优势
HGA(%)=(GA-GG) ×100/GG
反交组单亲杂种优势
HAG(%)=(AG-AA) ×100/AA
式中,G、A分别代表长牡蛎和近江牡蛎,GG、GA、AG、AA分别代表各实验组稚贝的表型值(生长、存活)。
1.4.3 平均壳高日增长率的测定
平均壳高日增率
RH(μm/d)=(H1-H0)/(t1-t0)
式中,t1和t0分别为实验结束和开始时的时间,H1和H0分别为实验结束和实验开始时的壳高。
1.4.4 适宜存活盐度和最适存活盐度的界定
以稚贝成活率稳定时的时间作为稚贝50%死亡的考察时间,以稚贝50%出现死亡的盐度(LS50)作为生存临界盐度,高低两端生存临界盐度之间的盐度范围为适宜生存盐度。临界盐度采用二点法计算,公式为:
LS50=S1+[(P1-50%)/(P1-P2)]×(S2-S1)
式中,S1、S2分别为成活率接近50%的高低端盐度,P1、P2为相应的相对成活率。把经过多重比较无明显差异的成活率最高的几个实验组所对应的盐度作为最适生存盐度[13- 14]。
1.4.5 适宜生长盐度和最适生长盐度的界定
本次研究的生长指标主要包括壳高,生长临界盐度采用曹伏君等[13- 14]为壳高日增长率最快一组增长率30%所对应的盐度,高低生长临界盐度之间的盐度范围为适宜壳高生长盐度。最适壳高生长盐度为经过多重比较无明显差异的日增长率最高的几个实验组所对应的盐度范围。
1.5 数据处理
实验数据使用SPSS19.0分析软件进行采用单因素方差分析,结合Duncan多重比较来检验不同组差异显著性,显著水平设置为P<0.05。
2 结果
2.1 盐度对稚贝成活率的影响
经过25d的培育,不同盐度梯度对不同稚贝相对成活率的影响见图1,实验进行15 d时,不同稚贝在不同盐度下的死亡率基本稳定,从图1中可以看到长牡蛎的稚贝在各个盐度梯度下的相对成活率都大于50%,说明盐度10—40是长牡蛎的适宜生存盐度,经过多重比较发现长牡蛎的最适生存盐度为15—35。
从图1中看出近江牡蛎稚贝对低盐耐受性很强,从10—30都有很好的适应性,且对低盐的适应性要高于高盐环境,对高盐环境的临界点应该介于30和35之间,经过二点法求得高盐环境的生存临界盐度32.2,所以10—32.2在其适宜生长盐度范围内,经过多重比较发现近江牡蛎的最适生存盐度范围为10—25。
通过图1发现,GA组稚贝的低端临界盐度在10和15之间,高端在30和35之间,经过二点法得出稚贝的适宜生长盐度在11.9—34.1,而GA的最适生存盐度范围为15—30。从图1中还可以看到,AG对低盐也有很强的适应性,高端临界盐度在35和40之间,并由二点法得出高端临界盐度为38,10—38在AG的适宜生长范围内,多重比较得出最适生存盐度范围为20—30。
随着环境盐度的提高盐度升到25时,HG×A、HGA和HAG的值都在增加,当盐度在25—30之间时,HG×A和HAG都为正值,在盐度35时AG的单亲杂种优势上升到353.3,具有明显的存活杂种优势。由于GA的单亲杂种优势为负值,所以中亲杂种优势是由AG的单亲杂种优势而获得(图2)。

图1 不同盐度下稚贝的相对成活率Fig.1 Relative survival rates of juveniles at different salinity
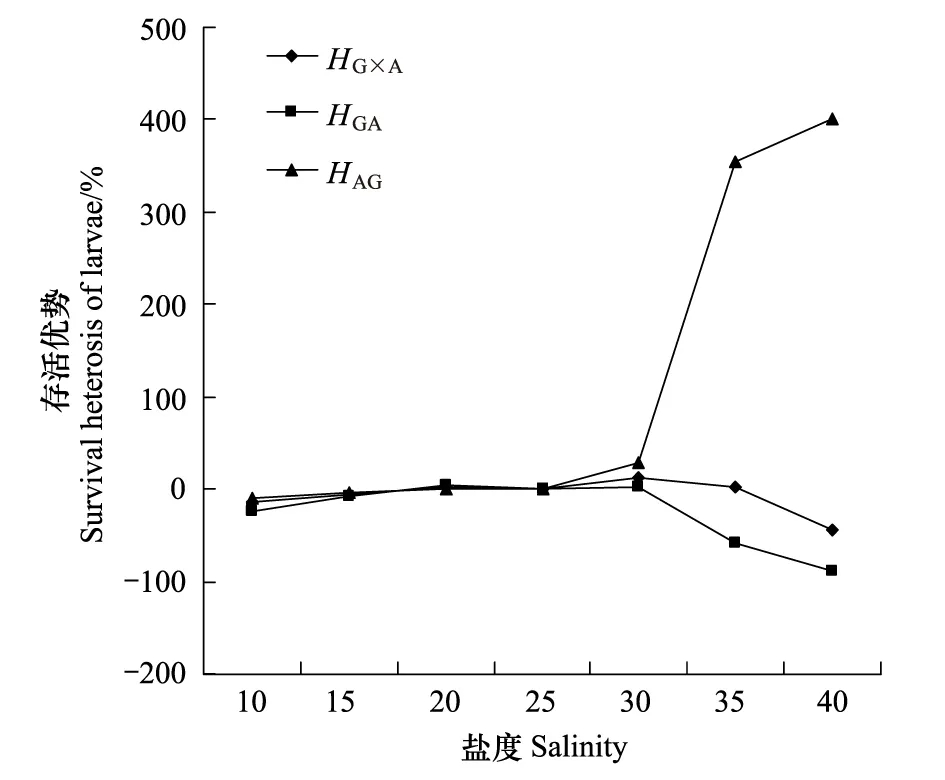
图2 不同盐度下稚贝的的存活优势Fig.2 Survival heterosis of juveniles at different salinity
2.2 盐度对不同稚贝日增长率的影响
实验统计结果如表1,不同盐度对不同稚贝的生长产生了显著的影响,但是对于任何一组稚贝而言,参照曹伏君等和栗志民等对临界生长盐度的界定(壳高日增长率最快一组增长率30%所对应的盐度),10—40都是其适宜生长盐度,经过多重比较得出长牡蛎稚贝的最适生长盐度为25—35;近江牡蛎的的最适壳高生长盐度为20—25;GA和AG的最适生长盐度分别为15—30和20—25。
2.3 盐度对稚贝生长的影响
盐度实验结束后对不同盐度的实验组的不同实验稚贝进行了壳高的测量,并对不同盐度下不同稚贝的壳高进行了多重比较,结果见图3。从图3的结果来看,在低盐范围内,相同盐度组AA与其它各组差显著;在盐度25时近江牡蛎自交苗和长牡蛎自交苗壳高差异不显著(P>0.05);在高盐范围内,长牡蛎自交苗与其它自交自交苗在壳高上差异显著(P<0.05)。杂交苗无论GA还是AG在壳高生长上基本都小于自交苗,尚未表现出杂种优势。

表1 不同盐度下稚贝的壳高日增长率Table 1 Daily growth of shell height of juveniles at different salinity
GG:长牡蛎自交组inbred group of GG;AA:为近江牡蛎自交组inbred group of AA;GA:杂交子C.gigas♀ ×C.ariakensis♂ hybrid progeny ofC.gigas♀ ×C.ariakensis♂;AG:杂交子C.ariakensis♀ ×C.gigas♂ hybrid progeny ofC.ariakensis♀ ×C.gigas♂;表中S为Salinity的缩写

图3 实验结束时不同稚贝的壳高 Fig.3 The shell height of different juveniles at the end of the experiment
3 讨论
贝类生活在海水环境中,必然受到盐度的影响。由于不同种类生活的海水环境不同,所以造成了对不同海水盐度的适应性。海水盐度与贝类的渗透压调节息息相关,一旦海水盐度的改变超过了水产动物的自身调节能力,就会造成大量死亡[15]。
通过本次实验发现太平洋在10—40的盐度范围内都具有很好的适应性,并得出长牡蛎稚贝的最适生存盐度范围为15—35,这与刘海涛等[16]的研究认为25.21—34.25是最适存活盐度有所不同,可能与选取的实验材料有关,刘海涛等选取的是大连湾牡蛎面盘幼虫,选取的是长牡蛎稚贝。2008年Wang和Guo将我国北方原来的大连湾牡蛎C.talienwhanensis及褶牡蛎C.plicatula划入长牡蛎[17]。谢忠明认为近江牡蛎属广盐性种类,适宜盐度范围为5—25,最适盐度范围10—20,对低盐有较强的抗性,但对高盐的耐受性弱,适宜栖息在河口咸淡水环境[18]。研究中发现近江牡蛎在10—30盐度范围内都能很好的生存,最适生存盐度为10—25,跟谢忠明的有所区别,没有采用低于10的盐度范围,所以造成适宜盐度的不同,最适盐度的不同可能跟所用的近江牡蛎亲本有关,本研究使用的近江牡蛎种贝已经在北方高盐海域养殖2a,这也充分说明,近江牡蛎高盐驯化后,对其盐度的适应有所变化,可以很好地适应北方的高盐环境。
GA组是并没有很好的遗传长牡蛎对盐度的适应性,只在20—30盐度范围内具有很好的适应性,尚未表现出在盐度适应性上的杂种优势。AG组则很好的继承了近江牡蛎在低盐范围的适应性,并更好的扩展了其在高盐范围内的适应性,表现了其在盐度适应性上的杂种优势。
本研究结果显示,长牡蛎稚贝的最适生长盐度为25—35,与刘海涛,董占武等[16]的结果相似。他们认为大连湾牡蛎在盐度22—36条件下胚胎发育速度较快,面盘幼虫在盐度29.1—34.25间生长较快,28.24组生长最快,逾此则生长速度和成活率均有不同程度的降低。本实验中近江牡蛎的最适生长盐度为20—25,且10—20盐度范围内的生长速度远远大于35—40盐度范围内的生长速度,与盐度30组差异不显著,这与薛凌展等[19]的研究稍有不同,他们认为16盐度组的幼虫生长最快,25盐度组次之,30盐度组最慢,究其原因可能是近江牡蛎适应了北方的养殖环境。杂交群体的日增长率方面,除GA在10盐度组的日增长率大于AG和GG,并显著小于AA外,其余各个盐度组的杂交苗增长率都小于自繁群体。通过表1发现GA的壳高日增长高峰相对于GG向低盐偏移,而AG的壳高日增长高峰相对于AA向高盐偏移,这说明经过杂交后,都对原来的生长特征产生了一定的影响,这种影响跟杂种的父本对盐度适应特征成正相关,表现出一定程度的父本效应。
从其生长上看,长牡蛎和近江牡蛎自交苗在各自适宜盐度范围内显著大于其他各组(杂交组GA和AG除在10和35两个盐度组差异显著外,在其它各盐度组差异不显著)。这与近江牡蛎C.arickensis×熊本牡蛎C.sikamea[20],长牡蛎C.gigas×香港牡蛎C.hongkngensis等[21]相似表现为一种杂种劣势现象。与2010年的研究结果[10]稍有不同,2010年发现GA具有杂种优势,结果上的不同可能与2010与2011年的养殖环境改变有关,2011年养殖用水的生态虾池中饲养了很多的海蜇,导致养殖用水黏性增高,对稚贝的生长性状产生了一定的影响。2012年8月,在作者对实验材料进行统计时,发现1龄AG的壳高仅为长牡蛎和近江牡蛎的一半大小,再次证明了AG的具有明显的杂种劣势。
总之,本文研究了盐度对长牡蛎、近江牡蛎及其杂种稚贝的生长、存活性状的影响。发现,杂种对盐度适应性介于双亲之间,而且表现出一定程度的父系遗传特点。通过杂交可以改良种质性状,但不一定表现在生长上,这为养殖生产和牡蛎种间杂交研究,牡蛎种间生殖隔离障碍机制及其杂种优势开发利用奠定了坚实的基础。
[1] 何启谦. 遗传育种学. 北京: 中央广播电视大学出版社, 1999: 292- 293.
[2] Bouchon-Brandely M. On the sexuality of the common oyster (Ostreaedulis) and that of the Portuguese oyster (O.angulata). Artificial fecundation of the Portuguese oyster. Annals and Magazine of Natural History, 1882, 10(5): 328- 330.
[3] Davis H C. On interspecific hybridization inOstrea. Science, 1950, 111(2889): 522- 522.
[4] 滕爽爽, 李琪, 李金蓉. 长牡蛎(Crassostreagigas)与熊本牡蛎(C.sikamea)杂交的受精细胞学观察及子一代的生长比较. 海洋与湖沼, 2010, 41(6): 914- 922.
[5] 郑怀平, 王迪文, 林清, 孙泽伟, 张涛, 陈兴强. 太平洋牡蛎与葡萄牙牡蛎两近缘种间杂交及其早期阶段生长与存活的杂种优势. 水产学报, 2012, 36(2): 210- 215.
[6] 张跃环, 王昭萍, 闫喜武, 虞志飞, 霍忠明, 姚托, 刘晓赫, 于瑞海. 香港巨牡蛎和长牡蛎幼虫及稚贝的表型性状. 生态学报, 2012, 32(4): 1105- 1114.
[7] Wang H Y, Guo X M, Zhang G F, Zhang F S. Classification of Jinjiang oystersCrassostrearivularis(Gould, 1861) from China, based on morphology and phylogenetic analysis. Aquaculture, 2004, 242(1/4): 137- 155.
[8] 周茂德, 高允田, 吴融. 太平洋牡蛎与近江牡蛎、褶牡蛎人工杂交的初步研究. 水产学报, 1982, 6(3): 235- 241.
[9] Allen S K Jr, Gaffney P M. Genetic confirmation of hybridization betweenCrassostreagigas(Thunberg) andCrassostrearivularis(Gould). Aquaculture, 1993, 113(4): 291- 300.
[10] 张跃环, 王昭萍, 闫喜武, 姚托, 虞志飞, 霍忠明, 于瑞海, 李晓喻, 李雅林, 郭希明. 太平洋牡蛎与近江牡蛎的种间杂交. 水产学报, 2012, 36(8): 1215- 1224.
[11] Zheng H P, Zhang G F, Guo X M, Liu X. Heterosis between two stocks of the bay scallop, Argopecten irradians irradians Lamarck (1981). Journal of Shellfish Research, 2006, 25(3): 807- 182.
[12] Zheng H P, Xu F, Zhang G F. Crosses between two subspecies of bay scallopArgopectenirradiansand heterosis for yield traits at harvest. Aquaculture Research, 2011, 42(4): 602- 612.
[13] 曹伏君, 刘志刚, 罗正杰. 海水盐度、温度对文蛤稚贝生长及存活的影响. 应用生态学报, 2009, 20(10): 2545- 2550.
[14] 栗志民, 刘志刚, 姚茹, 骆城金, 颜俊飞. 温度和盐度对皱肋文蛤幼贝存活与生长的影响. 生态学报2010, 30(13): 3406- 3413.
[15] 刘志刚, 刘建勇, 王辉, 郑云龙. 墨西哥湾扇贝稚贝盐度适应性的研究. 湛江海洋大学学报, 2006, 26(6): 12- 16.
[16] 刘海涛, 董占武, 徐志明. 盐度对大连湾牡蛎胚胎发育及幼虫生长的影响. 水产学报, 1992, 16(1): 32- 39.
[17] Wang H Y, Zhang G F, Liu X, Guo X M. Classification of common oysters from North China. Journal of Shellfish Research, 2008, 27(3): 495- 503.
[18] 谢忠明. 海水经济贝类养殖技术. 北京: 中国农业出版社, 2003: 557- 578.
[19] 薛凌展, 阙华勇, 张国范, 杨笑波, 方彰胜, 高如承. 盐度对近江牡蛎幼虫生长及存活的影响. 海洋科学, 2007, 31(9): 73- 77.
[20] Xu F, Zhang G F, Liu X, Zhang S D, Shi B, Guo X M. Laboratory hybridization betweenCrassostreaariakensisandC.sikamea. Journal of Shellfish Research, 2009, 28(3): 453- 458.
[21] Zhang Y H, Wang Z P, Yan X W, Yu R H, Kong J, Liu J, Li X Y, Li Y L, Guo X M. Laboratory hybridization between two oyster:CrassostreagigasandCrassostreahongkongensis. Journal of Shellfish Research, 2012, 31(3): 619- 625.
Effect of salinity on growth and survival ofCrassostreagigas,C.ariakensisand juvenile hybrids
YAO Tuo1, WANG Zhaoping1,*, YAN Xiwu2, LI Dongchun2, ZHANG Yuehuan3, HUO Zhongming1, SU Jiaqi1, YU Ruihai1
1KeyLaboratoryofMaricultureMinistryofEducation,FisheriesCollege,OceanUniversityofChina,Qingdao266001,China2EngineeringResearchCenterofShellfishCultureandBreedingofLiaoningProvince,CollegeofFisheriesandLifeScience,DalianOceanUniversity,Dalian116023,China3KeyLaboratoryofTropicalMarineBio-resourcesandEcology,SouthChinaSeaInstitutionofOceanology,ChineseAcademyofSciences,Guangzhou510301,China
The overall aim of distant hybridization is to obtain hybrids between varieties, species, or genera via the transfer the genome of one species to another, which results in changes in phenotypes and genotypes of the progenies. Hybridization is essentially the fusion of genotypically different sex cells and the development of a new organism that combines the hereditary character of both parents. Heterosis is often characteristic of the first generation of hybrids, as displayed by an increased capacity for adaptation and improved viability. Hybridization between different species, categories or advanced genetic relationships between species can yield various characteristics (species, category), penetrate species or category boundaries, expand genetic variation, and create new mutation types or even new species. Hybridization is also a source of hereditary variation, which is one of the main factors in evolution. Distant hybridization mimics the evolution of a species, so it is an important experimental tool in the study of evolution. Samples ofCrassostreagigasandC.ariakensiswere purchased in Dalian and Shenzhen in August 2010. They were identified as being of pure stock by molecular genetic analysis. The samples ofC.gigasandC.ariakensiswere spawned in the laboratory and crosses obtained in the same year. The effect of salinity on two hybrid progenies (GA and AG) and two inbred groups (GG and AA) was investigated during August 2011 using an experimental design incorporating seven salinities (10, 15, 20, 25, 30, 35 and 40 ppt). The experiments were carried out in 60-L white barrel-shaped tanks and performed in three replicates. To achieve the required salinity levels, the salinity was controlled and monitored every hour. In order to maintain adequate dissolved oxygen levels, the barrels were aerated slowly and any dead juvenile mollusks were removed immediately to prevent deterioration of water quality. The results showed that the optimum salinities for survival and optimal growth for the various experimental crosses were as follows: 15—35 and 10—25 ppt, respectively, for GG; 10—25 and 20—25, respectively, for AA; 15—30 and 15—30 respectively, for GA; 20—30 and 20—25, respectively, for AG. The GG inbred group was sensitive to low salinity, as were the AA inbred progeny. Heterosis was positive for the AG hybrid progeny at the higher salinity, but negative for both the GA and AG hybrids for growth as measured by shell height. The heterosis ofHG×Awas 13.32 at a salinity of 30 ppt, while the single parent heterosis ofHGAandHAGwas 1.89 and 27.88, respectively. The single parent heterosis ofHAGincreased to 400 at a salinity of 40 ppt. The adaptability of juvenile hybrid was shared between parents but showed a certain degree of paternal inheritance. This study examined the effects of various salinities on the growth and survival ofCrassostreagigas,C.ariakensisand juvenile hybrids. Through hybridization, trait-specific germplasm can be identified and traits can be improved, but not necessarily growth performance. This study has the potential to be the basis for increased aquaculture production of oysters, and to advance our knowledge of interspecies cross breeding, reproductive isolating mechanisms and heterosis utilization.
Crassostreagigas;Crassostreaariakensis; salinity; hybrid progenies; growth; survival
国家自然科学基金项目(31172403); 国家重点基础研究发展规划项目(2010CB126406)
2013- 05- 15;
日期:2014- 04- 17
10.5846/stxb201305151066
*通讯作者Corresponding author.E-mail: zpwang@ouc.edu.cn
姚托,王昭萍,闫喜武,李冬春,张跃环,霍忠明,苏家齐,于瑞海.盐度对长牡蛎和近江牡蛎及其杂交稚贝生长和存活的影响.生态学报,2015,35(5):1581- 1586.
Yao T, Wang Z P, Yan X W, Li D C, Zhang Y H, Huo Z M, Su J Q, Yu R H.Effect of salinity on growth and survival ofCrassostreagigas,C.ariakensisand juvenile hybrids.Acta Ecologica Sinica,2015,35(5):1581- 1586.
