红阳猕猴桃叶片再生体系的建立
2015-03-11刘永胜
石 玮, 张 玲, 刘永胜
(合肥工业大学 生物与食品工程学院,安徽 合肥 230009)
0 引 言
猕猴桃又称丰桃、杨桃、奇异果等[1],属雌雄异株植物,倍性复杂,雌雄株间花期不遇,致使种间杂交困难,育种周期长。而利用扦插、嫁接的方法,成活率较低。文献[2]首次以猕猴桃茎段为材料,进行离体培养,为猕猴桃组织培养的研究揭开了序幕。目前,世界上猕猴桃生产大国的猕猴桃主要来源于组织培养[3]。通过器官再生和胚胎发育可对不同的猕猴桃亚种进行再生研究,再生结果在不同种属、品种、性别和外植体类型间存在差异[4]。
红阳猕猴桃是一种新的红肉猕猴桃,它是中国经过近20年的繁育和筛选而获得的。红阳猕猴桃鲜果横剖面沿果心有紫红色线条,呈放射状分布,似太阳光芒四射,故称“红阳猕猴桃”。其果实短圆柱形,肉质鲜嫩,果心小,果味浓,品质极佳。总糖的质量分数为13.45%,高出世界流行品种“海沃德”近5%[5]。
本试验以红阳猕猴桃组培苗的叶片为材料进行组织培养,优化不同激素组合对外植体脱分化和器官再生的影响,以期建立快速有效的繁殖体系。
1 材料与方法
1.1 试验材料与培养条件
以红阳猕猴桃组培苗28d叶龄的叶片作为初始外植体。组培苗叶片愈伤组织、不定芽的诱导培养基以MS为基本培养基,不定根的诱导以1/2MS为基本培养基。基本培养基中蔗糖质量浓度为30g/L(不定根诱导中为20g/L),琼脂质量浓度为7g/L,pH值为5.8。培养条件为光照强度2 500lx,光照时间16h/d,温度(25±1)℃。每个处理接种6瓶,每瓶接种5个外植体。分别在接种后30d或40d观察和记录愈伤组织的发生,统计不定芽及不定根的分化情况。
1.2 炼苗与移栽
挑选根多且粗壮的植株,拧松瓶盖于室内炼苗3d左右。在瓶内加入适量自来水以保持培养基的湿润,再炼苗5d后移栽至温室,遮荫、保持土壤湿润,温度控制在(25±1)℃、光照12h/d,空气湿度90%以上。移栽土壤为营养土、珍珠岩、蛭石,三者的质量比为3∶1∶1。土壤事先经高温、高压灭菌,珍珠岩和蛭石在灭菌前要用自来水冲洗干净。
2 结果与分析
2.1 调节剂对叶片愈伤组织诱导的影响
将组培苗叶片切成大小为1.0cm×1.0cm的叶盘,接种在不同植物生长调节剂组合的培养基中,调节剂对叶片愈伤组织诱导的影响见表1所列。由表1可以看出,由组培苗叶片进行愈伤组织的诱导效率比较高,可以达到100%。所产生愈伤组织的不同状态取决于所添加的生长素的种类。添加了2,4-D(2,4-二氯苯氧乙酸)的培养基上产生淡黄色或白色、质地疏松状态的愈伤组织。而IBA(吲哚丁酸)或NAA(萘乙酸)的添加则产生另一种绿色、质地致密的愈伤组织,并且还有部分叶盘也可以直接产生不定芽。愈伤组织和不定芽都主要形成于叶柄基部及叶脉处。
在添加2,4-D的培养基中,随着细胞分裂素ZT(玉米素)和BA(6-苄基腺嘌呤)质量浓度的升高,愈伤组织的诱导率都呈现先升后降的趋势。试验结果表明,最有利于疏松状态愈伤组织形成的培养基为 MS+0.5mg/L ZT+0.5mg/L 2,4-D,最有利于致密状态愈伤组织形成的培养基为 MS+3.0mg/L BA+1.0mg/L NAA。

表1 植物生长调节剂对叶片愈伤组织诱导的影响
2.2 调节剂对愈伤组织不定芽分化的影响
将诱导试验得到的淡黄色或白色愈伤组织通过MS+1.0mg/L ZT培养基进行继代培养,使之转绿并变得致密。而经诱导试验得到的绿色、质地致密的愈伤组织可直接转入愈伤组织分化不定芽的试验。选取生长良好并呈绿色致密状态的愈伤组织,切成1.0cm×1.0cm的方块,接种在不同的分化培养基上,可得调节剂对不定芽分化的影响见表2所列。
由表2可以看出,在培养基 MS+5.0mg/L BA+0.5mg/L NAA上诱导30d的愈伤组织不定芽分化率就可以达到100%,而培养基 MS+1.0mg/L ZT+0.3mg/L IAA 上诱导的不定芽分化率在40d才能达到100%,说明红阳猕猴桃愈伤组织不定芽分化中BA的作用优于ZT,这与在阔叶猕猴桃组织培养中所报道的ZT比BA更有利于诱导不定芽的结果不一致[6],也表明了猕猴桃不同品种之间存在的基因型差异[7]。同时,在添加ZT的培养基中都出现了愈伤组织局部产生暗红色的现象,并且在后期这些暗红色愈伤褐化死亡,这种现象在前人的报道[8-9]中出现不多。试验结果表明,培养基 MS+5.0mg/LBA+0.5mg/LNAA为愈伤组织不定芽分化的最优培养基。
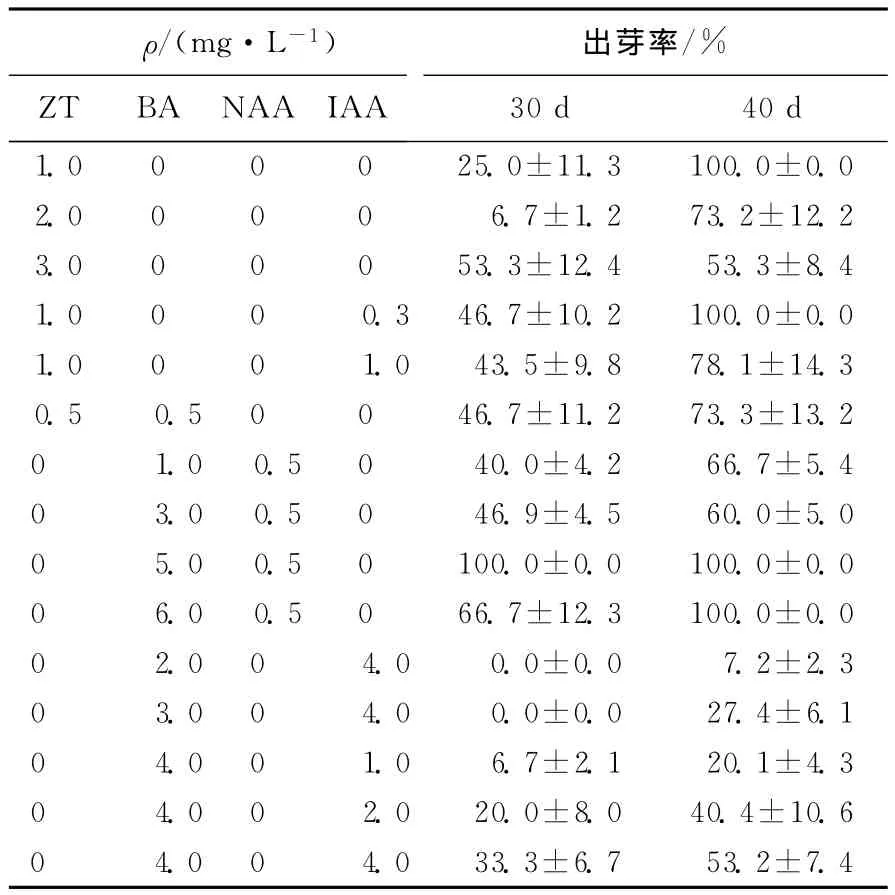
表2 植物生长调节剂对不定芽分化的影响
2.3 调节剂对不定芽生根的影响
愈伤组织不定芽在分化培养基上继代培养2次后,选取长势良好、3cm左右的不定芽,接种到不同的生根培养基中诱导生根。植物生长调节剂对不定芽生根的影响见表3所列。由表3可见,红阳猕猴桃不定芽的生根效率较低,培养基1/2MS+1.2mg/L IBA 的诱导生根效率为最高,达到83.3%。大部分外植体基部首先形成少量的愈伤组织,接着再生出不定根。添加BA后,促进了外植体基部愈伤组织的生长和基部的膨大,对诱导生根具有明显的抑制作用。从诱导不定芽的生根率和平均生根数2个指标来看,1/2MS+1.2mg/L IBA为最优的不定芽生根培养基。
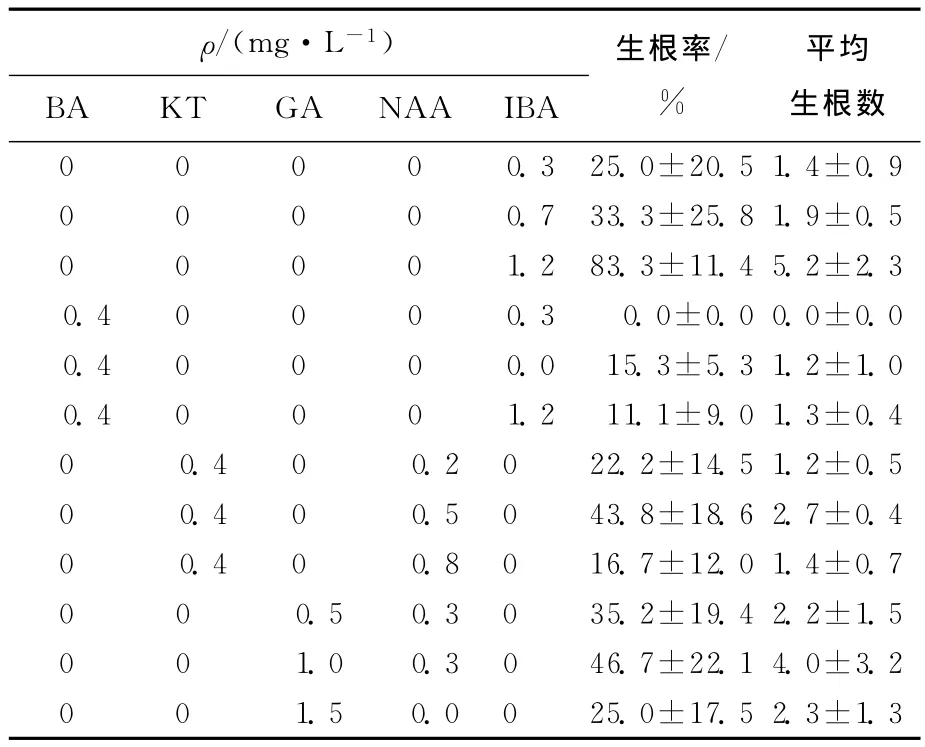
表3 植物生长调节剂对不定芽生根的影响
2.4 移栽成活
生根苗移栽后30d成活率达到90%以上,成活的苗生长良好,叶片颜色均匀,呈鲜绿色。
3 讨 论
试验由红阳猕猴桃组培苗叶片得到淡黄色或白色、质地疏松和绿色、质地致密的2类愈伤组织。淡黄色或白色、质地疏松的愈伤组织可以在相同的诱导培养基上继代增殖,增殖系数大,但也会出现部分水渍化现象。试验表明,由加入了2,4-D的培养基中产生的淡黄色或白色、质地疏松的愈伤组织进行不定芽分化时,必须先在只加细胞分裂素(如 MS+1.0mg/L ZT)的培养基上,通过1~2次继代培养,逐渐转绿变致密后,才可以在愈伤组织不定芽分化培养基上(同时添加细胞分裂素和生长素)实现分化生芽。如果直接转入不定芽分化培养基,愈伤组织会产生大量的不定根而不分化、不定芽。虽然大量不定根的产生也可以使愈伤组织迅速增殖,并且在切除这些不定根后继续诱导不定芽分化时可以产生不定芽,但是再生周期明显增加,不利于快速繁殖。
有报道称,在不定芽分化前将由添加了2,4-D的培养基诱导出来的疏松的愈伤组织转接到MS+1.0mg/L ZT的培养基上培养14d,然后再转接到不定芽分化培养基上,即采用“二次培养”的方法来解除2,4-D对分化的抑制作用[10]。本试验将2,4-D作为细胞生长素所表现出来的是诱导生根效应。在愈伤组织诱导不定芽分化阶段,必须用只加入细胞分裂素作为植物生长调节剂的培养基来诱导不定芽才能获得成功。
2种不同状态的愈伤组织都可以最终再生成完整植株。由 MS+3.0mg/L BA+1.0mg/L NAA诱导的绿色、质地致密的愈伤组织的再生过程更快、效率更高,可以用于工厂化快繁和遗传转化等方面。由 MS+0.5mg/L ZT+0.5mg/L 2,4-D所诱导的淡黄色、质地疏松的愈伤组织再生周期较长,但是对于降低一些试验(例如多倍体诱导试验)中的嵌合体现象是有利的。
[1] 胥小林.猕猴桃栽培技术[J].现代园艺,2013(6):28.
[2] Hirsch A M.The culture of Actinidia chinensis fruit tissues and the metabolism of free amino acids in stem segments cultured in vitro[J].Comptes-Rendus-Hebdomadaires-des-Seances-de-l'Aeademiedes-Sciences,D,1975,280(11):1369-1372.
[3] 谢志兵,鲁旭东.猕猴桃组织培养中适宜激素组合的筛选[J].北方果树,2003(3):7-8.
[4] Wu Y J,Xie M,Long Q J.In vitro organogenesis and plant regereration from leaves of Actinidia eriantha Benth.cv White[J].New Zealand Journal of Crop and Horticultual Science,2011,39(4):231-240.
[5] 汪克强,周建峰,王晓兵.红阳猕猴桃的栽培与管理[J].山西林业科技,2010(5):68-71.
[6] Bi J H,Liu Y L,Syed A H.In vitro organogenesis and plant regeneration from leaf explants of Actinidia latifolia[J].Journal of Fruit Science,2005,22(4):405-408.
[7] 黄宏文,龚俊杰,王圣梅,等.猕猴桃属(Actinidia)的遗传多样性[J].生物多样性,2000,8(1):1-12.
[8] 隆前进,吴延军,谢 鸣.‘红阳’猕猴桃叶片和带芽茎段的组织培养快繁技术 [J].浙江农业学报,2010,22(4):429-432.
[9] 尚霄丽,马春华,冯建灿,等.中华猕猴桃叶片再生体系的建立[J].江西农业学报,2010,22(4):50-52.
[10] 贾海慧.中华猕猴桃愈伤组织的诱导与分化[J].山东林业科技,2010(3):41-42.
