肝螺杆菌诱导不同品系小鼠慢性肝损伤与Th1/Th2细胞功能变化的分析
2015-03-11李红艳盛传伦赵晓南
李红艳,王 静,盛传伦,赵晓南
(吉林大学中日联谊医院,吉林 长春130033)
肝螺杆菌诱导不同品系小鼠慢性肝损伤与Th1/Th2细胞功能变化的分析
李红艳,王静,盛传伦,赵晓南*
(吉林大学中日联谊医院,吉林 长春130033)
摘要:目的观察不同品系小鼠感染H.hepaticu后的肝脏病理损伤与Th1/Th2细胞功能的变化的关系。方法SPF级雄性BABL/c Cr、SCID/ Cr、C57BL/6 Cr小鼠接种 H.hepaticus标准菌株ATCC51450菌液0.2 ml(1×108CUF/ml),连续3次,每次间隔48 h,对照组灌饲等量的PBS。于末次接种H.hepaticus后第16周处死小鼠,留取血清和肝脏,一份肝组织行病理组织学检查,另一份肝组织及血清应用ELISA方法检测细胞因子IFN-γ、TNF-α、IL-4、IL-5含量。结果H.hepaticus感染后16周时BALB/c Cr小鼠血清、肝脏组织中IFN-γ、TNF-α含量明显高于对照组(P<0.001);BALB/c Cr小鼠血清、肝脏组织中IFN-γ、TNF-α含量明显高于SCID/ Cr、C57BL/6 Cr小鼠(P<0.001);而SCID/ Cr小鼠、C57BL/6 Cr小鼠血清、肝脏组织中IFN-γ、TNF-α含量与对照组相比无显著性差异(P>0.05);H.hepaticus感染后的各品系小鼠血清、肝脏组织中IL-4及IL-5含量与对照组相比,无显著性差异(P>0.05);H.hepaticus感染后BALB/c Cr小鼠血清及肝脏组织中IFN-γ、TNF-α含量随着肝脏病理评分的增高而增加(P<0.05;P<0.01)。结论H.hepaticus感染BALB/c Cr小鼠后诱导慢性肝损伤的程度与Th1细胞因子IFN-γ、TNF-α的水平呈正相关;具有免疫活性小鼠H.hepaticus感染后宿主免疫反应是以Th1细胞为主的免疫反应。
关键词:肝螺杆菌;不同品系小鼠;慢性肝损伤;Th1/Th2细胞功能
(ChinJLabDiagn,2015,19:2004)
1992年,美国国立癌症研究所从发生了较高水平肝癌的雌性A/JCr小鼠的胆小管和胆囊中检出一种螺旋状细菌,命名为肝螺杆菌 (Helicobactel hepaticus,H.hepaticus)[1]。H.hepaticus不仅定植于多种敏感品系小鼠的下位肠道及肝胆系统,引起肠道炎症性病变及慢性活动性肝炎,尤其是雄性的A/JCr小鼠,甚至导致肝细胞腺癌和肿瘤[2,3]。感染H.hepaticu的A/JCr小鼠肝脏血管周围、肝实质以及胆囊周围出现多个单核细胞浸润病灶,这些损伤提示在肝胆管系统可能存在针对H.hepaticus抗原细胞介导的免疫反应[2]。研究发现H.hepaticus感染A/JCr小鼠的宿主反应与人类感染H.pylori相类似,两者所引起的病理改变均与细菌的持续定植以及显著的免疫反应所导致的炎症损伤相关[2,4]。细胞介导的免疫反应在螺杆菌的持续定植或促进损伤方面的作用机制目前还没有确定。H.pylori、H.felis的免疫反应均为Th1样反应,因为免疫细胞产生IFN-γ多于IL-4[5-7]。Th细胞是能辅助T、B淋巴细胞应答的功能亚群。生理状态下,体内Th1和Th2细胞可分别产生Th1型和Th2型细胞因子,并相互调节、相互制约,它们的失调与感染性疾病以及自身免疫性疾病相关。因此本研究针对H.hepaticu感染诱导出慢性肝损伤的不同品系小鼠,检测其血清及肝脏组织中与Th1细胞功能相关的细胞因子IFN-γ、TNF-α含量以及与Th2细胞功能相关的细胞因子IL-4、IL-5 的含量,观察不同品系小鼠感染H.hepaticu后的Th1/Th2细胞功能的变化及其与肝脏病理损伤的关系,为进一步探讨H.hepaticu致病机制奠定基础。
1材料与方法
1.1实验材料
1.1.1H.hepaticus标准菌株来源及培养
H.hepaticus标准菌株ATCC51450购自美国国家标准菌种保藏中心(American Type Culture Collection,ATCC)公司。冻存菌株经布氏琼脂培养基复苏,于微需氧(5%O2,10%CO2,85%N2)、37℃、高湿度条件下培养7~10天,可疑菌落经鉴定为H.hepaticus后进行纯培养2-3代,备用。
1.1.2实验动物及饲养
4-6周龄无特定病原菌(SPF)级雄性BABL/C、C57BL/6小鼠,购自吉林省高新医学实验动物中心,SCID小鼠购自上海SLAC实验动物有限公司。体重16-28克,分笼饲养,饲喂消毒的食物(食物根据小鼠体重限量供给)及水。
1.2实验分组与方法
1.2.1小鼠H.hepaticus感染模型的建立
已经证实无H.hepaticus感染的SPF级雄性BABL/cCr、SCID/Cr、C57BL/6Cr小鼠各10只,按照文献介绍方法接种H.hepaticus[2]。具体步骤如下:禁食12 h后接种制备好的H.hepaticus标准菌株ATCC51450菌液0.2毫升(1×108CUF/ml),对照组灌饲等量的PBS,连续3次,每次间隔48 h。
于最后一次接种H.hepaticus后第16周时,禁食12 h后处死小鼠,采用眼球摘除法取血0.3-0.5 ml,分离血清并于-80℃保存,统一行ELISA法检测血清抗H.hepaticus-IgG抗体水平及细胞因子水平;随机留取16周各组小鼠的肝脏、盲肠,用无菌生理盐水冲洗肠内容物,将组织加入适量生理盐水捣碎,1000×g离心10 min,取上清液-80℃保存统一行细胞因子水平检测。
1.2.2血清抗H.hepaticus-IgG抗体检测
应用H.hepaticus标准菌株制备抗原包被ELISA反应板,应用ELISA法行小鼠血清中抗H.hepaticus抗体检测。
①H.hepaticus超声粉碎抗原的制备
选取稳定传代的H.hepaticus标准菌株ATCC51450在固体培养基培养7-10天,用无菌生理盐水洗脱固体平板上的细菌,4℃、3 000 rmp离心10 min后弃上清,重新加入生理盐水并用毛细细管吹打,悬浮后再离心,收集细菌。然后用小体积无菌生理盐水悬浮,冰浴超声粉碎10 min,4℃、12 000 rmp 离心20 min,收集上清。细菌残渣再超声粉碎10 min,重复上述过程一次。合并两次上清,测蛋白浓度,分装后置-80℃保存,备用。
抗原浓度计算:超声粉碎细菌抗原稀释后,用U-341紫外可见分光光度计测260 nm和280 nm波长的吸光度值(A260、A280),按下列公式计算浓度:
蛋白浓度(mg/ml)=(1.74×A280-0.75×A260)×稀释倍数
②病理组织学分析
取小鼠肝脏组织以10%甲醛固定,石蜡切片,行HE染色供组织学诊断。病理组织学由两人作双盲检查,采用Mohammadi 等[8]提出的评分标准,采用半定量计分方法:肝脏组织学损伤按炎症细胞浸润、肝细胞坏死、静脉周围卵圆细胞和胆小管增生、Ito细胞和增生枯否细胞以及多型性肝细胞这5种形态学变量分级:0分(正常),1分(微小病变;病变累及≤5%),2分(轻度:病变累及5-25%),3分(中度:病变累及25-50%)和4分(重度:病变累及50%以上)。
③血清及组织中细胞因子IFN-γ、IL-2、IL-4和IL-5检测:ELISA检测试剂盒购自上海锐聪生物技术有限公司,具体操作方法参照说明书。
④统计学方法
2结果
2.1不同品系小鼠H.hepaticus感染后16周时Th1细胞功能分析
为了分析不同品系小鼠H.hepaticus感染后与Th1细胞功能的关系,对H.hepaticus感染后16周时不同品系小鼠血清及肝脏组织中的IFN-γ、TNF-α含量进行检测。结果显示H.hepaticus感染后16周时BALB/cCr小鼠血清、肝脏组织中IFN-γ、TNF-α含量明显高于对照组(P<0.001);BALB/cCr小鼠血清、肝脏组织中IFN-γ、TNF-α含量明显高于SCID/Cr、C57BL/6Cr小鼠(P<0.001);而SCID/Cr小鼠、C57BL/6Cr小鼠血清、肝脏组织中IFN-γ、TNF-α含量与对照组相比无显著性差异(P>0.05)。见表1。

表1 不同品系小鼠H.hepaticus感染后血清及肝组织中IFN-γ、TNF-α含量的比较
注:BALB/c Cr小鼠与对照组相比P<0.001;实验组BALB/c Cr小鼠血清及组织IFN-γ、TNF-α含量与C57BL/6 Cr及SCID/ Cr小鼠相比P<0.001
2.2不同品系小鼠H.hepaticus感染后16周时Th2细胞功能分析
H.hepaticus感染后的各品系小鼠血清、肝脏组织中IL-4及IL-5含量与对照组相比,无显著性差异(P>0.05);各品系小鼠之间相比,也无显著性差异(P>0.05)。见表2。
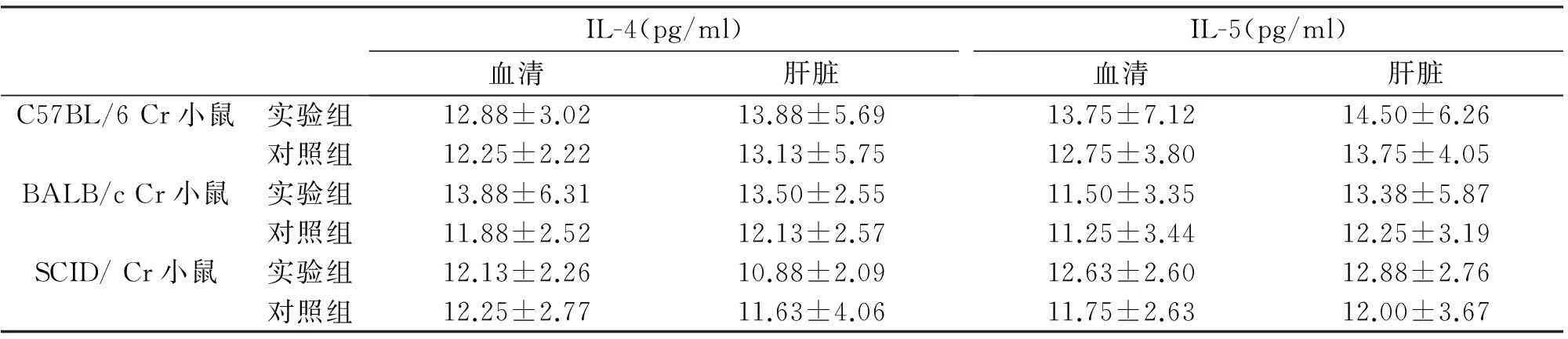
表2 不同品系小鼠H.hepaticus感染后血清及肝组织中IL-4、IL-5含量的比较
各组之间比较P>0.05
2.3不同品系小鼠H.hepaticus感染肝脏病理评分与Th1细胞功能变化的关系
BALB/c Cr小鼠感染H.hepaticus后肝脏及血清中的IFN-γ、TNF-α含量明显增高,为了进一步探讨H.hepaticus感染所诱导的慢性肝损伤与Th1细胞功能变化的关系,我们按照不同的肝脏病理损伤评分来观察Th1细胞功能的变化。结果显示H.hepaticus感染后BALB/c Cr小鼠血清及肝脏组织中IFN-γ、TNF-α含量随着肝脏病理评分的增高而增加(P<0.05;P<0.01)。见图1。

图1 H.hepaticus感染BALB/c Cr小鼠血清及肝组织中IFN-γ、TNF-α含量与肝脏病理评分的关系
3讨论
螺杆菌属是一组革兰氏阴性的微需氧螺旋状细菌,研究显示该菌属与人或动物的一些疾病的发生具有一定的相关性,如胃肠道、肝胆疾病以及某些肿瘤等[9]。H.hepaticus最初是在A/JCr小鼠体内发现的,可引起多种敏感品系小鼠发生慢性活动性肝炎,甚至肝细胞癌,而在免疫缺陷小鼠可导致炎症性肠病[10]。本课题组应用不同品系小鼠C57BL/6Cr、BALB/cCr以及SCID/Cr小鼠接种H.hepaticus,其中C57BL/6Cr、BALB/cCr小鼠具有免疫活性,而SCID/Cr小鼠为免疫缺陷小鼠,BALB/cCr及SCID/Cr小鼠感染H.hepaticus后均出现明显的盲肠结肠炎症及慢性活动性肝炎,而同样具有免疫活性的C57BL/6Cr小鼠肝脏及肠道炎症均较轻,因此探讨H.hepaticus感染后宿主的免疫应答反应显得十分重要。
本研究结果显示BALB/c Cr小鼠感染H.hepaticus后血清、肝脏组织中IFN-γ、TNF-α含量明显升高;SCID/ Cr、C57BL/6 Cr小鼠感染H.hepaticus后血清、肝脏组织中IFN-γ、TNF-α含量虽较对照组有所增高,但两者之间无显著性差异,表明SCID/ Cr小鼠缺乏具有免疫活性小鼠感染H.hepaticus后所表现的重要的T细胞介导的免疫应答;而C57BL/6 Cr小鼠提示其感染H.hepaticus后病理损伤轻可能与其Th1细胞反应不明显有关。干扰素的过量产生以及低水平的IL-4、IL- 5与H.felis相关性胃炎小鼠模型是一致的[11]。自然杀伤细胞和Th1细胞均可产生IFN-γ,IFN-γ是一种炎症因子,促进IL-12的产生,进一步促进幼稚T细胞向Th1细胞表型转换[12,13]。Th1介导的应答中,IFN-γ释放后诱导内皮细胞产生趋化性细胞因子IP-10、Mig和MCP-1。IP-10、Mig作用于Th1细胞表面的趋化因子受体CXCR3,MCP-1可吸引单核吞噬细胞,从而使这些细胞聚集到炎症部位,增强Th1型反应。本研究中H.hepaticus感染BALB/c Cr小鼠后诱导慢性肝损伤的程度与Th1细胞因子IFN-γ、TNF-α的水平呈正相关,而以Th1为主的免疫反应常和炎症反应及组织损伤有关,因此推测H.hepaticus感染的慢性肝损害的发生,伴随着Th1细胞介导的免疫应答反应的产生,该反应加剧了感染的过程。
总之,本研究结果显示H.hepaticus感染后引起明显病理损伤的BALB/c Cr小鼠表现为Th1细胞介导的免疫反应,我们可以推测H.hepaticus感染引起病理损伤的结果至少部分原因来自宿主的免疫反应及相关炎症,Th1细胞介导的炎性反应对宿主来讲可能是有害的。因此,将免疫策略转向Th2细胞介导的免疫反应,这也许能为抑制细菌定植或减缓疾病恶化提供更多的保护。此外本实验也显示SCID/ Cr小鼠感染H.hepaticus后可出现与BALB/c Cr小鼠相似的病理损伤,但其缺乏有效的宿主免疫应答,这表明H.hepaticus感染小鼠导致病理损伤的发病机制不能完全归因于宿主的免疫反应,其致病机制是一个多因素相互作用的结果,还有待于进一步研究探讨。
参考文献:
[1]Fox JG,Dewhirst FE,Tully JG,et al.Helicobacter hepaticus Sp.Now,a microaerophilic bacterium isolated from lives and interstinal mucosal scrapings from mice[J].Clinical Microbiology,1994,32(5):1238.
[2]Fox JG,Li X,L Yan RJ,et al.Chronic proliferative hepatitis in A/JCr mice associated with persistent Helicobacter hepaticus infection:a model of Helicobacter-induced carcinogenesis[J].Infect Immun 1996,64:1548.
[3]Ward JM,Benveniste RE,Fox CH,et al.Tully.Autoimmunity in chronic active Helicobacter hepatitis of mice[J].Serum antibodies and expression of heat shock protein 70 in liver[J].Am J Pathol,1996,148:509.
[4]Fox JG,Yan L,Shames JB,et al.Persistent hepatitis and enterocolitis in germfree mice infected with Helicobacter hepaticus[J].Infect Immun,1996.64:3673.
[5]Delios MM,Manghetti M,Decarli M,et al.T helper 1 effector cells specific for Helicobacter pylori in the gastric antrum of patients with peptic ulcer disease[J].J Immunol,1997,158:962.
[6]Livingston RS,Myles MH,Livingston BAJ,et al.Sex influence on chronic intestinal inflammation in Helicobacter hepaticus-infected A/JCr mice[J].Comp Med,2004.54:301.
[7]Whary MT,Morgan TJ,Dangler CA,et al.Chronic active hepatitis induced by Helicobacter hepaticus in the A/JCr mouse is associated with a Th1 cell-mediated immune response[J].Infect Immun,1998,66:3142.
[8]Mohammadi M,Redline R,Nedrud J,et al.Role of the host in pathogenesis of Helicobacter-associated gastritis:H.felis infection of inbred and congenic mouse strains[J].Infect Immun,1996,64:238.
[9]Solnick JV,Schauer DB.Emergence of diverse Helicobacter species in the pathogenesis of gastric and enterohepatic diseases[J].Clin Microbiol Rev,2001,14:59.
[10]Ward JM,Anver MR,Haines DC,et al.Benveniste.Chronic active hepatitis in mice caused by Helicobacter hepaticus[J].Am J Pathol,1994.145:959.
[11]Sedlik C.Th1 and Th2 subsets of T lymphocytes:characteristics,physiological role and regulation[J].Bull Inst Pasteur,1996,94:173.
[12]Hayglass Y,Li JD,Rempel MD,et al.Exogenous IL-12 and directed induction of human and murine Th1-associated responses[J].Int Arch Allergy Immunol,1997,113:281.
[13]Xiong H,Ohya S,Tanabe Y,et al.Persistent production of interferon-gamma (IFN-gamma) and IL-12 is essential for the generation of protective immunity against Listeria monocytogenes[J].Clin Exp Immunol,1997,108:456.
《中国实验诊断学》杂志社声明
本刊为中国科技论文统计源期刊(中国科技核心期刊)、中国学术期刊综合数据库来源期刊、《中国期刊网》、《中国学术期刊》(光盘版)》全文收录期刊、《万方数据库—数据化期刊群》、《中国生物医学文献数据库》、中国科技期刊数据库等入网期刊。本刊已许可上述单位以数字化方式复制、汇编、发行、信息网络传播本刊全文。作者著作权使用费与本刊稿酬一次性给付。如作者不同意将文章编入以上数据库,请在来稿时声明,本刊将做适当处理,否则本刊视为同意收录。
Analysis of chronic liver injury induced by Helicobacter hepaticus in mice of different strains and functional changes of Th1/Th2 cellsLIHong-yan,WANGJing,SHENGChuan-lun,etal.(China-JapanUnionHospitalofJilinUniversty130033,China)
Abstract:ObjectiveTo observe the relationship between liver pathological injury induced by H.hepaticus in mice of different strains and Th1/Th2 cell function.MethodsSPF-class male BABL/c Cr、SCID/Cr,C57BL/ 6 Cr mice inoculated H.hepaticus standard strain ATCC51450 0.2ml bacterial suspension (1×108CUF/ml),for 3 times,each time interval of 48 hours,the control Group gavage the same amount of PBS.At last after Helicobacter hepaticus inoculation 16 weeks mice were killed,specimens from serum and liver,one liver tissue for histopathology;application of ELISA method to detect cytokines IFN-γ,TNF-α,IL-4,IL-5 contents of another liver tissue and serum.ResultsAfter H.hepaticus infection 16 weeks,IFN-γ,TNF-α contents of serum and liver tissue in BALB /c Cr mice were significantly higher than the control group(P<0.001);which IFN-γ,TNF-α contents of serum and liver tissue in BALB /c Cr mice were significantly higher than SCID/ Cr mice and C57BL/6 Cr mice (P<0.001);Compared with the control group,the IFN-γ,TNF-α contents of serum and liver tissue in SCID/ Cr mice and C57BL/6 Cr mice after H.hepaticus infection were no significant difference (P>0.05);Compared with the control group,the IL-4,IL-5 contents of serum and liver tissue in all strains of mice after H.hepaticus infection were no significant difference (P>0.05);IFN-γ,TNF-α contents of serum and liver tissue in H.hepaticus infected BALB/c Cr mice were increased with liver pathology scores increased (P<0.05;P<0.01).ConclusionThe degree of chronic liver injury induced by H.hepaticus infection in BALB/c Cr mice were positively correlated with IFN-γ,TNF-α levels of Th1 cytokines;Host immune response after immunocompetent mice infect H.hepaticus is a Th1-based immune response.
Key words:Helicobacter hepaticus; different strains of mice; chronic liver damage;Th1/Th2 cell function
(收稿日期:2015-01-19)
文献标识码:A
中图分类号:R392
文章编号:1007-4287(2015)12-2004-05
*通讯作者
