荷木整树蒸腾对干湿季土壤水分的水力响应
2015-03-10倪广艳朱丽薇牛俊峰赵秀华曾小平
倪广艳,赵 平,朱丽薇,牛俊峰,赵秀华,曾小平
中国科学院华南植物园,退化生态系统植被恢复与管理重点实验室,广州 510650
荷木整树蒸腾对干湿季土壤水分的水力响应
倪广艳,赵 平*,朱丽薇,牛俊峰,赵秀华,曾小平
中国科学院华南植物园,退化生态系统植被恢复与管理重点实验室,广州 510650
降雨在时间上的非均匀分配导致森林土壤含水量呈现明显的干、湿季变化,并可能在干季形成水分胁迫,引起植物蒸腾变化。在监测环境因子的同时,利用Granier热消散探针连续监测荷木(Schimasuperba)的树干液流,以液流密度值计算整树蒸腾,并结合水力导度与叶片/土壤的水势差,探讨环境因子和水力导度对荷木整树蒸腾的协同控制。结果表明,华南地区的季节性降雨形成的干、湿季并未引起荷木蒸腾在季节上的显著差异,但对产生蒸腾的水力生理产生了显著影响。荷木蒸腾在干、湿季均与主要驱动环境因子(光合有效辐射PAR和水汽压亏缺VPD)呈显著正相关。在水热充足的湿季,荷木蒸腾主要受气孔导度调节;在干季,当空气水汽压亏缺达2.132 MPa时,水力导度与气孔导度协同控制蒸腾。整树水力导度对整树蒸腾的水力补偿出现在15:00—17:00,平均补偿值为0.08 g/s。利用蒸腾的估测值与实测值之间的差值量化荷木的水力补偿效应,是对水力导度与气孔导度协同控制树木蒸腾机理的深入探索。研究结果对于掌握季节性降雨不均背景下华南地区主要造林树种需水和耗水规律,有效发挥森林保水功能具有重要意义。
蒸腾;整树水力导度;土壤/叶片水势差;水力补偿;荷木
植物将根系从土壤吸收的水分输送到各个器官,以满足生命活动的需要,并以水汽的形式从叶片、枝条或树干向外逸散而形成蒸腾。水分在土壤-植物的水力连续体中的运输存在两个关键环节,一是根部与土壤的水势差急剧变化形成的干燥非导水面,二是木质部导管空穴化阻碍水分传输[1]。在这两个环节中,水势差与水分传输阻力协同调节气孔气体的交换,影响CO2的吸收,进而调控树木生长(hydraulic limitation hypothesis,HLH,简称水力限制假说)[2]。因此,水势差和水分传输阻力在维持植物体内水分供应、防止水力功能失调和木质部空穴化等方面起关键作用,对植物蒸腾有重要意义。
降雨在时间上的非均匀分配导致森林土壤含水量呈现出明显的干湿季变化,并可能在干季形成水分胁迫。土壤水分决定植物的蒸腾量,由于土壤水分供应差异,干季黎明前植物叶片水势与午间最低水势差值较大[3],导致水分在土壤-叶片水力路径上的传输阻力增大,叶片气孔开度变小而蒸腾降低[4- 6]。然而,在具有可利用光热资源的条件下,树木可通过调整水力导度来避免气孔过度关闭,以保证足够的CO2吸收,维持适度生长,即水力导度对蒸腾具有补偿作用[7],这是森林树种适应干季土壤水分胁迫,在时间和空间上充分利用光热资源的重要生态策略之一。目前,国内外已有不少学者开展了叶片和枝条的水力特征及其与抗旱性关系的研究,并建立了水势与导水率、比导率、叶比导率等关系的数学模型,得出输水结构的有效性和安全性不可完全兼得的重要结论[8- 10]。尽管理论上认为植物会适当调整水力导度以补偿蒸腾,然而关于在干旱环境下水力特征与水分传输补偿关系的实际研究却不多,而更多的是关于树高、落叶等情况下对蒸腾的水力补偿。如Sala[7]对落基山脉的针叶林研究表明,演替后期的物种能完全补偿由于树木高度上升而不断增加的水力限制,而演替早期物种只能部分补偿树高的影响;飓风引起了落羽杉(Taxodiumdistichum)叶面积减少41%,只引起液流密度和蒸腾下降18%[11];火炬松(Pinustaeda)的叶面积减少55%,蒸腾仍得到完全补偿[12]。此外,目前关于水力补偿作用的重要结果多从针叶树获得,尤其是松和云杉,对阔叶树的研究则相对较少。阔叶林因为具有与针叶林明显不同的立地条件、冠层表面粗糙度、叶片尺寸、冠层和大气偶联程度等,其蒸腾的机理比针叶林复杂的多,其应对干旱环境的策略也要复杂的多[13]。
阔叶树的水力导度如何响应由季节性降雨不均引起的干、湿季土壤水分含量变化,如何补偿蒸腾以应付干旱环境,能在多大程度上补偿?这些问题对于区域的水分利用、冠层乃至更大尺度上碳水交换具有重要意义。本研究以亚热带常绿优势阔叶树种荷木(Schimasuperba)为研究对象,在监测主要环境参数(如光合有效辐射、气温和湿度等)的基础上,利用基于树干液流(sap flow)观测值计算的整树蒸腾,结合水力导度与叶片/土壤的水势差,探讨荷木整树水力导度和土壤/冠层叶片水势差对蒸腾的控制作用,以及水力导度对干季土壤水分胁迫影响下植物蒸腾的补偿效应。
1 材料与方法
1.1 试验地概况
野外试验样地位于华南植物园小青山生态实验场荷木林(23°8′N,113°17′E),样地面积2885.6 m2,东北坡向,坡度12°,海拔高度41 m。该地区气候条件见参考文献[14]。该荷木林为20世纪80年代中期种植,种植密度为1046 株/hm2,地下植被稀疏,立地条件中等。样地内设有16.5 m高的观测塔,塔顶安装有森林冠层上方的环境因子观测系统,林下设有小气候观测设施等。
1.2 观测方法
1.2.1 Sap flow观测系统安装
选择观测塔周围的6株样树(表1),于树干北面胸高处(1.3 m)安装Granier热消散探针(长20 mm),用四芯屏蔽电缆连接DL2e型数据采集仪(英国Delta-T公司),自动记录树干液流密度,每30 s测读1次,每10 min进行平均并储存。

表1 荷木样树的树形特征Table 1 Characteristics of Schima superba sample trees
1.2.2 环境监测系统安装
借助观测塔,将光合有效辐射传感器安装在冠层上方约1 m处,空气温度和湿度传感器安装在近树冠高度三分之二处。根据树木根系在土壤中的分布情况和特点,将土壤水分传感器埋入根系分布密度最高的土层范围(30—50 cm)。以上传感器均与DL2e数据采集仪连接,测读频率与液流相同。空气水汽压亏缺(Vapor Pressure Deficit(VPD),kPa)由以下公式计算[15]:
VPD =a×exp[bTa/(Ta+c)]×(1/RH)
式中,RH为空气相对湿度(%);Ta是叶片温度(℃);a、b和c分别为0.611 kPa,17.502和240.97 ℃。
1.2.3 树形因子测定
边材面积、冠层叶面积等的测定方法参见参考文献[16]。
1.2.4 叶片水势(ΨL)的测定
根据华南地区的降雨分配特点,选择8月和11月分别代表湿季和干季。借助观测塔于2009年8月20、22日和11月3—5日晴朗天气下,选择上述安装液流测定系统的6株荷木样树,每株剪取3枝带叶枝条,利用 PMS压力室(PMS Instruments,Oregon,USA)即时测定叶片水势值(ΨL,MPa),从黎明前至傍晚太阳辐射为零每隔1 h进行测定(8月为5:00—20:00,11月为5:00—19:00)。
1.3 计算
1.3.1 由液流密度(JS)到整树蒸腾(ET)的计算
树干液流测定值为液流密度(JS,g m-2s-1),即单位时间流经单位面积边材的液流量,用美国杜克大学(Duke University)环境学院Ram Oren教授实验室开发的Baseliner 3.0.8程序,将Granier探针获取的原始电压值转换为液流密度值。利用Js经尺度扩展计算整树蒸腾(ET,g/s),需要考虑液流沿边材的径向变化。梅婷婷等[17]研究发现,该试验地荷木的液流分布可看作两个同心圆,即边材0—4 cm为高液流密度区,4 cm至心材为低液流密度区,低密度区液流量平均为高密度区的45%。为了减少尺度扩展的误差,将两部分液流密度分开计算。因此,基于各样树的边材厚度及边材面积(表1),累计单株整树蒸腾公式如下:
ET= ∑[(JSi·ASi) + (JSj·ASj)×45%]
式中,i为边材厚度0—4 cm,j为边材厚度大于4 cm的部分。
由于液流反映的树木蒸腾往往滞后于林冠的实际蒸腾,即液流的时滞现象(time lag);因此,本研究采用错位对比法[18],分析每棵样树在干季和湿季的时滞(表1),在将液流观测值尺度扩展到冠层蒸腾时考虑时滞效应。
1.3.2 整树水力导度(k)
将欧姆定律(Ohm′s law)用于土壤-植物连续水分供应体即可得蒸腾、水力导度与土壤/叶片水势差三者之间的函数关系[19]:
k=E/ (ΨS-ΨL-hρwg)
式中,k是树木根系附近土壤至冠层叶片之间的整树水力导度(kg m-2s-1MPa),E为树木蒸腾(kg m-2s-1),ΨS为土壤水势(MPa),ΨL是冠层叶片水势(MPa),两者之差为根系附近土壤与冠层叶片之间的水势差,hρwg表示水密度为ρw(kg/m3)、高为h(m)(树木根部至冠层的木质部长度)的水柱重量拉力,g为重力加速度(N/kg)。
1.3.3 水力补偿的判断与计算
以树干液流测定值扩展到的瞬时蒸腾为实测值(M-ET),分别建立干、湿季实测蒸腾与土壤-叶片水势的函数关系(ET=F(ΨL-S))。将土壤-叶片水势值代入函数关系,得到对应时刻的估测蒸腾值(P-ET)。在光合有效辐射(PAR,μmol m-2s-1)和VPD相近的时间范围内,从一个时间点到另一个时间点的间隔内整树蒸腾变化量(M-ΔET和P-ΔET)可反映整树蒸腾对水力导度的响应敏感度。本文中,以PAR和VPD均较高的时段(13:00—17:00)为例,根据试验采用的整点测量水势方法,若相邻两个整点间隔的时间范围内ΔET变化与水力导度k不遵循明显的关系,说明蒸腾主要由气孔限制;若两者遵循1∶1的线性关系,说明蒸腾由水力导度控制;若两者遵循非1∶1的线性关系,说明蒸腾由水力导度与气孔协同控制,即气孔导度对气孔限制的蒸腾具有补偿效应。水力导度贡献可通过对应时刻的ΔET估测值和实测值之间的差进行量化,表示因水力导度的补偿效应而产生的蒸腾量。
1.4 统计分析
采用SPSS 13.0进行数据处理与统计分析,环境参数以试验日的平均值为代表。荷木的液流密度、整树蒸腾、水势及水力导度等以试验日6棵样树的平均值为代表。以线性回归进行方程拟合,使用配对样本t检验和独立样本配对t检验分析干、湿季的差异显著性。最小显著水平为0. 05。
2 结果与分析
2.1 荷木的液流和整树蒸腾的干湿季变化动态
在晴朗天气条件下,荷木液流和整树蒸腾在湿季(8月)和干季(11月)均呈现出明显的日变化(图1)。干季和湿季的平均日耗水量分别为(23.88±12.52) kg/d和(32.48±19.92) kg/d(以24 h为单位),日耗水量变化随样树个体的差异较大,从1号树至6号树,干季比湿季分别减少了34.38%,18.94%,2.08%,34.50%,17.87%和31.80%。蒸腾启动时间与日出时间紧密相关,干季日出时间晚于湿季(6∶33, 6∶04),荷木蒸腾的启动时间亦明显晚于湿季((7:26±7.8) min,(7:10±7.4) min;P<0.001)。干季的蒸腾峰值出现在正午时分,而湿季由于正午时段太阳辐射强度的波动,未呈现明显的蒸腾峰值。
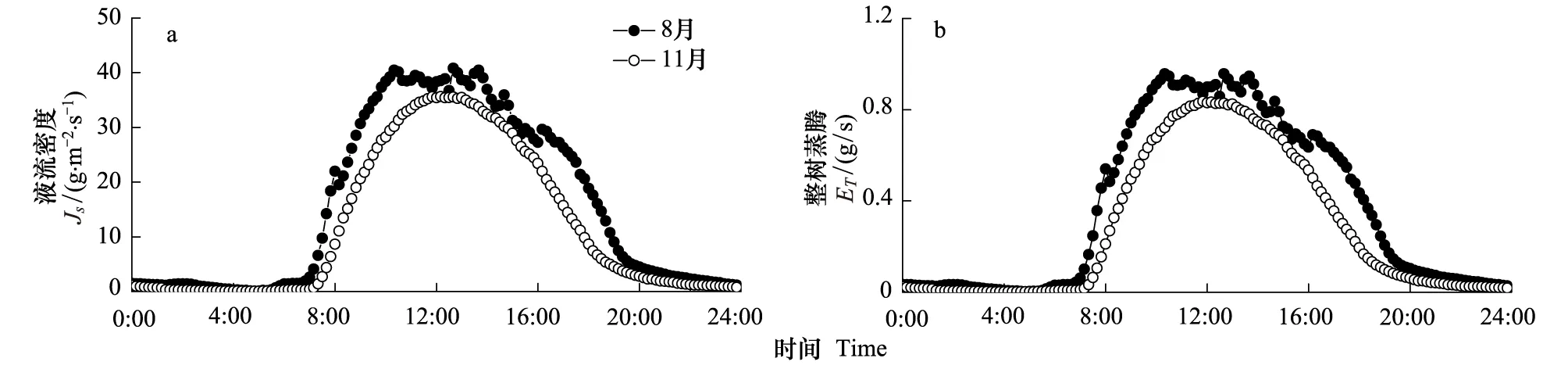
图1 湿季和干季荷木树干液流密度(JS)和整树蒸腾(ET)的日变化Fig.1 Daily variation of sap flux density (JS) and whole tree transpiration (ET) of Schima superba in wet and dry seasons
以PAR=0作为划分夜间依据,累计夜间液流的量作为补水量,每棵荷木样树在干季的夜间补水量均低于湿季,而干、季湿季的夜间补水量占日蒸腾量的比例无明显变化规律(图2)。

图2 湿季和干季荷木冠层日蒸腾耗水量(左上角图为夜间补水量占日蒸腾量的百分比)Fig.2 Daily whole tree transpiration of each sample tree of Schima superba in dry and wet seasons (Inlet represents the ratio of nighttime water recharge to daily transpiration)
2.2 荷木整树蒸腾与环境因子的关系
荷木树干液流密度和整树蒸腾的波动规律与同步监测的光合有效辐射(PAR)、冠层空气温湿度等环境因子的变化趋势基本吻合(图1,图3),湿季PAR在中午时段有波动,液流和蒸腾亦相应出现波动。干季每日7:00左右PAR开始上升,12:00达到峰值,然后下降,并于18:00前后下降为零。湿季的PAR开始上升的时间略早于干季,下降为零则略晚于干季。随PAR增大,气温逐渐升高,树木生理活动增强,叶片蒸腾增强。
空气温度和湿度主要受太阳辐射制约,而水汽压亏缺(VPD)则反映空气温度和湿度的共同效应,为了避免重复分析相互影响的因子,我们使用偏相关分析了整树蒸腾(ET)与PAR及VPD的关系(表2)。ET与PAR或VPD偏相关显著,湿季ET与PAR的偏相关程度大于与VPD的关系,干季则相反,而且无论是PAR还是VPD,在干季与ET的相关性均高于湿季。二元线性回归分析表明,ET与PAR及VPD在干、湿季均呈现显著的线性相关(表3),PAR和VPD的协同效应对ET日变化的决定系数分别为湿季96.5%和干季99.3%。可见,PAR和VPD对ET的影响总体上干季大于湿季。湿季是植物旺盛生长的季节,虽然天气变化剧烈,植物自身调节的生理响应也较为灵敏和活跃,因此减小了环境变化对蒸腾的影响,而干季环境因子对蒸腾的主导效应更明显[20]。

表2 整树蒸腾(ET)与PAR和VPD的偏相关关系Table 2 Partial correlations between ET and PAR, as well as VPD

图3 试验期间气候因子(温度、空气湿度、土壤水分含量、光合有效辐射、水汽压亏缺)的昼夜变化(2009年8月20、22日;11月3—5日)Fig.3 Diurnal courses of meteorological variables, including Temperature (Ta), Relative humidity (Rh), Soil moisture (SM), Photosynthetically active radiation (PAR), Vapor pressure deficit (VPD), during experimental days in wet and dry seasons (Aug. 20, 22 and Nov. 3—5, 2009)
2.3 整树蒸腾(ET)与土壤/叶片水势差(ΨL-S)的关系
就整株树木而言,叶片是水势最低的部位,植物吸收水分的过程中需要克服水势差产生的压力[21]。由于黎明前植物还未开始蒸腾活动,此时稳定天气条件下的叶片水势等同于土壤水势[22- 23]。随着叶片气孔开放,蒸腾作用开始,消耗叶片的水分致使水势逐渐降低。图4和图5分别显示了干、湿季荷木叶片黎明前水势(土壤水势)和土壤/叶片水势差(ΨL-S)的日变化。湿季和干季的土壤水势分别为(-0.252±0.015) MPa和(-0.324±0.017) MPa,后者明显低于前者(P=0.008);ΨL-S在早晨最高,随着时间推移,中午达到最低(湿季在11:00,干季在13:00),随后逐渐回升。将其与ET回归分析发现,干、湿季荷木的ΨL-S和ET呈明显的线性关系(8月(方程1):ET=-1.072ΨL-S+ 0.077,R2=0.3575,P<0.0001;11月(方程2):ET=-1.365ΨL-S+ 0.065,R2= 0.3031,P<0.0001),但两个季节的整树蒸腾并无明显差异(P=0.1302)(图6),该研究结果与朱丽薇等[24]认为荷木的干、湿季土壤水分对荷木蒸腾无显著影响的结果一致。通常,11月份是华南地区的干季,但各年度的降雨情况并不完全一致。本试验进行的年度(2009年)10月份的降雨量达22.3 mm(数据来源于离试验地较近的广州市气象局五山观测站),土壤湿度(22.69±0.02)%,土壤的缺水并不突出。此外,11月份太阳辐射依然较强(最大辐射超过1000 μmol m-2s-1),荷木的蒸腾活动仍然有较好的能量条件。
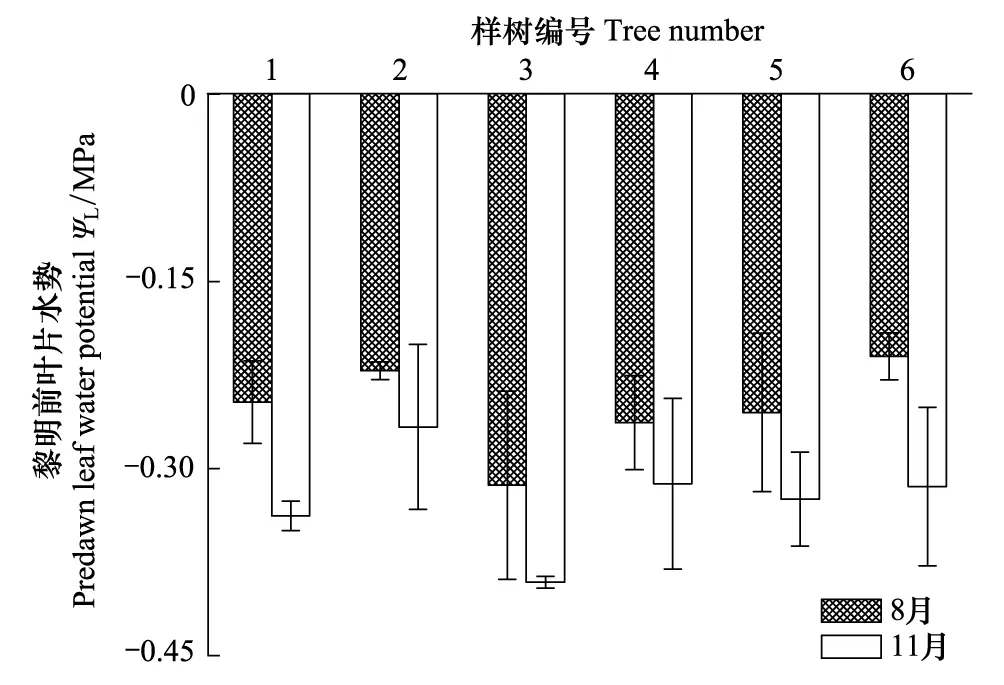
图4 荷木叶片黎明前水势Fig.4 Predawn leaf water potential in wet and dry seasons
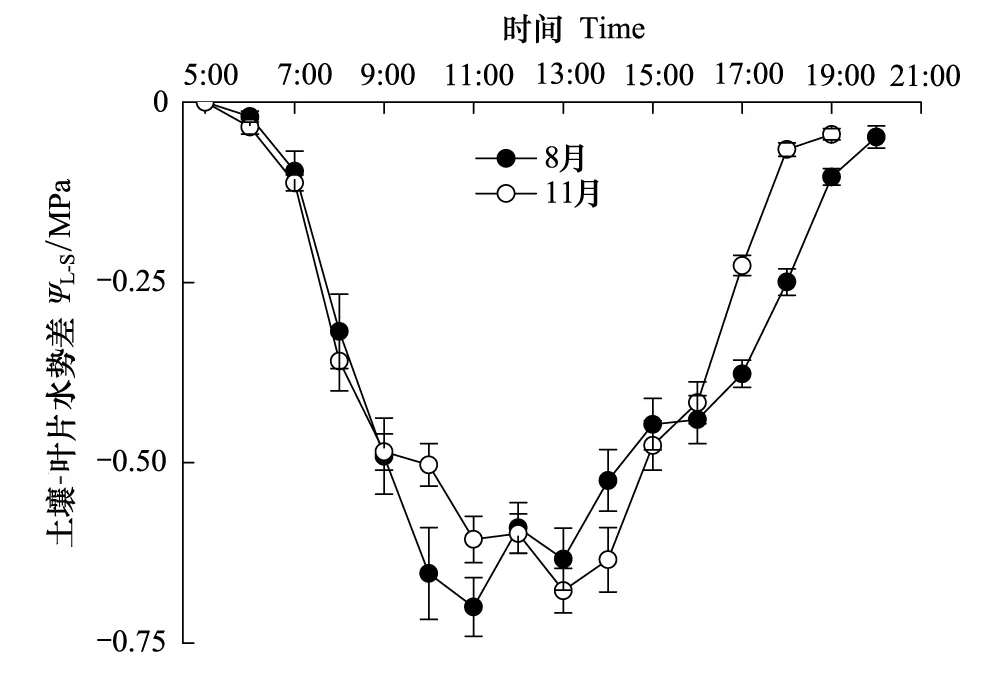
图5 荷木土壤-叶片水势差日变化 Fig.5 Daily variation of soil-leaf water potential difference of Schima superba in wet and dry seasons

图6 荷木整树蒸腾与土壤/叶片水势差的关系 Fig.6 Relationship between soil-leaf water potential difference and whole tree transpiration of Schima superba
表3 整树蒸腾(ET)与PAR及VPD的直线回归关系
Table 3 Linear regression relationship betweenETand PAR, as well as VPD

季节Season直线回归方程Linearregressionequa-tionR2Sig.湿季(8月)Wet(Aug.)ET=-0.114+0.530VPD+0.543PAR0.9650.000干季(11月)Dry(Nov.)ET=-0.232+0.432VPD+0.643PAR0.9930.000
2.4 整树蒸腾与整树水力导度的关系
整树水力导度(k)是树木水力结构对水分传输效率的间接表现[25]。图7显示,早上k较高,随着时间推移,k逐渐下降,上午k变化干季比湿季平缓,而下午比湿季剧烈,两个季节均于傍晚达到最小,干湿季k差异明显(P=0.040);干季在7:00—9:00和13:00—17:00的k值低于湿季,显示这两个时段干季的水力阻力大于湿季(图7)。将8月份11个时间点的k值为横坐标,11月份对应时刻的k值为纵坐标,比较干湿季的k值,拟合到的线性关系为Y=0.442X+0.614,k值越高偏离理想状态(1∶1)越远(图8),如7:00的k值最高,干湿季k的比值为0.71,即此时干季荷木水力阻力为湿季的1.41倍。前人的研究结果显示,干旱条件下欧洲赤松(Pinussylvestris)水力阻力是水分充足时的2—3倍[26];不灌溉时橄榄(Oleaeuropaea)的水力阻力为灌溉时的1.93倍[27];干季土耳其冷杉(Abiesbornmulleriana)的水力阻力比湿季增加了3倍[28]。本文的研究结果显示,干季土壤水分相对较低,土壤水势下降,水分供应减少,致使荷木植物根系吸水困难,如果叶片蒸腾耗水继续增大,木质部导管的物理张力随之增加,水力阻力增大。
树木水力结构的调整、储存水以及其他生物学特征均可能影响水力阻力。Granier等[28]的研究表明,干旱提高土壤与根系之间的水力阻力,减低边材的水力导度。橙树(Shanioutiorange)灌溉减少40%,根系水分传输受到持久干扰,水力导度降低[29]。此外,由于蒸腾会增加木质部导管的水柱张力,取决于水力结构和土壤水分条件的水分传输阻力会制约过度蒸腾,避免蒸腾拉力和水柱重力的共同作用引起水柱断裂或者空穴化,气孔也适当关闭以维持水分平衡。因此,荷木干季与湿季的蒸腾相近,意味着干季的水力阻力可能进一步增加。
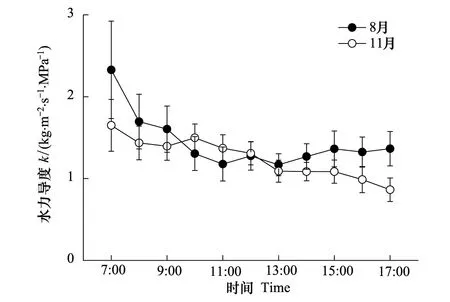
图7 荷木整树水力导度日变化 Fig.7 Daily variation of whole tree hydraulic conductance of Schima superba in wet and dry seasons
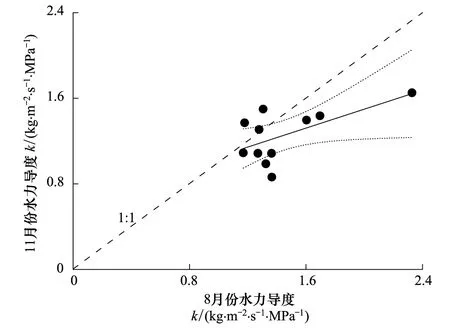
图8 荷木干湿季整树水力导度比例图 Fig.8 Ratio of whole tree hydraulic conductance in wet and dry seasons 图中对角虚线表示水力导度在干、湿季无差异时的理想状态,即比值为1∶1; 回归直线附近的虚线为拟合直线的95%置信区间
2.5 荷木的水力补偿效应

图9 干湿季荷木实测蒸腾值与估测蒸腾值的偏差图 Fig.9 Deviation between measured and predicted transpiration of Schima superba in wet and dry seasons
由于蒸腾的估测值是通过干湿季试验日每个时刻实际测得的土壤/叶片水势差分别代入相应季节的蒸腾与水势差方程计算得到,因此,毫无疑问,蒸腾的估测值与实测值相关性较高(8月:R2=0.981,P<0.0001;11月:R2=0.928,P<0.0001),但是存在明显的干湿季节差异(P<0.0001),即湿季实测值为预测值的1.33倍,而干季的实测值为预测值的0.92倍(图9)。与湿季相比,干季土壤水分供应较低,在VPD较高时,气孔部分关闭以防过度失水,而此时适合生长的热量依然充足,因此,植物通过调节水力导度来平衡防止过分失水和有效利用光热资源的关系;而湿季水分供应充足,太阳辐射也较高,同时具备满足植物旺盛生长的水热条件,植物的蒸腾不受水热资源制约,因此出现实测值在干、湿季分别呈现出小于和大于预测值的情况。本结果显示干季树木蒸腾除受气孔导度的主导控制,还受到水力导度的协调控制。
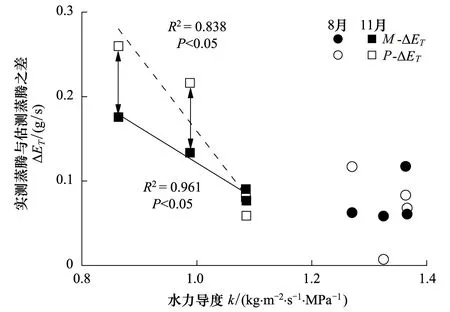
图10 荷木整树水力导度对蒸腾的补偿效应(13:00—17:00)(M-⊿ET为每隔1 h实测蒸腾变化量,P-⊿ET为每隔1h预测蒸腾变化量)Fig.10 Hydraulic compensation for transpiration of Schima superba during the time period of 13:00—17:00 (M-⊿ET and P-⊿ET represent the measured and predicted transpiration variation in every hour, respectively)
干季荷木的整树水力导度对整树蒸腾具有明显的补偿效应,其水力补偿效应出现在15:00—17:00,平均补偿值为0.08 g/s;湿季则未出现补偿效应(图10)。干季补偿效应的出现与VPD有较大关系,根据环境参数的记录,干季试验日VPD最高值(VPDmax)出现在14:50—15:00,为2.132 MPa,到17:00时降至1.917 MPa。可见,当VPD最大时,荷木的整树水力导度开始协同气孔导度对蒸腾产生限制作用,随着VPD进一步降至一定程度,气孔基本关闭,蒸腾几乎为零,水力导度的协同控制解除(2011年干季17:00时,经由Li- 6400测得的气孔导度几乎为0)。
3 讨论
本研究结果表明,华南地区的季节性降雨形成的干、湿季并未导致荷木的蒸腾产生明显差异,但是对产生蒸腾的水力生理造成了明显不同的影响。在湿季,水热充足,荷木的蒸腾主要受气孔导度调节;在干季,土壤水分供应减少,荷木整树蒸腾除了受气孔导度的控制,当空气水汽压亏缺达到一定程度,水力导度协同调节的作用变得明显。植物蒸腾对降雨不均引起的土壤水分减少的响应方式各异。如Fisher等[30]通过降雨再分配方法研究亚马逊连续2个干季的树干液流,发现去除50%降雨引起了土壤干旱,导致林分蒸腾年减少41%,最严重的甚至减少80%;挪威云杉(Piceaabies)对土壤水分含量的变化敏感,当土壤较为干旱时,有些树干的液流便不可测得[31];根系较深的桉树(Eucalyptuswandoo)对干旱/降雨则无显著响应[32];干旱亦未引起毛山核桃(Caryatomentosa)和白橡木(Quercusalba)等的蒸腾变化,但是加速生长季后的叶片衰老和凋落[33]。这些研究均表明,植物蒸腾对干旱的响应依赖于物种(生理)、环境(地理、气候)等各方面的因素。本文的研究结果显示,常绿阔叶树种荷木可以调节自身水力结构,降低对干旱的敏感性,适应干旱环境。
多环境因子交互协同调控森林蒸腾的研究已有一些报道,然而由于各种原因,并未取得一致结论[10,34]。如: Granier等[28, 35]研究发现21年生挪威云杉(Piceaabies)和热带雨林树干液流与水汽压亏缺的相关性高于与太阳辐射和气温等其他环境因子的相关性。紫玉兰树干液流主要受大气温度、空气相对湿度、总辐射、风速和水汽压亏缺的影响,而受土壤温湿度以及降水量的影响则较小[36]。Pataki等[37]研究了扭叶松(Pinuscontorta)、落基山冷杉(Abieslasiocarpa)、美洲山杨(Populustremuloides)和柔枝松(Pinusexilis)等4种植物对水汽压亏缺的敏感性,发现美洲山杨对VPD敏感性最高,扭叶松敏感性最低。本文的荷木是南亚热带的常见常绿阔叶树种,由于阔叶森林结构复杂,冠层与大气之间的水汽交换部分解耦联[13]。本研究显示,干、湿季荷木整树蒸腾均受到PAR和VPD的强烈控制,然而在不同季节,两者的控制程度有所不同,推测荷木的内在调节可能是造成不同控制程度的原因。因此,研究影响荷木蒸腾的因子时,需同时考虑气象因子和内在水力特征的协同作用。
对于水分在植物内运输的理解主要基于“内聚力张力”学说。由于水分输入(降雨)和输出(蒸腾+蒸发)的不平衡造成的土壤水分亏缺会改变植物水分的内聚力与张力,引起水力特征的变化[38]。研究表明,长期土壤水分亏缺造成的持续管胞/导管空穴化削弱了木质部水分传输能力,植物体内从木质部至叶片的水分传输中断,木质部机能失调,引起冠层干燥和顶梢枯死[38- 40]。然而,经过长期的适应性进化,植物会通过连续调整水力导度,从而保持自身水力张力与水力极限阈值的安全距离,避免引起水力灾变[41]。正因为如此,在土壤水分亏缺、PAR和VPD较高时,树木为了减少水分耗失,防止叶片水势低于最低阈值而引起水力张力过高,造成木质部灾变性的功能失衡,蒸腾与直接驱动力(即土壤/叶片水势差)之间并不总呈线性关系,气孔导度随VPD的上升也会往往呈非线性下降[21]。如马占相思(Acaciamangium)林冠蒸腾对VPD的响应模式呈现明显的两个阶段:当VPD<0.85 kPa,冠层蒸腾呈线性增加;当VPD>0.85 kPa,冠层蒸腾的变化是非线性的,并有所下降,表明此时气孔导度受水力导度的影响而对冠层蒸腾产生限制[10]。本研究基于液流密度扩展得到的蒸腾(实测值)与通过土壤-叶片水势差(ΨL-S)与ET的关系推算得到的蒸腾(估测值),并比较这两者,发现干湿季之间的实测与估测的ET并不遵循1∶1的关系,而是湿季低估了蒸腾,干季高估蒸腾,显示干季的蒸腾不仅受气孔导度的控制,在水汽压亏缺高达一定程度时,水力导度会协同气孔导度控制蒸腾。蒸腾估测值与实测值之间的差值可以量化水力导度的补偿效应,反映水力导度与气孔导度对整树蒸腾的协同控制。然而,至于不同VPD下产生的水力补偿值是不是常数,补偿值的大小与哪些因素有关,如树高、储存水、AL∶AS、根系的深度亦或其它,目前还未可知,有待今后进一步探索。
本文的水力补偿值是基于蒸腾实测值与估测值之间的差值计算得到。实际上,在用液流扩展的蒸腾值与ΨL-S进行回归的时候,所用的液流扩展的蒸腾值已经经过水力导度的补偿,所以本文计算得到的水力补偿值要小于实际补偿值。这一缺陷可通过建立冠层导度与蒸腾之间的关系,将实际蒸腾进行标准化,通过标准化后的实际蒸腾与估测蒸腾之间的差值得到改进。另外,McDowell[42]的关于树高的水力补偿模型认为,水力补偿过程主要通过垂直方向上ΨL-S和AL∶As的连续变化完成。本文在计算水力补偿值时,只考虑了补偿值与ΨL-S的线性关系,若将AL∶As也考虑进来,得到实测蒸腾与ΨL-S、AL∶As的二元一次或更高阶的方程,由此计算得到补偿值会更加准确。总之,本文是对量化水力补偿效应的一个尝试,未来还需更多的研究进行更正、深化。
整树水力导度体现了整树蒸腾和土壤/叶片水势差的线性关系,它一直处于连续的动态变化中,有时候随着蒸腾的增大而增大,有时候又滞后于水势差[43]。上述蒸腾与土壤/叶片水势差之间不总呈线性关系就是因为伴随着水力导度的调整。正是由于其不断变化,才保证木质部避免出现气穴化,而处于不断输送水分的状态。当水分供应减少时,ΨL-S降低,整树水力导度降低;水力导度的连续下降便将水分压力这一信号传递给气孔,有效增加气孔对于干旱的敏感性,增强在干旱环境中的适生能力[41]。本研究显示荷木的整树水力导度在干季午后明显下降,有效避免了由于VPD过高可能造成的气穴化,同时将水分供应减少的信号传递给气孔,使得气孔适度关闭,平衡适度失水和有效利用光热资源的关系。研究结果对于探索本地区主要造林树种耗水和需水规律,有效发挥森林保水功能具有重要的指导意义。
[1] Sperry J S, Adler F R, Campbell G S, Comstock J P. Limitation of plant water use by rhizosphere and xylem conductance: results from a model. Plant, Cell and Environment, 1998, 21(4): 347- 359.
[2] Ryan M G, Yoder B J. Hydraulic limits to tree height and tree growth. BioScience, 1997, 47(4): 235- 242.
[3] Tognetti R, Giovannelli A, Lavini A, Morelli G, Fragnito F, D′Andria R. Assessing environmental controls over conductance through the soil-plant-atmosphere continuum in an experimental olive tree plantation of southern Italy. Agricultural and Forest Meteorology, 2009, 149(8): 1229- 1243.
[4] Radin J W, Eidenbock M P. Hydraulic conductance as a factor limiting leaf expansion of phosphorus-deficient cotton plants. Plant Physiology, 1984, 75(2): 372- 377.
[5] Williams M, Bond B J, Ryan M G. Evaluating different soil and plant hydraulic constraints on tree function using a model and sap flow data from Ponderosa pine. Plant, Cell and Environment, 2001, 24(7): 679- 690.
[6] Martre P, North G B, Nobel P S. Hydraulic conductance and mercury- sensitive water transport for roots ofOpuntiaacanthocarpain relation to soil drying and rewetting. Plant Physiology, 2001, 126(1): 352- 362.
[7] Sala A. Hydraulic compensation in northern Rocky Mountain conifers: does successional position and life history matter? Oecologia, 2006, 149(1): 1- 11.
[8] 李吉跃, 翟洪波. 木本植物水力结构与抗旱性. 应用生态学报, 2000, 11(2): 301- 305.
[9] 刘晓燕, 李吉跃, 翟洪波, 朱国彬. 从树木水力结构特征探讨植物耐旱性. 北京林业大学学报, 2003, 25(3): 48- 54.
[10] 赵平. 整树水力导度协同冠层气孔导度调节森林蒸腾. 生态学报, 2011, 31(4): 1164- 1173.
[11] Oren R, Phillips N, Ewers B E, Pataki D E, Megonigal J P. Sap-flux-scaled transpiration responses to light, vapor pressure deficit, and lead area reduction in a floodedTaxodiumdistichumforest. Tree Physiology, 1998, 19(6): 337- 347.
[12] Pataki D E, Oren R, Phillips N. Responses of sap flux and stomatal conductance ofPinustaedaL. trees to stepwise reductions in leaf area. Journal of Experimental Botany, 1998, 49(322): 871- 878.
[13] Wullschleger S D, Wilson K B, Hanson P J. Environmental control of whole-plant transpiration, canopy conductance and estimates of the decoupling coefficient for large red maple trees. Agricultural and Forest Meteorology, 2000, 104(2): 157- 168.
[14] 朱丽薇, 赵平, 蔡锡安, 曾小平, 邹绿柳. 荷木树干CO2释放通量与木质部液流和CO2浓度的关系. 生态学杂志, 2009, 28(11): 2227- 2232.
[15] Campbell G S, Norman J M. An Introduction to Environmental Biophysics. 2nd ed. New York: Springer-Verlag, 1998: 36- 51, 221- 246.
[16] 周翠鸣, 赵平, 倪广艳, 朱丽薇, 王权, 梅婷婷, 张军彦, 蔡锡安. 基于树干液流和土壤-叶片水势梯度分析荷木干湿季整树水分利用特征. 生态学杂志, 2011, 30(12): 2659- 2666.
[17] 梅婷婷, 赵平, 王权, 蔡锡安, 余孟好, 朱丽薇, 邹绿柳, 曾小平. 基于液流格型特征值和标准化方法分析胸径和土壤水分对荷木液流的影响. 应用生态学报, 2010, 21(10): 2457- 2464.
[18] 王慧梅, 孙伟, 祖元刚, 王文杰. 不同环境因子对兴安落叶松树干液流的时滞效应复杂性及其综合影响. 应用生态学报, 2011, 22(12): 3109- 3116.
[19] Mencuccini M. The ecological significance of long-distance water transport: short-term regulation, long-term acclimation and the hydraulic costs of stature across plant life forms. Plant, Cell and Environment, 2003, 26(1): 163- 182.
[20] 赵平, 邹绿柳, 饶兴权, 马玲, 倪广艳, 曾小平, 蔡锡安. 成熟马占相思林的蒸腾耗水及年际变化. 生态学报, 2011, 31(20): 6038- 6048.
[21] Cochard H, Bréda N, Granier A. Whole tree hydraulic conductance and water loss regulation inQuercusduring drought: evidence for stomatal control of embolism. Annals of Forest Science, 1996, 53(2/3): 197- 206.
[22] Ritchie G A, Hinckley T M. The pressure chamber as an instrument for ecological research. Advanced Ecological Research, 1975, 9: 165- 253.
[23] Sellin A. Does pre-dawn water potential reflect conditions of equilibrium in plant and soil water status? Acta Oecologica, 1999, 20(1): 51- 59.
[24] 朱丽薇, 赵平, 蔡锡安, 曾小平, 邹绿柳, 王权. 荷木人工林蒸腾与冠层气孔导度特征及对环境因子的响应. 热带亚热带植物学报, 2010, 18(6): 599- 606.
[25] Tyree M T, Sperry J S. Vulnerability of xylem to cavitation and embolism. Annual Review of Plant Physiology and Plant Molecular Biology, 1989, 40(1): 19- 38.
[26] Irvine J, Perks M P, Magnani F, Grace J. The response ofPinussylvestristo drought: stomatal control of transpiration and hydraulic conductance. Tree Physiology, 1998, 18(6): 393- 402.
[27] Tognetti R, d′Andria R, Morelli G, Calandrelli D, Fragnito F. Irrigation effects on daily and seasonal variations of trunk sap flow and leaf water relations in olive trees. Plant and Soil, 2004, 263(1): 249- 264.
[28] Granier A, Claustres J P. Water relations of a Norway spruce (Piceaabies) tree growing in natural condition: variation within the tree. Acta Oecologica, 1989, 10(3): 295- 310.
[29] Cohen Y, Moreshet S, Fuchs M. Changes in hydraulic conductance of citrus trees following a reduction in wetted soil volume. Plant, Cell and Environment, 1987, 10(1): 53- 57.
[30] Fisher R A, Williams M, da Costa L, Malhi Y, da Costa R F, Almeida S, Meir P. The response of an Eastern Amazonian rain forest to drought stress: results and modelling analyses from a throughfall exclusion experiment. Global Change Biology, 2007, 13(11): 2361- 2378.
[31] Lagergren F, Lindroth A. Transpiration response to soil moisture in pine and spruce trees in Sweden. Agricultural and Forest Meteorology, 2002, 112(2): 67- 85.
[32] Burgess S S O. Measuring transpiration responses to summer precipitation in a Mediterranean climate: a simple screening tool for identifying plant water-use strategies. Physiologia Plantarum, 2006, 127(3): 404- 412.
[33] Pataki D E, Oren R. Species differences in stomatal control of water loss at the canopy scale in a mature bottom land deciduous forest. Advances in Water Resources, 2003, 26(12): 1267- 1278.
[34] 张雷, 孙鹏森, 刘世荣. 树干液流对环境变化响应研究进展. 生态学报, 2009, 29(10): 5600- 5610.
[35] Granier A, Huc R, Barigah S T. Transpiration of natural rain forest and its dependence on climatic factors. Agricultural and Forest Meteorology, 1996, 78(1/2): 19- 29.
[36] 王华, 欧阳志云, 郑华, 任玉芬, 高付元. 紫玉兰树干液流对北京市综合环境变量的响应. 应用生态学报, 2011, 22(3): 571- 576.
[37] Pataki D E, Oren R, Smith A W. Sap flow of co-occurring species in a western subalpine forest during seasonal soil drought. Ecology, 2000, 81(9): 2557- 2566.
[38] Lu P, Biron P, Granier A, Cochard H. Water relations of adult Norway spruce (Piceaabies(L.) Karst) under soil drought in the Vosges mountains: whole-tree hydraulic conductance, xylem embolism and water loss regulation. Annals of Forest Science, 1996, 53(1): 113- 121.
[39] Tributsch H. The water-cohesion-tension insufficiency syndrome of forest decline. Journal of Theoretical Biology, 1992, 156(2): 235- 267.
[40] Auclair A N D. Extreme climatic fluctuations as a cause of forest dieback in the Pacific rim. Water, Air, and Soil Pollution, 1993, 66(3/4): 207- 229.
[41] Sperry J S. Hydraulic constraints on plant gas exchange. Agricultural and Forest Meteorology, 2000, 104(1): 13- 23.
[42] McDowell N G, Phillips N, Lunch C, Bond B J, Ryan M G. An investigation of hydraulic limitation and compensation in large, old Douglas-fir trees. Tree Physiology, 2002, 22(11): 763- 774.
[43] Tsuda M, Tyree M T. Plant hydraulic conductance measured by the high pressure flow meter in crop plants. Journal of Experimental Botany, 2000, 51(345): 823- 828.
Hydraulic responses of whole tree transpiration ofSchimasuperbato soil moisture in dry and wet seasons
NI Guangyan, ZHAO Ping*, ZHU Liwei, NIU Junfeng, ZHAO Xiuhua, ZENG Xiaoping
KeyLaboratoryofVegetationRestorationandManagementofDegradedEcosystems,SouthChinaBotanicalGarden,ChineseAcademyofSciences,Guangzhou510650,China
The seasonal uneven distributions of precipitation results in significant difference of soil water content in subtropical forests of southern China. This potentially induces water stress in the dry season, which in turn may affect plant transpiration. In the present study, we intended to explore effects of environmental variables and plant hydraulic conductance on the whole tree transpiration (ET) ofSchimasuperba, a dominant tree species in subtropical forests, and paid a special attention to the mechanisms of hydraulic compensation for transpiration under water stress condition.ETwas determined from simultaneously measured stem sap flow using Granier′s thermal dissipation probes, and soil-leaf water potential difference (ΨL-S) was measured with the aid of a PMS pressure chamber on sunny days in dry (November 3 to 5) and wet seasons (August 21 and 22) of 2009. In addition, atmospheric evaporative demands and soil moisture conditions were monitored. The results showed that the rainfall seasonality brought about distinct soil moisture conditions between wet and dry seasons, but had no significant effect on theETofS.superba. It turned out thatETofS.superbawas significantly correlated to photosynthetically active radiation (PAR) and vapor pressure deficit (VPD) in both dry and wet seasons. However, in dry seasonETwas co-regulated by both stomatal and hydraulic conductance, whereasETwas mainly regulated by stomatal conductance in wet season possibly due to sufficient supply of water and radiation. Regression analyses ofETand soil-leaf water potential difference (ΨL-S) allowed the prediction ofETin both dry and wet seasons. A distinct discrepancy between predicted and measuredET(calculated from sap flow measurements) was found, i.e. the measuredETwas 91.74% of the predictedETin dry season, while in wet season measuredETwas 1.33 times higher than the predicted one. This revealed a hydraulic compensation forETthat usually occurred in the afternoon of the dry season (13:00—17:00), when VPD reached as high as 2.132 MPa, and the compensation value was calculated to be 0.08 g/s. The whole tree hydraulic conductance (k) decreased within the daytime in both dry and wet seasons; while it was generally lower in dry than wet season, especially in the morning (7:00—9:00) and afternoon (13:00—17:00), indicating higher hydraulic resistance during that time in dry season. Taken together, the present results suggested that the lower and continuously decreasingkin dry season especially in the afternoon when VPD was high, strengthened the water stress on leaves and increased the sensitivity of stomata to drought, which thus balanced the water loss and heat absorption and promoted plant survival under drought conditions. The dynamic variation ofkand subsequent hydraulic compensation may represent one of the reasons why subtropical broadleaf trees have potentially similarETin dry and wet seasons. The quantification of hydraulic compensation may be useful for a better understanding the interactive regulations of stomatal and hydraulic conductance onET. Our results would also be helpful to evaluate the ecological functions of subtropical forests in southern China, in terms of water conservation under the background of seasonal uneven precipitations.
transpiration; whole tree hydraulic conductance; soil-to-leaf water potential; hydraulic compensation;Schimasuperba
国家自然科学基金(41030638, 31200380, 41275169);广东省自然科学基金(S2012020010933, S2011040000331)
2013- 05- 07;
日期:2014- 04- 03
10.5846/stxb201305070962
*通讯作者Corresponding author.E-mail: zhaoping@scib.ac.cn
倪广艳,赵平,朱丽薇,牛俊峰,赵秀华,曾小平.荷木整树蒸腾对干湿季土壤水分的水力响应.生态学报,2015,35(3):652- 662.
Ni G Y, Zhao P, Zhu L W, Niu J F, Zhao X H, Zeng X P.Hydraulic responses of whole tree transpiration ofSchimasuperbato soil moisture in dry and wet seasons.Acta Ecologica Sinica,2015,35(3):652- 662.
