温度和盐度对西藏拟溞抗氧化酶和脂质过氧化作用的影响
2015-03-10亢玉静
亢玉静,赵 文,魏 杰
大连海洋大学 水产与生命学院,辽宁省水生生物学重点实验室,大连 116023
温度和盐度对西藏拟溞抗氧化酶和脂质过氧化作用的影响
亢玉静,赵 文*,魏 杰
大连海洋大学 水产与生命学院,辽宁省水生生物学重点实验室,大连 116023
采用实验生态学方法,研究了温度(T=16、19、22、25、28℃)、盐度(S=5、10、15、20、25)对西藏拟溞总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-PX)活力以及脂质过氧化产物丙二醛(MDA)含量的影响。结果表明:温度和盐度能够诱导西藏拟溞抗氧化应激反应,胁迫24h后,SOD、GPX活性及MDA含量在28℃、盐度20时均达到最高值,分别为(37.18±1.97) U mg-1μg-1、(75.1±9.96) U mg-1μg-1和(12.24±2.12) nmol mg-1μg-1;48h后,高温低盐组(25—28℃、5—10)和高温高盐组(25—28℃、20—25)SOD、GPX活性及MDA含量显著高于其他处理组(P<0.05),在28℃,盐度5时均达到最大值,分别为(19.25±3.48) U mg-1μg-1、(59.95±4.66) U mg-1μg-1和(4.98±0.66) nmol mg-1μg-1;温度、盐度以及这两个因子之间对西藏拟溞体内SOD、GPX活性和MDA含量均有极显著影响(P<0.01)。
西藏拟溞;温度;盐度;总超氧化物歧化酶;谷胱甘肽过氧化物酶;丙二醛
西藏拟溞(DaphniopsistibetanaSars,1903)隶属溞科(Daphniidae)拟溞属Daphniopsis,是一种冷水性盐水枝角类,在我国主要分布于西藏、青海、新疆等高海拔、高寒、贫营养型盐水水体。分布水体多为碳酸盐型,水温-2—18℃、盐度2.7—35、pH8.7—10.4[1- 6]。枝角类作为海洋经济动物养殖中的一种新的活饵料,国内外学者已对其进行了一系列的研究,其中蒙古裸腹溞(MoinamongolicaDaday)在海水中的大量培养和投喂试验获得了一定的成效[1],但该溞属喜暖性种类,在北方低水温期培养需升温而有其局限性,而西藏拟溞虽发育期比较长,繁殖力也低于蒙古裸腹溞,但仍高于海产桡足类,其耐低温性可弥补上述缺憾,比较适合北方多数海产鱼、虾类育苗期的水温条件,有望成为海水鱼、虾苗种阶段的活饵料[7]。目前,国内外对西藏拟溞的自然分布[1]、生物学特征[1]、形态构造[8]、生活习性[9]、染色体核型[10]、耗氧率[7]和排氨率[11]等方面进行了研究,但有关于西藏拟溞对环境因子(温度、盐度、pH等)胁迫的生物抗性与细胞内保护酶系统的研究尚未见报道。环境胁迫可造成机体自由基代谢紊乱,体内活性氧含量及抗氧化酶活性发生变化,产生应激反应,若长期处于应激状态会导致机体免疫防御能力下降,从而影响生物正常生长。抗氧化酶具有消除机体氧自由基的功能,对增强吞噬细胞防御能力和机体免疫功能有重要作用[12]。因此,研究西藏拟溞抗氧化效应对于探索其环境适应机制和提高机体抗氧化免疫能力具有重要意义。本文研究了温度和盐度对西藏拟溞总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GPX)活力以及脂质过氧化产物丙二醛(MDA)的影响,旨在为西藏拟溞室内驯化及规模化培养条件、作为海水环境监测生物的可行性提供参考。
1 材料与方法
1.1 试验材料
试验所用的西藏拟溞系于2007年6月采自西藏那曲的纳木卡错,驯化培养于盐度15的稀释海水中,以混合饵料为食物。试验前挑选300只相对同步、体格健壮的带卵成溞,在温度16℃、盐度为15的稀释海水中培养,待孤雌生殖第一代后,将幼溞挑出,继续培养幼溞,如此反复,以获得试验所需的同步性良好的成溞,避免由于个体差异对试验结果产生影响。
1.2 试验条件
试验用水来源于大连黑石礁近海,经沉淀、砂滤、300目筛绢网过滤、煮沸消毒,用纯水调整到试验所需盐度。所有试验均用250mL烧杯,装入200 mL培养液,每烧杯放入成溞20只。温度以光照培养箱控制,光照强度为1500lx,光周期为12 L∶12 D。培养期间用混合饵料(蛋白核小球藻(Chlorellapyrenoidosa):盐生杜氏藻(Dunaliellasalina):牟氏角毛藻(Chaetocerosmuelleri):湛江等鞭金藻(Isochrysiszhanjiangensis)=1∶1∶1∶2)作为饵料投喂。将配好的饵料,用淡水稀释1倍后进行投喂,饵料浓度约为8.5—9.5×106个/mL。试验所用个体均为20日龄成溞,其平均体长为(1.75±0.05) mm。
1.3 试验设计
根据西藏拟溞对温度及盐度的耐受范围,本试验设计温度分为16、19、22、25℃和28℃,盐度分为5、10、15、20、25五个梯度,胁迫时间为24h和48h,共50个处理组,每一处理组设置3个重复。将在温度16℃,盐度15下培养出来的同步成溞(平均体长为(1.75±0.05)mm)放入250mL烧杯,每个烧杯20只,培养液200mL,试验在光照培养箱中进行,温度变幅在±0.5℃以内,试验过程中不投饵。试验结束后,将溞从烧杯中挑出,用滤纸吸除体表的水分,放入2mL离心管中,经电子天平称得最终体质量(精确至0.0001g)。
1.4 粗酶液制备
用移液枪量取0.5mL预冷(4℃)的匀浆介质(pH 7.36,浓度0.01mol/L 的PBS缓冲液)加入装有溞体的2mL离心管中,在冰浴的条件下进行超生波破碎(400安培,5s每次,间隔10s反复3—5次),低温高速离心(4℃,10000r/min,10min),上清液备用。
1.5 酶活测定
采用南京建成生物工程研究所生产的试剂盒测定T-SOD、GPX活性和MDA、蛋白质含量,操作步骤按试剂盒说明进行。
SOD活性的测定 采用黄嘌呤氧化酶法测定,SOD活性定义:每毫克组织蛋白在1mL反应液中SOD抑制率达50.0%时所对应的SOD量为1个SOD活力单位(U)。
GPX活性的测定 采用二硫代二硝基苯甲酸(DTNB)消耗法测定,GPX活性定义:每毫克蛋白质,每分钟扣除非酶反应的作用,使反应体系中GSH浓度降低1μmol/L为1个酶活力单位(U)。
MDA含量的测定 采用硫代巴比妥酸法测定,过氧化脂质降解产物中的丙二醛(MDA)可与硫代巴比妥酸(TBA)缩合,形成红色产物,在532nm处有最大吸收峰,从而计算MDA含量。
可溶性蛋白含量的测定 采用考马斯亮蓝法测定蛋白质含量。
1.6 数据处理
采用SPSS18.0统计软件进行数据处理和分析。数据结果为平均值±标准误差(Mean±S.D.)表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 温度和盐度对西藏拟溞SOD活性的影响

图1 温度和盐度对西藏拟溞SOD活性的影响Fig.1 Effect of temperature and salinity on the SOD activity of Daphniopsis tibetana Sars小写字母不同表示同一盐度下不同温度处理组差异显著(P<0.05);大写字母不同表示同一温度下不同盐度处理组差异显著(P<0.05); SOD:超氧化物歧化酶 Superoxide dismutase
温度和盐度对西藏拟溞SOD活性的影响示于图1。从图1可见,温度和盐度对西藏拟溞体内SOD活性均有显著影响(P<0.05)。胁迫24h后,同一盐度下,西藏拟溞SOD活性随着温度的升高而升高,25℃和28℃与其他处理组相比,差异显著(P<0.05),在温度28℃、盐度20时SOD活性最高,为(37.18±1.97) U mg-1μg-1,其中盐度为15时,随着温度的升高,西藏拟溞SOD活性变化不明显,范围(1.67±0.76)—(3.27±0.1) U mg-1μg-1。而在温度分别为25℃、28℃时,随着盐度的升高,溞体内SOD活性变化幅度较为明显,其范围分别为(3.27±0.1)—(10.78±2.98) U mg-1μg-1,(1.67±0.76)—(37.18±1.97) U mg-1μg-1;在低温组,随着盐度的升高其SOD活性变化较小。胁迫48h后,西藏拟溞SOD活性随着温度和盐度的改变与24h有相同的趋势,在盐度5,28℃时,SOD活性达到最高(19.25±3.48) U mg-1μg-1,在相同温度、盐度条件下,随着胁迫时间的延长,西藏拟溞SOD活性变化不明显(图1)。
2.2 温度和盐度对西藏拟溞GPX活性的影响
温度和盐度影响西藏拟溞体内GPX活性(图2)。胁迫24h后,当盐度为20及25时,随着温度的升高,西藏拟溞体内GPX活性呈先降低后升高的趋势,变化较为明显,其范围分别(7.92±2.75)—(75.1±9.96) U mg-1μg-1、(8.07±0.98)—(31.65 ±1.7) U mg-1μg-1,而其他处理组GPX活性随着温度的升高而呈现先降低后升高再降低的趋势;同一温度下,随着盐度的升高,溞体内GPX活性呈现先升高后降低的趋势。在温度28℃,盐度20时达到最高值(75.1±9.96) U mg-1μg-1,其中温度为16℃时,随着盐度的升高,GPX活性变化不明显。胁迫48h后,同一盐度下,西藏拟溞GPX活性随着温度的升高呈先降低后升高趋势,盐度5,温度25℃和28℃时,GPX活性显著高于其他处理组(P<0.05);同一温度下,盐度的升降能够引起GPX活性的显著改变(P<0.05)。在相同的温度、盐度条件下,随着胁迫时间的延长,高温低盐组(25—28℃、5—10)GPX活性显著增强,其他处理组变化不明显(图2)。
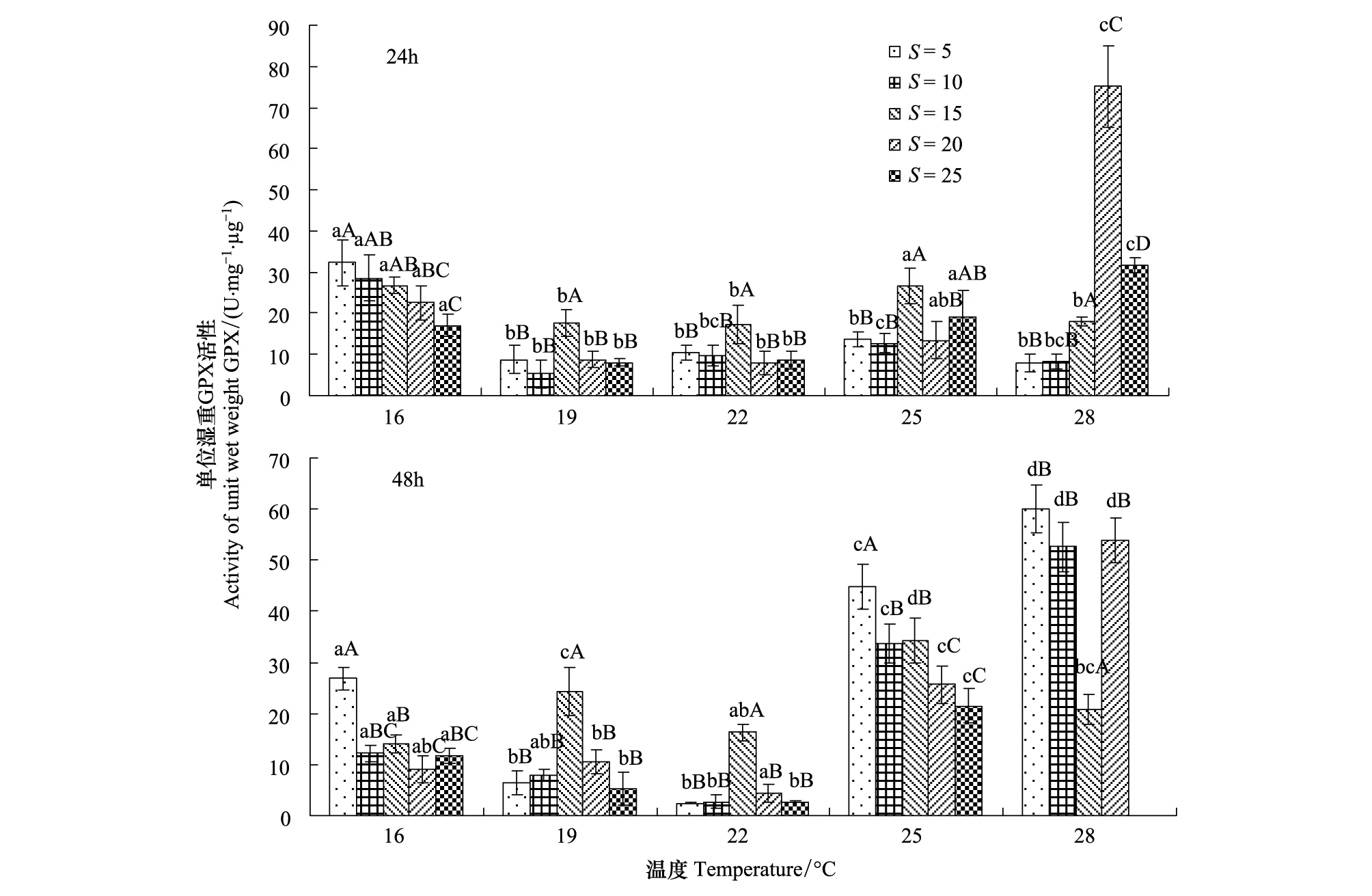
图2 温度和盐度对西藏拟溞GPX活性的影响Fig.2 Effect of temperature and salinity on the GPX activity of Daphniopsis tibetana SarsGPX:谷胱甘肽过氧化物酶Glutathione peroxidase
2.3 温度和盐度对西藏拟溞MDA含量的影响
温度和盐度对西藏拟溞MDA含量有显著影响(P<0.05)(图3)。胁迫24h后,同一盐度,MDA含量随着温度的升高呈先降低后升高的趋势,其中,当温度为28℃,盐度为20时MDA含量最高(12.24±2.12) nmol mg-1μg-1;最小值为(0.26±0.02) nmol mg-1μg-1,对应的温度为22℃,盐度25。另外,盐度为20时,MDA含量随着温度的升高而升高的幅度最大,范围(0.43±0.13)—(12.24±2.12) nmol mg-1μg-1,盐度为15时,溞体内MDA含量随着温度超过25℃而急剧降低(3.41±0.53)—(0.74±0.1) nmol mg-1μg-1;同一温度下,MDA含量随着盐度的升高而先升高后降低,温度为16℃时,随着盐度的升高,溞体内MDA含量变化不明显。胁迫48h后,同一盐度,随着温度的升高MDA含量先降低后升高,盐度15时,MDA含量随着温度的升高变化不明显;高于16℃,同一温度下,随着盐度的升高,MDA含量均有显著变化(P<0.05),在28℃,盐度为5时达到最高值(4.98±0.66) nmol mg-1μg-1。在相同温度、盐度下,随着时间的延长,在高温组(25—28℃)盐度改变,MDA含量有所降低,其他处理组变化不明显,其中在28℃,盐度为25时,西藏拟溞全部死亡(图3)。
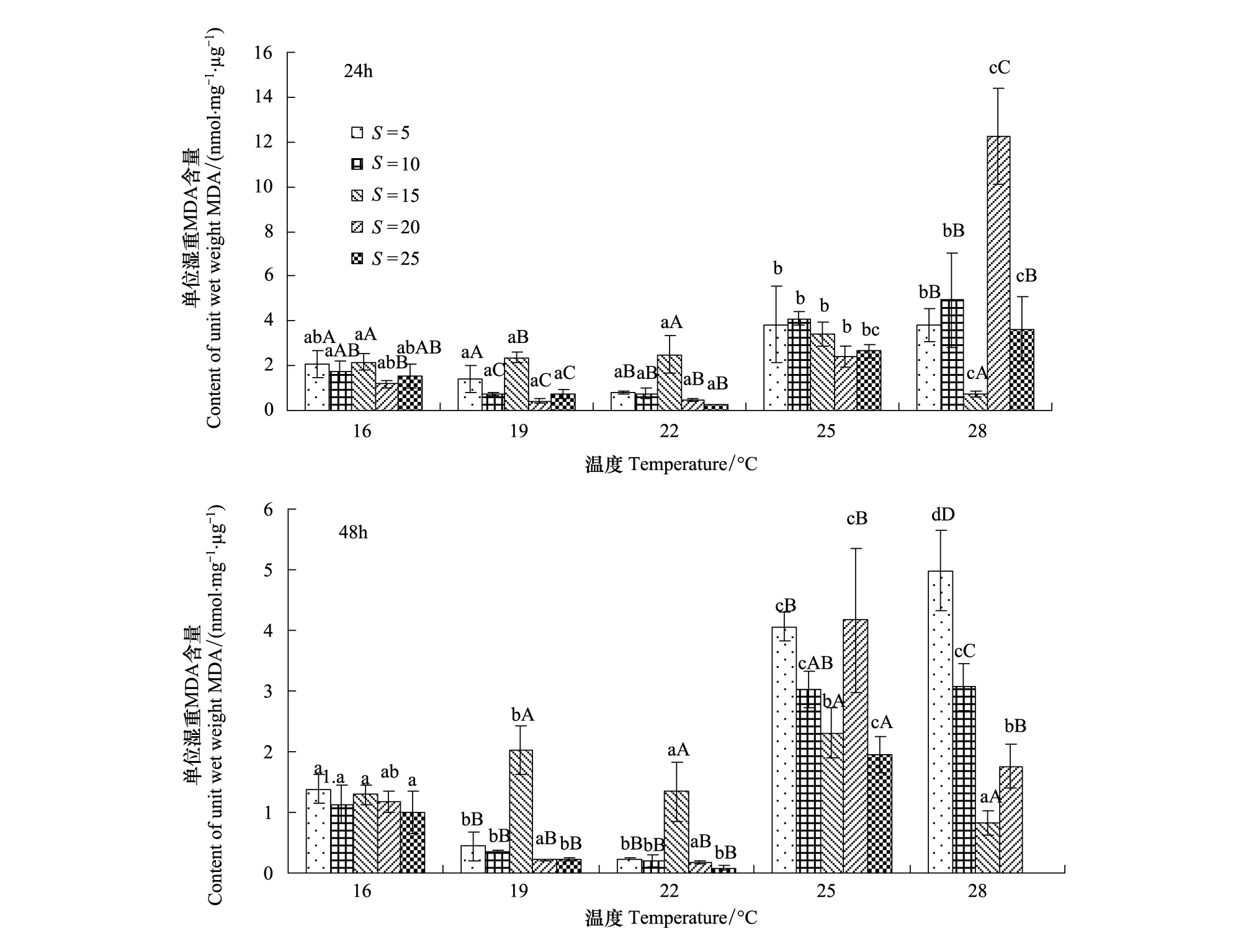
图3 温度和盐度对西藏拟溞MDA含量的影响Fig.3 Effect of temperature and salinity on the MDA content of Daphniopsis tibetana SarsMDA:丙二醛Maleic dialdehyde
2.4 西藏拟溞体内抗氧化酶活性方差分析
由表1统计分析结果所示,经双因子方差分析,温度、盐度以及这两个因子之间的交互作用对西藏拟溞SOD、GPX活性和MDA含量影响极显著(P<0.01)。

表1 温度和盐度对西藏拟溞SOD、GPX活性和MDA含量影响的统计分析结果Table 1 Results of two-way ANOVA of the SOD、GPX and MDA for Daphniopsis tibetana Sars in different temperature and salinity
**为差异极显著(P<0.01)
3 讨论
3.1 温度和盐度对西藏拟溞抗氧化酶和脂质过氧化作用的影响
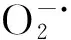
盐度作为影响海洋无脊椎动物生存、生长和发育的一个重要环境因子,能够直接影响动物体内渗透压和离子浓度的调节[17]。西藏拟溞是一种能进行低渗和高渗双向调节的广盐性盐水枝角类,调节机制较为复杂。王巧晗等[15]通过盐度(5、10、15、20、25)对西藏拟溞存活、生长、繁殖的影响发现,盐度10,15组生长最快,寿命长于其他组,说明在最适盐度范围内,机体体内各器官的活动代谢处于平衡状态,盐度改变能够影响西藏拟溞的生长发育。赵文等人曾在实验室条件下设置盐度5、10、15、20和25测定西藏拟溞耗氧率[7]、排氨率[11]。结果表明,该溞的个体耗氧率(IO)、比耗氧率(SO)及排氨率(NR)均随盐度升高而升高,说明随着盐度的升高,西藏拟溞的呼吸代谢增强。本试验结果发现,GPX活性和MDA含量变化趋势相同,随着盐度的升高呈先上升后下降趋势,在盐度20时达到最大值,而SOD活性随着盐度的升高呈先降低后上升趋势,在盐度15时达到最小值,说明盐度的升降能够引起西藏拟溞体内抗氧化酶及MDA含量的变化。有研究表明,抗氧化酶活力能够随代谢率和耗氧率的增加而升高[18],本试验结果与之相符,外界盐度的改变,使西藏拟溞体内产生过多的活性氧自由基,为保护体内细胞免受氧化损伤,抗氧化酶活力升高。GPX活性变化趋势与SOD活性相反,说明在低盐度条件下GPX发挥主要作用,在高盐度下SOD起主导作用,这可能与西藏拟溞对于低渗和高渗调节的机制有关。在低盐度下,机体出现了一定的氧化损伤,可能是因为西藏拟溞对低盐度较为敏感,体内产生的大量活性氧自由基超过了抗氧化酶的清除能力。在高盐度下,MDA含量有所降低,可能是由于SOD的大量合成,清除了机体产生的大部分氧自由基,因而细胞内生成的脂质过氧化物较少,对西藏拟溞的氧化损伤有所降低。通过目前对西藏拟溞所做的研究发现,尽管西藏拟溞能够在低盐以及高盐条件下生长一段时间,但是会导致机体自由基代谢紊乱,影响其健康生长发育。
3.2 温度和盐度交互作用对西藏拟溞抗氧化酶和脂质过氧化作用的影响
以往的研究多集中于温度和盐度对西藏拟溞生长生殖的影响,关于温盐交互作用对其抗氧化酶的研究还尚未见报道。通过本试验统计分析结果显示,温度、盐度以及两个因子交互作用对西藏拟溞体内SOD、GPX活性和MDA含量均有极显著影响(P<0.01),说明西藏拟溞体内抗氧化酶活力不仅与温度密切相关,还与盐度有关。在本研究范围内,温度16℃时,随着盐度的改变以及胁迫时间的延长,西藏拟溞体内抗氧化酶活性和MDA含量变化相对不明显,可能是与温度较低有关;在19—22℃,低盐或是高盐条件下,西藏拟溞体内SOD、GPX活性以及MDA含量均相对较低,这与王巧晗等[15]的相关研究结果不一致,分析其原因是经过多年的实验室条件驯化,随着四季温度的改变,遗传基因可能有所变化,改变了原始的特性;通过本试验还发现,随着胁迫时间的延长,高温低盐环境下,西藏拟溞体内SOD、GPX活性以及MDA含量均有明显增加,在高温高盐环境(28℃,盐度25)下,西藏拟溞全部死亡,说明超过一定的温度盐度后,随着时间的延长,虽然机体内抗氧化酶活性增强,但是仍然无法避免机体损伤甚至造成死亡现象。
在试验过程中选择不投饵,是因为考虑到饵料生物体内也含有SOD、GPX和MDA,而温度和盐度的改变也会影响西藏拟溞的摄食率,从而可能会导致机体内的生理生化指标发生变化,通过预实验发现,西藏拟溞在饥饿48h后仍然能够进行正常的生理活动,因此为了避免饵料对结果的影响,选择试验过程中不投饵。
综上,通过本试验可以反映出西藏拟溞体内SOD、GPX活性以及MDA含量能够反映对水体温度和盐度的敏感性。结果发现,高温条件下,盐度改变能够引起SOD、GPX活性和MDA含量的显著升高,随着时间的延长,低温条件下,盐度的改变,西藏拟溞SOD、GPX活性以及MDA含量较少,高温低盐及高温高盐促进了GPX的合成,但同时也增加了MDA含量,说明对机体造成了一定的氧化损伤,在28℃,盐度25胁迫48h后,西藏拟溞全部死亡。由此可以看出,西藏拟溞对低温条件下盐度的升降有更强的适应能力,能够存活一段时间;而对高温条件下,盐度的大幅度改变的适应力较差。西藏拟溞在短时间内能够通过调动体内抗氧化酶活性等生理机制来缓解对外界环境的改变,但是随着温度的升高以及盐度的改变,机体各机能会受到抑制,从而影响其生长发育乃至存活。因此,在今后大规模培养的过程中应避免长时间的温度升高以及盐度的大幅度升降,要注意保持水体温度和盐度的稳定。通过本试验对西藏拟溞在温度和盐度胁迫不同时间后生理变化的研究,为环境因子对其他枝角类抗氧化酶系统的影响提供了数据和资料,并且为今后做较为系统的研究奠定了基础。
[1] 赵文, 王巧晗, 郑绵平, 赵元艺, 王海雷. 西藏拟溞生物学的初步研究. 大连水产学院学报, 2002, 17(3): 209- 214.
[2] 蒋燮治, 堵南山. 中国动物志. 淡水枝角类. 北京: 科学出版社, 1979: 297- 297.
[3] 蒋燮治, 沈韫芬, 龚循矩. 西藏无水无脊椎动物. 北京: 科学出版社, 1983: 443- 492.
[4] 赵文. 内陆盐水水体枝角类研究述评. 大连水产学院学报, 1991, 6(2): 31- 41.
[5] 赵文, 姜宏, 何志辉. 三北地区内陆盐水的浮游甲壳类. 大连水产学院学报, 1996, 11(1): 1- 13.
[6] 沈嘉瑞, 宋大祥. 西藏枝角类的初步研究. 动物学报, 1964, 16(1): 61- 69.
[7] 赵文, 张琳, 霍元子. 温度、盐度和体长对西藏拟溞耗氧率的影响. 生态学报, 2005, 25(7): 1549- 1553.
[8] 赵文, 王巧晗. 西藏拟溞形态构造的再描述. 大连水产学院学报, 2005, 20(3): 165- 173.
[9] Manca M, Carnmarano P, Spagnuolo T. Notes on Cladocera and Copepoda from high altitude lakes in the Mount Everest Region (Nepal). Hydrobiologia, 1994, 287(3): 225- 231.
[10] 赵文, 张鹏, 霍元子, 王海雷. 西藏拟溞的染色体核型研究. 大连水产学院学报, 2004, 19(3): 167- 170.
[11] 赵文, 梁萧, 谢玺, 张琳, 魏杰. 温度、盐度和体长对西藏拟溞 (DaphniopsistibetanaSars) 排氨率的影响. 生态学报, 2008, 28(12): 6385- 6389.
[12] Rudneva I J. Blood antioxidant system of Black Sea elasmobranch and teleost. Comparative Biochemistry and Physiology, 1997, 118C(2): 255- 260.
[13] 孔繁翔. 环境生物学. 北京: 高等教育出版社, 2002: 55- 55.
[14] 吕庆, 郑容梁. 干旱及活性氧引起小麦膜脂过氧化与脱脂化. 中国科学(C辑), 1996. 26(1): 26- 30.
[15] 王巧晗. 温度和盐度对西藏拟溞 (Daphniopsistibetana) 存活、生长、发育和生殖的影响 [D]. 大连: 大连水产学院, 2004.
[16] 刘鸿艳, 郑曙明, 吴青, 刘代金, 蒋礼, 贺蓉, 张耀光. 隆线溞营养成分分析及高温胁迫对抗氧化酶活性的影响. 淡水渔业, 2012, 42(5): 45- 48.
[17] Estudillo C B, Duray M N, Marasigan E T, Emata A C. Salinity tolerance of larvae of the mangrove red snapper (Lutjanusargentimaculatus) during ontogeny. Aquaculture, 2000, 190(1/2): 155- 167.
[18] Fjlho D W, Boveris A. Antioxidant defences in marine fish-II Elasmobranchs. Comparative Biochemistry and Physiology, 1993, 106(2): 415- 418.
Effects of temperature and salinity on the activities of antioxidant enzymes and lipid peroxidation ofDaphniopsistibetanaSars
KANG Yujing, ZHAO Wen*, WEI Jie
CollegeofFisheriesandLifeScience,KeyLaboratoryofHydrobiologyinLiaoningProvince,DalianOceanUniversity,Dalian116023,China
The experiment was designed to evaluate the effects of temperature (16,19,22,25,28℃) and salinity (5,10,15,20,25) on the activity of total superoxide dismutase(T-SOD), glutathione peroxidase(GSH-PX) and maleic dialdehyde (MDA) ofDaphniopsistibetanaSars by means of the experimental ecology method under the laboratory conditions. The results showed that stress responses to temperature and salinity were induced in theD.tibetana.The activities of SOD,GPX and the content of MDA increased with temperature and salinity raised. After 24h-stress, the maxima were (37.18±1.97)U mg-1μg-1,(75.10±9.96)U mg-1μg-1and (12.24±2.12)nmol mg-1μg-1, respectively, when the temperature and salinity simultaneously reached 28℃ and 20;48 hours later, the activities of SOD,GPX and the content of MDA in the groups of high temperature of 25 and 28℃ except for those held at salinity of 15 were significantly higher than the others. While the maxima of (19.25±3.48)U mg-1μg-1, (59.95±4.66)U mg-1μg-1, (4.98±0.66)nmol mg-1μg-1, respectively,were observed in the group of temperature of 28℃ and salinity of 5. The above results indicated that there were significant affects of temperature and salinity on the antioxidant enzymatic activities(SOD, GPX) and lipid peroxidation(MDA) inD.tibetana(P<0.01).
DaphniopsistibetanaSars; temperature; salinity; total superoxide dismutase; glutathione peroxidase; maleic dialdehyde.
国家自然科学基金项目(31072210,40776065)
2013- 05- 05;
日期:2014- 04- 11
10.5846/stxb201305050925
*通讯作者Corresponding author.E-mail: zhaowen@dlou.edu.cn
亢玉静,赵文,魏杰.温度和盐度对西藏拟溞抗氧化酶和脂质过氧化作用的影响.生态学报,2015,35(4):1037- 1044.
Kang Y J, Zhao W, Wei J.Effects of temperature and salinity on the activities of antioxidant enzymes and lipid peroxidation ofDaphniopsistibetanaSars.Acta Ecologica Sinica,2015,35(4):1037- 1044.
