太湖岸带湿地土壤动物群落结构与多样性
2015-03-10崔丽娟赵欣胜张曼胤高常军王义飞
李 伟, 崔丽娟,*, 赵欣胜, 张曼胤, 高常军,张 岩, 王义飞
1 中国林业科学研究院湿地研究所,北京 100091 2 湿地生态功能与恢复北京市重点实验室,北京 100091
太湖岸带湿地土壤动物群落结构与多样性
李 伟1,2, 崔丽娟1,2,*, 赵欣胜1,2, 张曼胤1,2, 高常军1,2,张 岩1,2, 王义飞1,2
1 中国林业科学研究院湿地研究所,北京 100091 2 湿地生态功能与恢复北京市重点实验室,北京 100091
土壤动物是湿地生态系统物质循环和能量流动的关键环节,也是湿地生态系统演化的重要驱动因子。2010年4月—2011年2月研究了太湖岸带湿地4种生境类型(A酸模岸带、B乔灌岸带、C农作物岸带、D天然芦苇岸带)中的土壤动物群落结构和多样性。4次调查共分离到土壤动物3575只,隶属4门12纲,共有105类,土壤动物群落密度达到2794.49—67766.39 个/m2。在大类群中,节肢动物门(Arthropoda)为优势类群,占总个体数的55.75%,其次为线虫动物门(Nematoda),占总个体数的36.27%;节肢动物门和线虫动物门构成了该区土壤动物的主体,对土壤动物群落特征起着决定性作用。土壤动物群落各多样性指数的季节变化动态不同,Pielou均匀度的方差分析表明:2010年4月份类型A与类型C之间存在显著性差异(P<0.05);而Shannon多样性方差分析表明:2011年2月份类型A与C、D存在显著性差异(P<0.05)。土壤动物的整体数量表现为2010年4月>2010年11月>2010年8月>2011年2月。Sorensen和Morisita-Horn相似性分析说明不同生境类型对土壤动物物种丰度产生了不同的影响。太湖岸带湿地土壤动物个体数量在垂直分布上均有一定的表聚性,但不同季节表聚性程度不同。研究结果可为太湖岸带湿地的健康评价及科学管理提供理论依据。
太湖; 土壤动物; 群落结构; 生物多样性
土壤动物是湿地生态系统的重要组成部分,在物质循环、能量流动和生态指示等方面发挥了重要作用[1- 6],其对土壤微生物及土壤结构等具有调节作用。针对湿地土壤动物群落结构和多样性进行研究具有极其重要的现实意义[7- 8]。土壤动物与植被类型具有密切的联系[9- 10],植被类型可以通过改变微气候和土壤养分的空间分布以及构建多样化的生境类型来影响土壤动物群落组成、丰富度和密度等[11- 14]。植物群落可为土壤动物提供食物来源,满足其生长发育需要,还可以为土壤动物提供适宜的栖息环境,从而形成对土壤动物至上而下的控制机制[9,12,14]。
太湖是长江中下游著名五大淡水湖之一,属于我国重点控制的“三湖治理”之一。近年来由于流域经济社会的快速发展和不合理的开发利用导致太湖水质恶化,富营养化趋势明显,生态系统急剧退化,长期以来,太湖岸带作为防洪大坝不断被加高、加固,太湖岸带硬质化比较严重,太湖岸带湿地生态系统的结构破坏严重,造成生境恶化、生态功能退化等问题[15]。目前,关于太湖湿地生态系统的研究主要集中在太湖水质[16],水生植被[17],生态系统健康评价[18]以及太湖湖体蓝藻[19],对太湖湿地土壤动物群落区系组成的研究极少。这严重影响到对太湖岸带湿地地下食物网及重要生态过程的认识,甚至在一定程度上影响到对退化湿地的生态恢复。因此,有必要对太湖岸带湿地土壤动物群落结构与多样性进行研究。
本研究以太湖岸带湿地不同植被类型的岸带为研究对象,通过对土壤动物群落的观测,旨在查明太湖岸带湿地的土壤动物区系组成及季节变化特征。分别选取有类似的土壤状况及背景历史的岸带区域,其分别为A(酸模岸带)、B(乔灌岸带)、C(农作物岸带)、D(天然芦苇岸带)。研究了解:1)太湖岸带湿地土壤动物群落组成及差异;2)太湖岸带湿地土壤动物群落密度及多样性时间变化。研究结果不仅可以提供太湖岸带湿地土壤动物多样性方面的基础资料,还能为太湖岸带湿地的健康评价及科学管理提供理论依据。
1 研究区概况
研究区位于太湖东部沿岸岸带,平均海拔4 m左右,优势物种主要包括芦苇(Phragmitesaustralis)、芦竹(Arundodonax)、香蒲(Typhaorientalis)、喜旱莲子草(Alternantheraphiloxeroides)、水蓼(Polygonumhydropiper)、葎草(Humulusscandens)和酸模(Rumexacetosa)等。其中,酸模岸带(A)靠近太湖湿地公园,主要由酸模、葎草、稗(Echinochloacrusgalli)、飞蓬(Erigeronacer)、狗尾草(Setariaviridis)、藜(Chenopodiumalbum)和酸模叶蓼(Polygonumlapathifolium)等物种组成;乔灌岸带(B)主要由柽柳(Tamarixchinensis)、垂柳(Salixbabylonica)、喜旱莲子草、芦苇、菰(Zizanialatifolia)、香蒲、假稻(Leersiajaponica)、苦荬菜(Ixerispolycephala)、铁苋菜(Acalyphaaustralis)、酸模叶蓼和菟丝子(Cuscutachinensis)等物种组成;农作物岸带(C)主要是当地居民在岸带区开辟种植地进行农作物的栽种,主要物种包括番薯(Ipomoeabatatas),芝麻(Sesamumindicum)和豆类等作物,伴生植物包括葎草和灰绿藜(Chenopodiumglaucum)等;天然芦苇岸带(D)主要以芦苇和喜旱莲子草为优势种,伴生物种包括芦竹、野大豆(Glycinesoja)、荠(Capsellabursa-pastoris)、葎草和萝藦(Metaplexisjaponica)等。
2 研究方法
2.1 土壤动物取样和鉴定
2010年4月、8月、11月及2011年2月,在太湖岸带湿地调查取样,每个研究样地选取5个样方,分3个土壤层(Ⅰ:0—5 cm;Ⅱ:5—10 cm;Ⅲ:10—15 cm)用直径为5.4 cm,体积115 mL圆形取样器进行中小型土壤动物采样。对应3个土壤层次,在每个样点内选取20 cm×20 cm×5 cm的大样各1个。
利用手拣法野外分离大样,并放入75%的酒精内进行固定,带回实验室利用大类别分类法进行分类鉴定[20]。采用体视显微镜(Olympus SZX16)对分离出来的土壤动物进行鉴定并统计数量。实验室内采用湿漏斗法(Baermann法)和干漏斗法(Tullgren法)分离中小型土壤动物,其分离时间分别是48 h和24 h。其中,湿漏斗法可以分离到水生或湿生土壤动物;干漏斗法可以采集到以土壤微小节肢动物为主的大部分中型土壤动物。分离的土壤动物根据《中国土壤动物检索图鉴》[21]在光学显微镜(Leica DM 4000 B)和体视显微镜(Olympus SZX16)下进行分类鉴定,并进行数量统计。
2.2 数据分析
选择Simpson优势度指数、Shannon-Wiener多样性指数和Pielou均匀度指数反映土壤动物群落结构多样性特征:
Simpson优势度指数
Shannon-Wiener多样性指数
Pielou均匀度指数
E=H/lnS
式中,N表示全部种的个体总数;Ni表示种i的个体数;Pi为第i个物种占总物种数的比例;S表示物种数。
土壤动物群落相似性指标的测定,采用公式如下:
Sorensen相似性系数
Cs=2c/(a+b)
式中,a为A月份或类型全部类群数,b为B月份或类型全部类群数,c为A、B两月份或类型共有的类群数。计算值在0.75—1.00为极相似,在0.50—0.74为中等相似,在0.25—0.49为中等不相似,在0—0.24为极不相似。
Morisita-Horn系数[22]
式中,S为类型A、B所有的类群数;aN和bN分别为类型A、B所有类群的总个体数;ani和bni分别为类型A、B中第i个类群的个体数。
土壤动物密度数据均为分离的土壤动物个体数量换算成的平均密度(个/m2)。数据分析前,对土壤动物数据进行log(x+1)对数转换,对于服从正态分布的土壤动物数据,采用SPSS 21对不同类型土壤动物的个体数进行单因素方差分析(One-way ANOVA),同时,利用Duncan多重范围检验比较其差异显著性。而对于不服从正态分布的土壤动物数据,则采用Kruskal Wallis Test(H)非参数检验进行数据分析。
3 结果与分析
3.1 太湖岸带湿地土壤动物群落组成
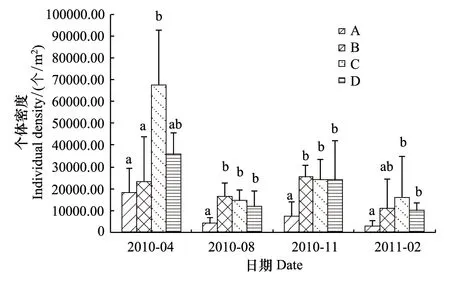
图1 土壤动物群落密度Fig.1 Densities of soil faunal communityA:酸模岸带Rumex acetosa lakeshore;B:乔灌岸带Tree and shrub lakeshore;C: 农作物岸带Crop lakeshore; D: 天然芦苇岸带Natural reed lakeshore
太湖岸带湿地不同类型的土壤动物群落结构组成存在一定差异(附表1)。4期调查共捕获土壤动物3575只,隶属于4门12纲,共105类;而类型A(酸模岸带)、B(乔灌岸带)、C(农作物岸带)、D(天然芦苇岸带)的土壤动物分别为59、66、63和63类。其中在大类群中,节肢动物门(Arthropoda)为优势类群,其次为线虫动物门(Nematoda),其分别占总个体数的55.75%和36.27%;而在节肢动物门中,昆虫纲(Insecta),弹尾纲(Collembola)和蛛形纲(Arachnida)分别占22.74%,16.92%和8.85%。在以上各类中,不同类群所占比例差异较大,其中,寡毛纲(Oligochaeta)中的线蚓科(Enchytraeidae),昆虫纲中的蚁科(Termitidae)以及隐翅甲科(Staphylinidae)分别占其总个体数的74.71%,11.79%和10.94%;弹尾纲中的等节跳科(Isotomidae)和球角跳科(Hypogastruridae)分别占该纲个体数的36.89%和25.40%;而蛛形纲中的蜱螨亚纲(Acari)和平腹蛛科(Gnaphosidae)分别占35.75%和19.13%。
3.2 太湖岸带湿地土壤动物群落密度
太湖岸带湿地土壤动物的群落密度在4期也存在一定的差异(图1)。2010年4月,8月,11月和2011年2月份,均以类型A的密度最低,其值分别为18164.19个/m2,4017.08个/m2,7422.86个/m2和2794.49个/m2。2010年4月和2011年2月均以类型C的密度最高,其值分别为67766.39个/m2和16068.32个/m2,而在2010年8月和11月均以类型B的群落密度最高,其值分别为14496.42个/m2和23927.82个/m2。
不同时间内4种类型的差异性检验表明,在2010年4月份,类型C与A、B(F=4.319,P<0.05)存在差异显著。在2010年8月和11月份中,类型A显著低于其它3种类型(F=4.331,P<0.05;F=6.555,P<0.05)。而2011年2月份,类型A与显著低于类型C、D(F=2.042,P<0.05),其他时间内各类型间无显著性差异(P>0.5)。
3.3 太湖岸带湿地土壤动物群落多样性
太湖岸带湿地土壤动物群落各多样性指数的季节变化动态不同(图2)。对Simpson优势度指数而言,类型B,C和D皆是2010年4月最大,其值分别为0.44,0.59和0.34;而类型A在2011年2月出现最大,其值为0.55。类型B的最小值出现在11月,其值为0.18;而类型A,C和D的最小值皆出现在2010年8月,分别为0.24,0.17和0.19。类型B,C和D的均匀度指数和多样性指数的最小值皆出现在2010年4月份;而类型A的最小值出现在2011年2月份。本研究中,不同类型中土壤动物群落的结构以及多样性均有不同的表现,这也反映了土壤动物对不同生境类型的响应。
统计分析结果表明季节变化对土壤动物群落多样性的影响较弱,但对不同类型的土壤动物影响程度有所不同(图2)。其中,Simpson优势度方差分析表明:2010年8月份,类型B与类型C,D之间,存在显著性差异(F=1.878,P<0.05)。Pielou均匀度的方差分析表明:2010年4月份类型A与C之间存在显著性差异(F=1.765,P<0.05);8月份类型B显著低于其他3类型(H=15.052,P<0.05)。Shannon多样性方差分析表明:2010年8月份,类型B与C之间存在显著性差异(F=1.299,P<0.05);11月份,类型A显著低于其他3种类型(F=3.271,P<0.01);2011年2月份,类型A与C、D存在显著性差异(F=1.585;P<0.05)。其余时间段内各类型间无显著性差异(P>0.05)。
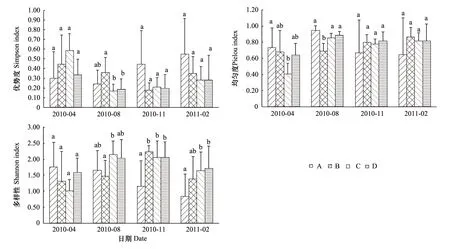
图2 不同类型土壤动物群落多样性Fig.2 Diversities of soil faunal community at different types
3.4 太湖岸带湿地土壤动物时间动态
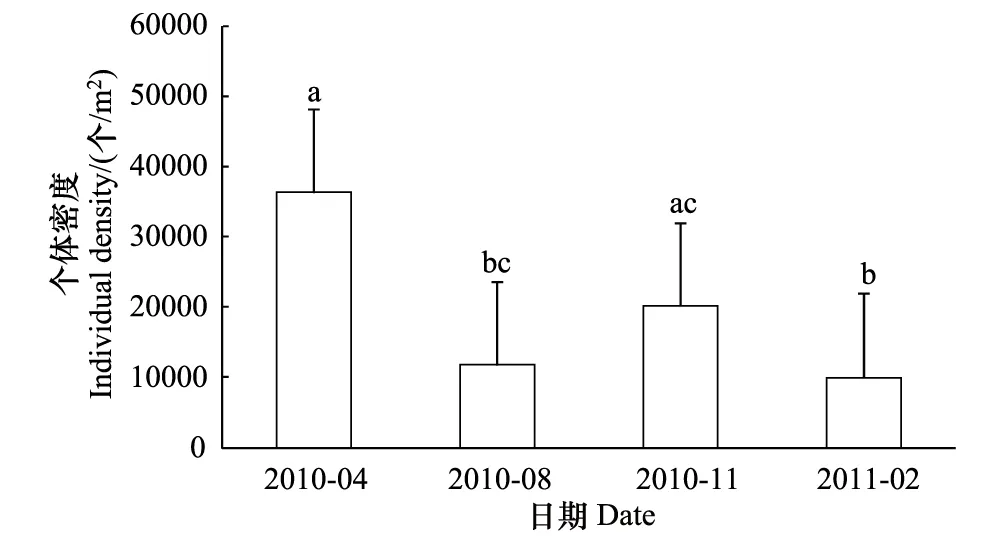
图3 土壤动物时间动态Fig.3 The temporal dynamics of soil animals
从整体来看,2010年4月土壤动物的群落密度最高,而2011年2月土壤动物的群落密度最低(图3)。分析表明,2010年4月份与8月份,2011年2月份呈显著性差异(F=9.571,P<0.01),2010年11月份和2011年2月份呈显著性差异(F=9.571,P<0.01)。
3.5 太湖岸带湿地土壤动物群落相似性
3.5.1 空间相似性
从Sorensen相似性系数(0.39—0.67)可知,4期土壤动物群落相似性有所差异,这表明群落空间相似性程度也受季节的影响。此外,2010年4月份和8月份间的Morisita-Horn相似性系数较大,部分相似性系数甚至接近于1,表明季节变化对土壤动物群落各类群的相对数量影响较弱;而在2010年11月份和2011年2月份的Morisita-Horn相似性系数相对较小,表明秋冬季对土壤动物群落各类群的相对数量影响较强(表1)。
3.5.2 季节相似性
土壤动物群落的季节相似性在这4种类型中存在差异(表2)。其中,Sorensen相似性系数以类型C中2010年11月与2011年2月最高(0.64),而类型A中2010年8月与2011年2月相似性系数最低(0.22)。这表明季节变化对太湖岸带湿地不同植被类型土壤动物群落影响不同。类型A在4次调查中的Sorensen系数均小于0.50,说明季节变化对类型A土壤动物群落优势类群数量的影响较大。
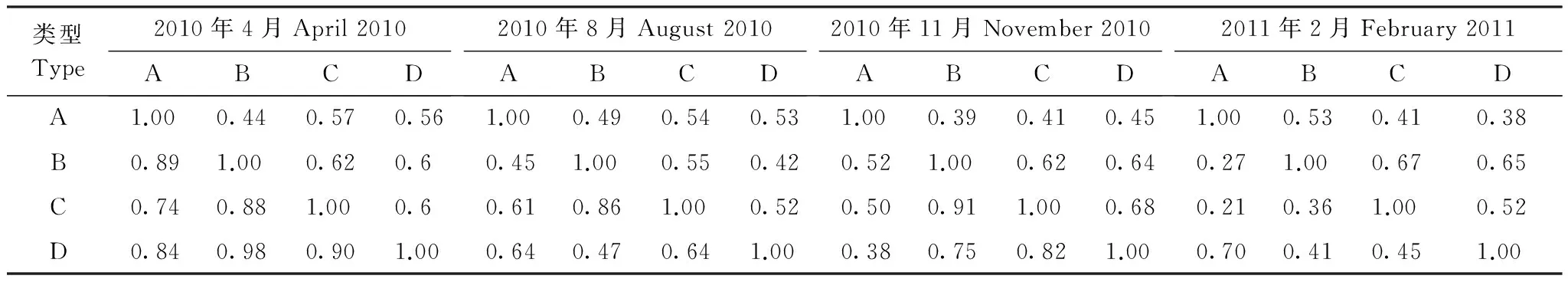
表1 土壤动物群落的空间相似性*Table 1 Similarities among soil faunal communities
*对角线之下为Morisita-Horn系数,对角线之上为Sorensen系数; A:酸模岸带Rumexacetosalakeshore;B:乔灌岸带Tree and shrub lakeshore;C: 农作物岸带Crop lakeshore; D: 天然芦苇岸带Natural reed lakeshore
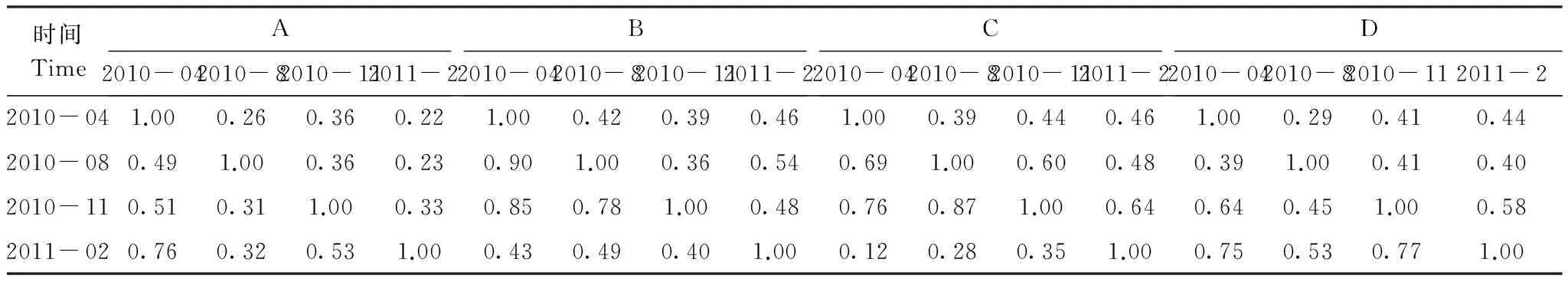
表2 土壤动物群落季节相似性Table 2 Similarities between four seasons of soil faunal communities
3.6 太湖岸带湿地土壤动物垂直分布
太湖岸带湿地土壤动物个体密度的垂直分布情况在不同月份及不同类型间有一定的差异。方差分析结果表明,2010年4月,类型C(H=9.572,P<0.01)和D(F=17.120,P<0.01)表层与二、三层呈显著性差异,其土壤动物垂直分布的表聚性现象较为明显。2010年8月,类型B表层与二、三层有显著的垂直分布差异(H=6.689,P<0.05)。2010年11月,类型A表层与二、三层呈显著性差异(P<0.05);类型B的三层之间存在显著性差异(H=10.614,P<0.01);而类型C的表层与第三层呈显著性差异(F=3.357,P<0.05)。其他时间各类型的不同层次间无显著性差异(P>0.05)(图4)。从太湖岸带湿地土壤动物垂直分布分析结果可以看出土壤动物个体数大部分表现为Ⅰ层>Ⅱ层>Ⅲ层,说明个体数量随土壤深度的增加而减少。而部分类型在不同月份间并未出现上述情况,说明土壤动物对不同类型的不同季节响应。
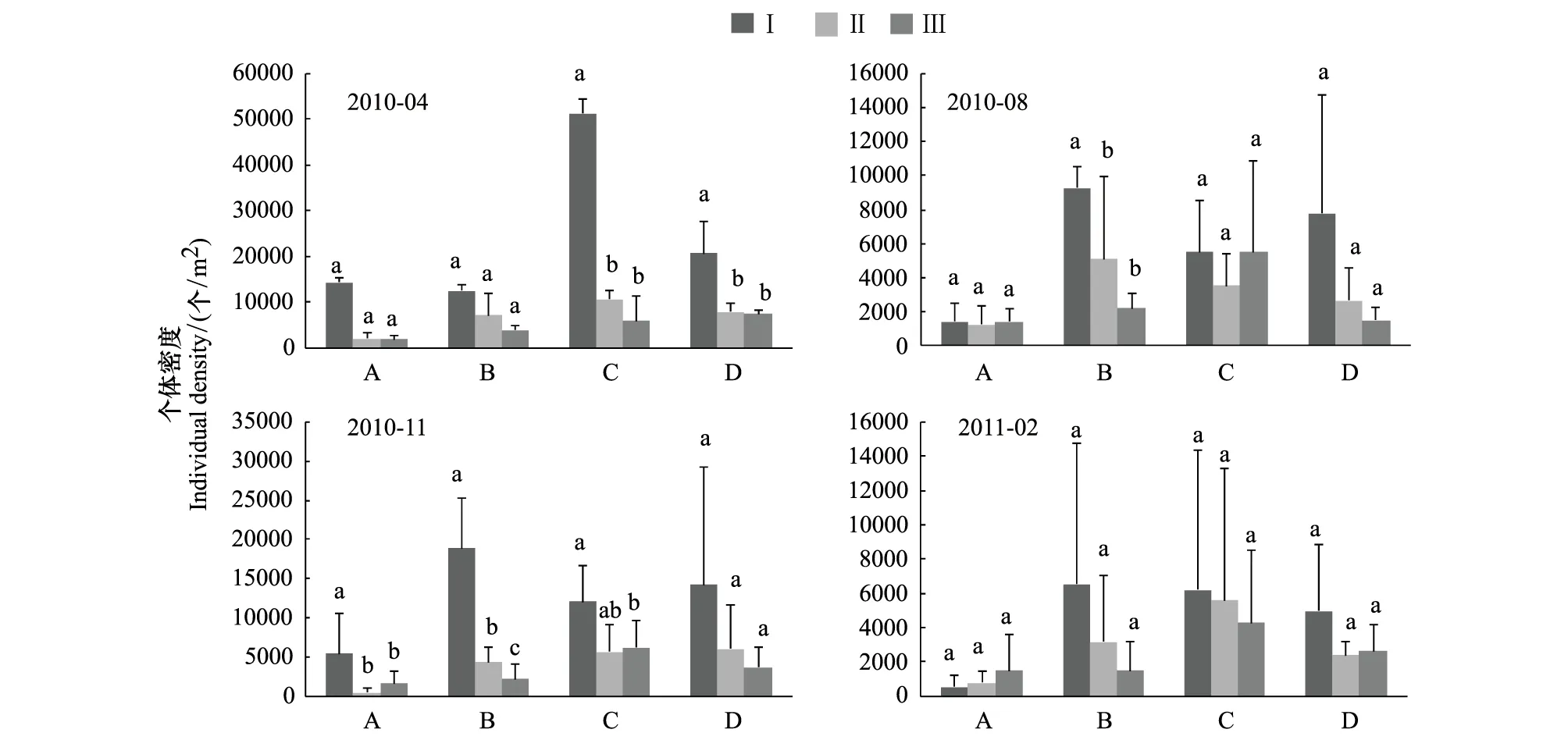
图4 土壤动物的垂直分布Fig.4 Vertical distributions of the individual density of soil faunal communities
4 讨论
太湖岸带湿地共捕获到土壤动物3575只,隶属4门12纲,共105类群。节肢动物门(Arthropoda)和线虫动物门(Nematoda)构成了太湖岸带湿地土壤动物的主体,对土壤动物群落特征起着决定性作用。其中部分个体较大的类群,如地蜈蚣目、石蜈蚣目等是碎裂植物残体的主力,在物质循环过程中发挥着重要作用。4次调查均出现的类群有3个(线虫、球角科和象甲科幼虫);出现3次的类群有16个;而出现2次的类群有72个,表明太湖岸带湿地土壤动物群落物种组成具有明显的季节特征,同时也反应出稀有类群和常见类群对季节变化具有较高的敏感性。4次调查期间的Sorensen相似性系数低于Morisita-Horn相似性系数,说明土壤动物群落稀有类群和常见类群的种类组成季节变化较大,而优势类群的种类组成及个体数量的变化相对较小。Sorensen和Morisita-Horn相似性分析表明不同类型对土壤动物物种丰度产生了不同的影响。土壤动物群落结构以及多样性受到植被类型的影响。
土壤动物的整体数量为2010年4月>2010年11月>2010年8月>2011年2月。Connell和Slatyer[23]认为植被结构和土壤理化性质是决定土壤动物分布的主要因子,而土壤温湿度的季节变化是影响土壤动物季节动态的主要因子。一般来说,温度过高和过低都不利于土壤动物的繁殖[24],温度变化能够影响植物的生理和群落结构,从而影响土壤动物的摄食活动及微生境的变化。冬季的2011年2月份所处环境相对比较寒冷,不利于土壤动物的繁殖。此外,在2011年2月份土壤动物的数量较低,可能跟当地冬季对岸带湿地进行火烧有关,火烧之后,由于温度过高致使表层土壤中土壤动物的死亡。太湖地区4月随着温度的升高,大量的昆虫幼虫开始滋生繁衍,数量较大;6月大量幼虫变为成虫;在太湖地区8月份属于最热月,不利于土壤动物的繁殖和生长,因此8月份的土壤动物群落密度较低。温度升高可以使线蚓等向土壤深层次迁移,廖崇惠等[24]等也发现亚热带夏季高温不利于小型湿生动物繁衍生息。
植物是土壤动物直接或间接的食物来源,植物群落的盖度、种类和凋落物的差异可导致土壤动物的栖息环境和食源的改变,从而影响土壤动物群落结构和功能,不同植物的凋落物可能对大型土壤动物产生影响[25- 28]。许多研究表明,植物群落物种组成能够影响土壤动物群落组成和结构[29- 32]。本研究中,不同类型之间,土壤动物分布存在一定的差异,并且存在着明显的不均衡分布现象,即少数物种因其个体数量较多而成为优势类群,如土壤中大量分布的线虫、等足类和膜翅目昆虫,其它土壤动物类群由于个体数量较少而成为稀有类群。有研究表明,土壤动物多样性随人为干扰程度的不同而存在很大差异,人类的农业生产活动可以导致湿地生态系统中土壤动物物种多样性降低,优势度提高,形成只利于少数几个种群栖息和生存的环境,土壤动物生物多样性受到影响,但适度干扰能提高土壤动物生物多样性[33]。本研究中土壤动物的群落密度在4期调查时间存在一定的差异。在调查期间,均以类型A(酸模岸带)的密度最低,分析原因由于类型A靠近苏州湿地公园,受人为影响较为明显,这表明一定强度的人为干扰可显著降低土壤动物的群落密度。在2010年4月和2011年2月份均以类型C(农作物岸带)的密度最高,分别为67766.39 个/m2和16068.32 个/m2,究其原因可能是由于土壤中可能留有农作物及杂草的种子或其他繁殖体,增加了土壤空间异质性,为某些土壤动物提供了较为适宜的生存环境,提高了土壤动物密度。而在2010年8月和11月份均以类型B(乔灌类型)的密度最高,分别为14496.42 个/m2和23927.82 个/m2,类型B可以产生种类丰富的凋落物,且容易被土壤动物分解消化,可为中小型土壤动物提供食物、水分及优良的生活场所,尤其对捕食性土壤动物、线蚓和线虫的影响较为明显[34],故其在2010年8月和11月份的土壤动物密度和类群较高。此外,太湖岸带湿地土壤动物个体数的垂直分布均有一定的表聚性,但不同季节表聚性程度不同。表层土层是植物根系的主要分布区,其土壤质地相对疏松,通气性较好,营养丰富,因而土壤动物相对增多[35- 36]。而11月份由于天气转冷,随着气温和土壤温度的降低导致表层土壤动物的逆向分布。
致谢:苏州湿地站冯育青站长和邱世民工程师、南京大学刘茂松副教授和黄成副教授、龙闹、滕漱清、石云峰、陈皓、黄涛、洪超硕士和王天乐博士等对野外试验和室内鉴定分别给予帮助。
[1] Anderson J T, Smith L M. Invertebrate response to moist-soil management of playa wetlands. Ecological Applications, 2000, 10(2): 550- 558.
[2] Volkmar W. Biodiversity of soil animals and its function. European Journal of Soil Biology, 2001, 37(4): 221- 227.
[3] Brady V J, Cardinale B J, Gathman J P, Burton T M. Does facilitation of faunal recruitment benefit ecosystem restoration? An experimental study of invertebrate assemblages in wetland mesocosms. Restoration Ecology, 2002, 10(4): 617- 626.
[4] Davis C A, Austin J E, Buhl D A. Factors influencing soil invertebrate communities in riparian grasslands of the central platte river floodplain. Wetlands, 2006, 26(2): 438- 454.
[5] 殷秀琴, 安静超, 陶岩, 辛未冬, 蒋云峰, 王富斌. 拉萨河流域健康湿地与退化湿地大型土壤动物群落比较研究. 资源科学, 2010, 32(9): 1643- 1649.
[6] Sugden A, Stone R, Ash C. Ecology in the Underworld. Science, 2004, 304(5677): 1613- 1613.
[7] Burger J C, Redak R A, Allen E B, Rotenberry J T, Allen M F. Restoring arthropod communities in coastal sage scrub. Conservation Biology, 2003, 17(2): 460- 467.
[8] 韩立亮, 王勇, 王广力, 张美文, 李波. 洞庭湖湿地与农田土壤动物多样性研究. 生物多样性, 2007, 15(2): 199- 206.
[9] Wardle D A, Bonner K I, Barker G M. Linkages between plant litter decomposition, litter quality, and vegetation responses to herbivores. Functional Ecology, 2002, 16(5): 585- 595.
[10] 王天乐, 李伟, 丁洁, 俞道远, 刘茂松. 退化湿地恢复中土壤节肢动物的群落结构. 南京林业大学学报: 自然科学版, 2011, 35(2): 51- 55.
[11] 王邵军, 阮宏华, 汪家社, 徐自坤, 吴焰玉. 武夷山典型植被类型土壤动物群落的结构特征. 生态学报, 2010, 30(19): 5174- 5184.
[12] 刘扬, 张岸, 严莹, 李恺, 方燕. 崇明岛不同土地利用类型下土壤动物群落多样性研究. 复旦学报: 自然科学版, 2011, 50(3): 288- 295.
[13] 张宇博, 杨海军, 王德利, 肖志坚, 韩吉玥. 受损河岸生态修复工程的土壤生物学评价. 应用生态学报, 2008, 19(6): 1374- 1380.
[14] Sarr M, Agbogba C, Russell-Smith A, Masse D. Effects of soil faunal activity and woody shrubs on water infiltration rates in a semi-arid fallow of Senegal. Applied Soil Ecology, 2001, 16(3): 283- 290.
[15] 叶春, 李春华, 王秋光, 陈小刚. 大堤型湖滨带生态系统健康状态驱动因子——以太湖为例. 生态学报, 2012, 32(12): 3681- 3690.
[16] 周文, 刘茂松, 徐驰, 何舸, 王磊, 杨雪姣. 太湖流域河流水质状况对景观背景的响应. 生态学报, 2012, 32(16): 5043- 5053.
[17] 李宽意, 张强, 刘正文. 东太湖四角菱 (Trapaquadrispinosa) 生长特性. 生态学报, 2009, 29(7): 3947- 3951.
[18] 李春华, 叶春, 赵晓峰, 王秋光, 陈小刚, 孔祥龙, 卢少勇, 徐东炯, 陈桥. 太湖湖滨带生态系统健康评价. 生态学报, 2012, 32(12): 3806- 3815.
[19] 刘丽贞, 秦伯强, 朱广伟, 宋玉芝, 王小冬, 丁艳青. 太湖蓝藻死亡腐烂产物对狐尾藻和水质的影响. 生态学报, 2012, 32(10): 3154- 3159.
[20] 尹文英. 中国土壤动物. 北京: 科学出版社, 2000: 1- 50.
[21] 尹文英. 中国土壤动物检索图鉴. 北京: 科学出版社, 1998: 31- 150.
[22] Doblas-Miranda E, Sánchez-Piero F, González-Megías A. Soil macroinvertebrate fauna of a Mediterranean arid system: composition and temporal changes in the assemblage. Soil Biology and Biochemistry, 2007, 39(8): 1916- 1925.
[23] Connell J H, Slatyer R O. Mechanisms of succession in natural communities and their role in community stability and organization. The American Naturalist, 1977, 111(982): 1119- 1144.
[24] 廖崇惠, 李健雄, 杨悦屏, 张振才. 海南尖峰岭热带林土壤动物群落-群落的组成及其特征. 生态学报, 2002, 22(11): 1866- 1872.
[25] Wardle D A, Bardgett R D, Klironomos J N, Setälä H, van der Putten W H, Wall D H. Ecological linkages between aboveground and belowground biota. Science, 2004, 304(5677): 1629- 1633.
[26] 林英华, 张夫道, 张俊清, 欧阳学军, 莫定生, 周国逸. 鼎湖山不同自然植被土壤动物群落结构时空变化. 生态学报, 2005, 25(10): 2616- 2622.
[27] 崔丽巍, 刘世荣, 刘兴良, 吴鹏飞, 张洪芝, 何先进. 川西北冷杉林恢复过程中土壤动物群落动态. 生态学报, 2012, 32(15): 4772- 4783.
[28] Wiwatwitaya D, Takeda H. Seasonal changes in soil arthropod abundance in the dry evergreen forest of north-east Thailand, with special reference to collembolan communities. Ecological Research, 2005, 20(1): 59- 70.
[29] 吴鹏飞, 杨大星. 若尔盖高寒草甸退化对中小型土壤动物群落的影响. 生态学报, 2011, 31(13): 3745- 3757.
[30] Kardol P, Cregger M A, Campany C E, Classen A T. Soil ecosystem functioning under climate change: plant species and community effects. Ecology, 2010, 91(3): 767- 781.
[31] Cole L, Buckland S M, Bardgett R D. Relating microarthropod community structure and diversity to soil fertility manipulations in temperate grassland. Soil Biology and Biochemistry, 2005, 37(9): 1707- 1717.
[32] 张龙龙, 鲍毅新, 胡知渊, 孙波, 赵庆洋, 许婧. 溪源湿地秋季不同植被类型土壤动物群落特征初步研究. 浙江师范大学学报: 自然科学版, 2009, 32(4): 453- 459.
[33] 王广力, 王勇, 韩立亮, 张美文, 李波. 洞庭湖区不同土地利用方式下的土壤动物群落结构. 生态学报, 2005, 25(10): 2629- 2636.
[34] Koehler H. Secondary succession of soil mesofauna: A thirteen year study. Applied Soil Ecology, 1998, 9(1/3): 81- 86.
[35] 张洪芝, 吴鹏飞, 杨大星, 崔丽巍, 何先进, 熊远清. 青藏东缘若尔盖高寒草甸中小型土壤动物群落特征及季节变化. 生态学报, 2011, 31(15): 4385- 4397.
[36] 武海涛, 吕宪国, 姜明, 朱宝光. 三江平原典型湿地土壤动物群落结构及季节变化. 湿地科学, 2008, 6(4): 459- 465.
Community structure and diversity of soil animals in the Lake Taihu lakeshore wetland
LI Wei1,2, CUI Lijuan1,2,*, ZHAO Xinsheng1,2, ZHANG Manyin1,2, GAO Changjun1,2, ZHANG Yan1,2, WANG Yifei1,2
1InstituteofWetlandResearch,ChineseAcademyofForestry,Beijing100091,China2BeijingKeyLaboratoryofWetlandServicesandRestoration,Beijing100091,China
Soil animals, a crucial part of wetland ecosystems, play an important role in nutrient cycling and energy flow and are also an important driver of wetland ecosystem succession. Research related to the diversity of soil animals is an important part of the study of soil biodiversity. Knowledge of the temporal variability of soil animal populations and species is crucial to the understanding of soil community dynamics and food webs. Lake Taihu, a shallow freshwater lake located in eastern China on the border of Jiangsu and Zhejiang provinces, was studied to document the composition, diversity, and seasonal variations of soil animal communities in a lakeshore wetland. Soil animal community structure and diversity were analyzed in four different types of lakeshore habitat: A,Rumexacetosalakeshore; B, tree and shrub lakeshore; C, crop lakeshore; D, natural reed lakeshore. Tullgren and Baermann′s methods were used to extract 3575 soil fauna individuals (ind) which were classified into four phyla, twelve classes, and 105 taxonomic groups. The density of soil animal communities was 2794.49—67766.39 ind/m2. Species in the phyla Arthropoda (55.75%) and Nematoda (36.27%) constituted the main body of the soil fauna. The proportion of animals in different groups varied widely from one community to another: for example, in the phylum Arthropoda, Insecta, Collembola and Arachnida accounted for 22.74%, 16.92% and 8.85% of the individuals in the soil fauna community, respectively. A test of the differences in population density of soil animal communities in different habitats indicated habitat types C and A were significantly different from habitat B (F=4.319,P< 0.05) in April 2010. In August and November 2010, the density of these communities was significantly lower in habitat A than in the other three types (F=4.331;F=6.555,P< 0.05). Also, in February 2011, the density was significantly lower than in type C and D (F=2.042,P< 0.05). At other times, no significant differences in the density of soil animal communities were observed for all habitat types (P> 0.5). The dynamics of several soil fauna community diversity indices varied in different seasons. The Simpson diversity index reached a maximum for habitat types B, C and D in April 2010, with values of 0.44, 0.59 and 0.34, respectively; meanwhile, the same index for type A reached a maximum of 0.55 in February 2011. For the Pielou evenness and Shannon diversity indices, type B, C and D reached a minimum in April 2010, while type A reached a minimum in February 2011. The Simpson diversity index difference test indicated types B and C were significantly different from type D (F=1.878,P< 0.05) in August 2010. Types A and C were significantly different for the Pielou evenness index in April 2010 (P< 0.05); and in August 2010, Type B was significantly lower than the other three types (H=5.052,P< 0.05). Meanwhile, in November 2010, Type A was significantly lower than the other three types (F=3.271,P< 0.01) for the Shannon diversity index, and types A and C were significantly different from type D in February 2011 (P< 0.05). When combining the four types as a single measurement, the overall reserves of the soil animals were in descending order of April 2010 > November 2010 > August 2010 > February 2011. Sørensen index similarity analysis showed that the seasonal similarity of the four types of Lake Taihu lakeshore wetland soil animal communities was different. The seasonal variation had higher impact on the number of Type A dominant communities. Morisita-Horn index analysis showed that different habitat types produced different effects on the abundance of soil animal species. This suggested that seasonal change can influence the structure and composition of the soil community. The vertical distribution of the number of individuals of the soil fauna had a certain degree of accumulation, with a greater number of individuals found in the surface layer of the soil, although the exact numbers varied in different seasons. The results of this study provide a basis for health assessment and scientific management of Lake Taihu lakeshore wetland.
Lake Taihu; soil fauna; community structure; biodiversity
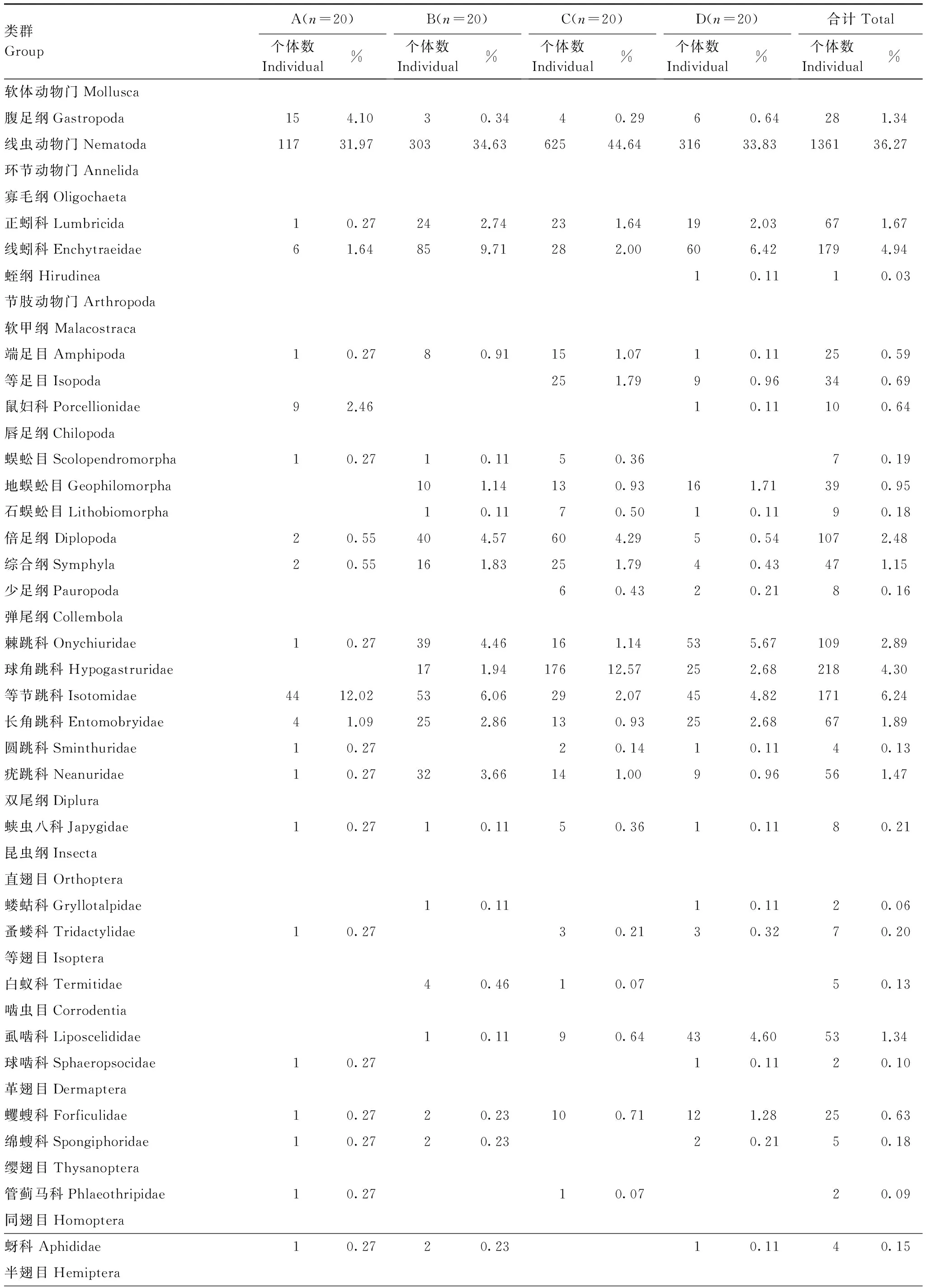
附表1 土壤动物群落类群与数量组成Appendix1 Group composition and quantitative distribution of soil faunal communities
林业公益性行业科研专项“太湖流域湿地生态系统功能作用机理及调控与恢复技术研究”(200904001)
2013- 05- 02;
日期:2014- 04- 11
10.5846/stxb201305020906
*通讯作者Corresponding author.E-mail: lkyclj@126.com
李伟, 崔丽娟, 赵欣胜, 张曼胤, 高常军,张岩, 王义飞.太湖岸带湿地土壤动物群落结构与多样性.生态学报,2015,35(4):944- 955.
Li W, Cui L J, Zhao X S, Zhang M Y, Gao C J, Zhang Y, Wang Y F.Community structure and diversity of soil animals in the Lake Taihu lakeshore wetland.Acta Ecologica Sinica,2015,35(4): 944- 955.
