耐受自身代谢产物及耐二甲基亚砜红霉素高产菌株的选育
2015-03-10沈小静张萍石彦鹏
沈小静,张萍,石彦鹏
(宁夏泰瑞制药股份有限公司,银川 750101)
耐受自身代谢产物及耐二甲基亚砜红霉素高产菌株的选育
沈小静,张萍*,石彦鹏
(宁夏泰瑞制药股份有限公司,银川 750101)
为提高红霉素发酵单位,考察了二甲基亚砜(DMSO)添加时间和体积分数对红霉素合成的影响,采用筛选自身代谢产物突变株的方法,将突变株进行常压室温等离子体(ARTP)诱变和耐受高浓度DMSO处理。结果显示,在36 h向发酵瓶中添加30000 μg/mL红霉素,筛选得到化学效价比对照提高22.4%的菌株。DMSO最适添加时间为发酵48 h,最适添加剂量为0.2%,其可提高发酵单位10.1%。
红霉素;耐受自身代谢产物;二甲基亚砜;遗传稳定性;常压室温等离子体
红霉素(Erythromycin,Er)是一类大环内酯类抗生素,包括红霉素A(ErA)、红霉素B(ErB)、红霉素C(ErC)、红霉素D(ErD)、红霉素E(ErE)和红霉素F(ErF)。在临床上广泛应用的是红霉素A。红霉素A的生物合成途径中红霉素D是一个很关键的中间产物。红霉素D沿两条分支途径转化为红霉素A,途径I:红霉素D在羟基化酶EryK的作用下羟基化,生成红霉素C,然后在甲基化酶EryG的作用下甲基化,生成红霉素A;其中途径Ⅱ:红霉素D在甲基化酶EryG的作用下甲基化,生成红霉素B,然后在羟基化酶EryK的作用下羟基化,生成红霉素A。据文献报道[1-3],途径I为红霉素主要代谢途径,即由红霉素B 转化成红霉素A 的通量小,红霉素B 容易积累,而由红霉素C 转化成红霉素A 的通量大,强化甲基化,红霉素C 不易积累,能得到高百分含量的红霉素A,可使发酵液的化学效价显著提高[4]。
据报道[5],对于羟基化反应,小分子有机溶剂如二甲基亚砜(DMSO)、乙醇、丙酮等可使细胞色素P450单加氧酶mRNA量增加,最终使细胞色素P450单加氧酶(EryK)表达量增加。丁盼盼等研究了摇瓶和发酵罐中DMSO对红霉素合成的影响,确定合适的添加时间及剂量,使红霉素效价比对照提高11.6%[6]。据此推测在发酵过程中向培养基中添加DMSO,可能会增加EryK的表达量从而促进红霉素效价的提高。本文考察了DMSO添加时间和体积分数对红霉素合成的影响。影响抗生素产生菌生物合成能力的因素有很多,获得对自身代谢产物耐受能力高的突变株,是菌种选育的有效手段和方法。这个方法对某个菌株选育的初期或者是对高产菌株进行纯化时,尤为有效[7]。据此,为了提高红霉素的发酵单位,借鉴前人的经验,在红霉素选育过程中首先采用了筛选自身代谢产物突变株的方法,然后将突变株进行ARTP诱变处理,再结合高浓度DMSO耐受性实验,最终使菌种具有耐自身代谢产物及耐受高浓度DMSO的特性,并将获得的突变菌株进行分离纯化和稳定性实验,使得红霉素产量大幅度提高。
1 材料与方法
1.1 材料1.1.1 供试菌株 红色糖多孢菌(Saccharopolysporaerythraea),CGMCC,经本公司分离纯化得到生产能力稳定的菌株:EM13-165,用沙土管保藏。
1.1.2 主要设备 旋转摇瓶机,XDW25/96型,四川长征制药机械厂;紫外可见分光光度计,
UV-1800,日本岛津;恒温、净化工作系统;ARTP 生物育种机,ARTP—Ⅱ型,清华大学与北京思清源生物科技有限公司联合开发;高效液相色谱仪,1100 /1200 Series ,美国Agilent。
1.1.3 试剂及原料 黄豆饼粉、玉米淀粉、糊精、碳酸钙均购自本地;玉米浆购自华北制药康欣股份有限公司; 硫酸铵、氯化钠、葡萄糖、正丙醇、磷酸氢二钾均为分析纯,购自天津市凯通化学试剂有限公司;乙腈为色谱纯;水为重蒸水;红霉素对照品(中国兽医药品监察所,批号:K0031208,红霉素A组分91.3 %)。
1.2 方法
1.2.1 培养基及培养方法 参照文献[8]培养制备培养基。
1.2.2 耐受自身代谢产物突变株筛选 将32 ℃培养成熟的斜面,用挖块法挖取约2 cm2接种到种瓶培养基(300 mL三角瓶,装量30 mL)中按上述方法进行培养。于发酵0、12、24、36 h,按摇瓶体积分别加入不同剂量(10000、20000、30000、40000、50000 μg/mL)的红霉素无菌粉(用Co60灭菌),在摇瓶培养到96、120、144、168 h时,开始以玻璃棒沾取摇瓶发酵培养物涂斜面。斜面在32 ℃培养9 d,再进行摇瓶发酵培养,并使用紫外分光光度法(UV)检测化学效价。
1.2.3 耐DMSO突变株筛选 首先分别在摇瓶发酵培养0、24、48、72、96、120 h时向摇瓶中添加0.2%(体积分数,下同)DMSO,测定其化学效价,考察其对红霉素效价的影响以确定最适添加时间。以筛选得到的自身代谢产物突变株S-17做为ARTP诱变处理出发菌株,筛选耐DMSO突变株。以99.99%氦气作为工作气体,氦气流量10 SLM;处理功率120 W;样品与等离子体发生器出口距离2 mm;处理样品为20 μL孢子悬液;为了寻找最佳的诱变处理时间,分别考察了照射时间为20、40、60、80、100、120 s时的诱变致死率。选择较适的等离子诱变剂量进行菌种诱变,将诱变孢子悬液适当稀释后涂布在含DMSO(体积分数分别为0.1%,0.15%,0.2%,0.25%,0.3%,0.4%)不同浓度平板上,32 ℃培养观察孢子萌发和菌丝生长情况。随机挑取单菌落,接种斜面培养。待孢子成熟,按1.2.1项方法进行培养,并分别在发酵48 h添加与筛选平板相同剂量的DMSO进行初筛,使用紫外分光光度法(UV)测定其化学效价。对于初筛效价相对较高的菌株按同样的方法进行复筛,使用紫外分光光度法(UV)测定其化学效价,对复筛效价较高的菌株使用高效液相色谱法(HPLC)测定红霉素A的含量。
1.2.4 紫外分光光度法(UV)检测方法 参照文献[9],本法是硫酸水解法,即红霉素经硫酸水解后呈黄色,于483 nm 处有吸收峰,使用紫外可见分光光度计可以定量测定。发酵液经离心后,根据确定好的倍数吸取一定量的滤液,用0.35% 碳酸钾液稀释。然后,取稀释液20 mL于分液漏斗中,加入醋酸丁酯20 mL,振摇30 min,放置分层,弃去下层水液,于丁酯液中加入无水硫酸钠1 g 左右(可酌量多加使丁酯液澄清) ,振荡至透明。准确吸取其上层脱水液10 mL于另一干燥的分液漏斗中,精确加入盐酸(0.1 mol/L ) 10 mL,振荡30 min,放置分层,把下层盐酸水液放入试管中,从中吸取5 mL 放入另一试管中,加入硫酸(8 mol/L ) 5 mL,摇匀,放入50 ℃水浴中,保温30 min取出冷却。在483 nm处测定吸光度值,同时以蒸馏水为空白,用所得的吸光度值查标准曲线。效价= 查出数×稀释倍数。
1.2.5 UV标准曲线制备方法 参考文献[10],精密称量红霉素对照品0.0502 g 置100 mL 容量瓶中,加乙醇20 mL溶解,用水稀释至刻度。准确量取该标准品溶液分别置于量瓶中,用纯化水稀释使其最终浓度相当于含红霉素0、1、5、10、20、30、40、50 mg/ L。分别加入硫酸溶液(5 mol/L)12 mL,在80 ℃水浴7 min,取出立即水浴冷却至室温,用硫酸溶液稀释至刻度,在483 nm处测定吸光度,以效价为纵坐标,吸光度为横坐标做回归方程(r≥0.999),列表备用。
1.2.6 高效液相色谱法(HPLC)检测方法 参考文献报道[11],色谱柱为反相C18柱RP-C18(250mm×4.6mm,5μm);流动相:V(0.025mol/L的K2HPO4溶液)∶V(乙睛) = 60∶40;流速1.0mL/min;检测波长210nm;柱温50 ℃;进样量100μL。
1.2.7HPLC标准曲线制备方法 取含红霉素0、1、5、10、20、30、40、50mg/L的标准品溶液分别进样,以标准品浓度为横坐标、峰面积为纵坐标,进行线性回归,得回归方程为:Y=0.0899X+0.0587(r=0.9999)。红霉素A在0.375~7.690mg/mL范围内与峰面积呈良好的线性关系。
2 结果与分析
2.1 红霉素标准曲线 标准曲线如图1所示。
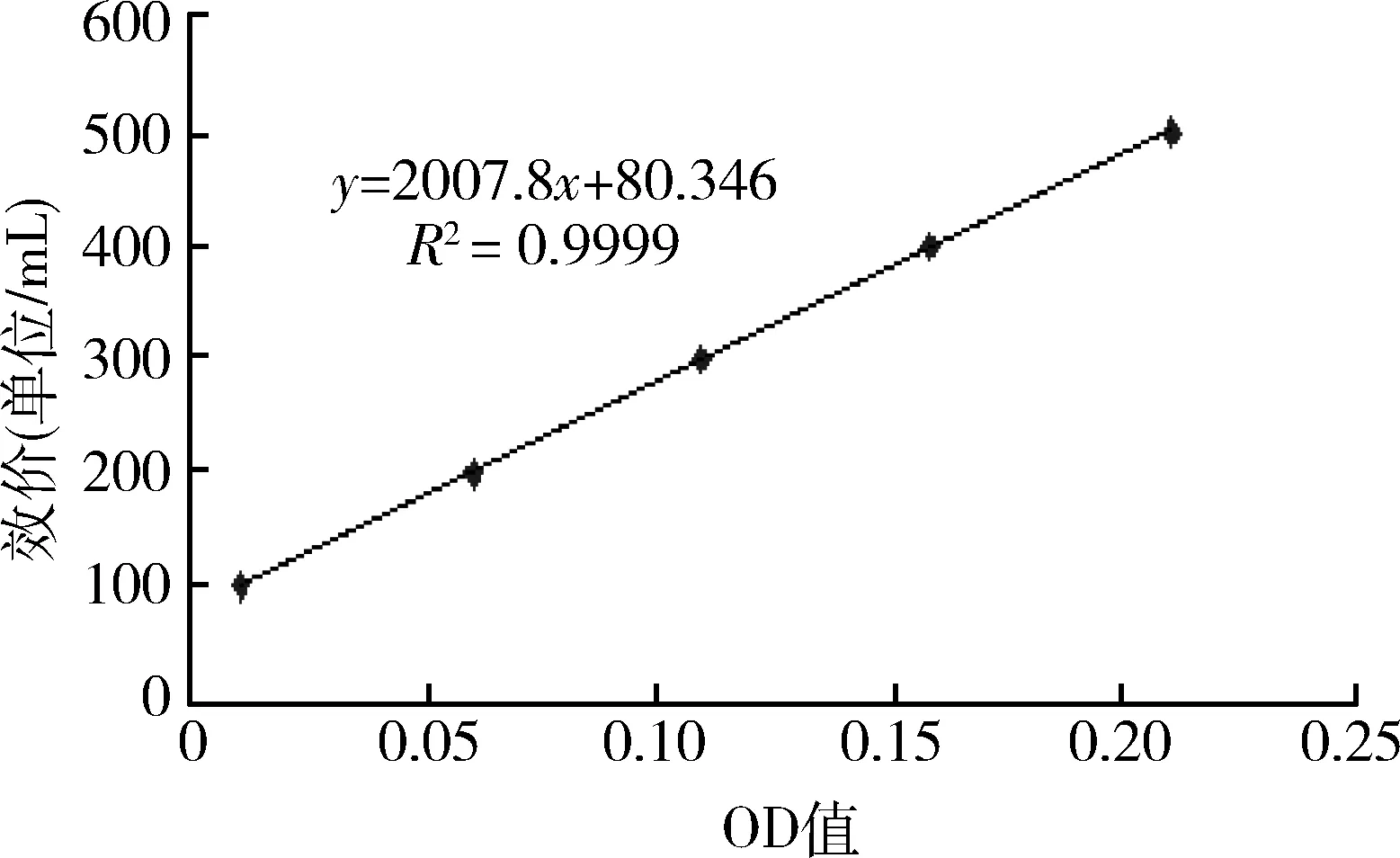
图1 红霉素标准曲线图
2.2 出发菌株耐受红霉素剂量的初步选择 以红霉素发酵24 h加入时间的菌丝生长状况为参考确定耐受剂量,结果如表1所示。

表1 耐受剂量选择实验结果表
由表1可知,随着红霉素浓度的增加,菌丝长势加快,外观颜色随耐受剂量增加逐渐加深;当耐受剂量达30000 μg/mL以后,随耐受剂量的增加,菌丝生长减缓,外观颜色随耐受剂量的增加而变浅。根据以上实验,选择30000 μg/mL耐受剂量做进一步考察。
2.3 耐受剂量 剂量在30000 μg/mL情况下,向摇瓶加红霉素的时间、从发酵摇瓶传斜面的时间与发酵单位的关系结果如表2所示。

表2 红霉素不同加入时间、涂斜面时间和发酵单位的关系
从表2可以看出,摇瓶添加红霉素时间36 h,发酵单位较高;斜面涂抹时间120 h,发酵单位最高。通过在36 h添加红霉素并在发酵120 h涂斜面,最终筛选出一株S-17耐受菌株,其生产能力比对照菌株提高22.4%,部分菌株效价提高幅度结果如图2所示。
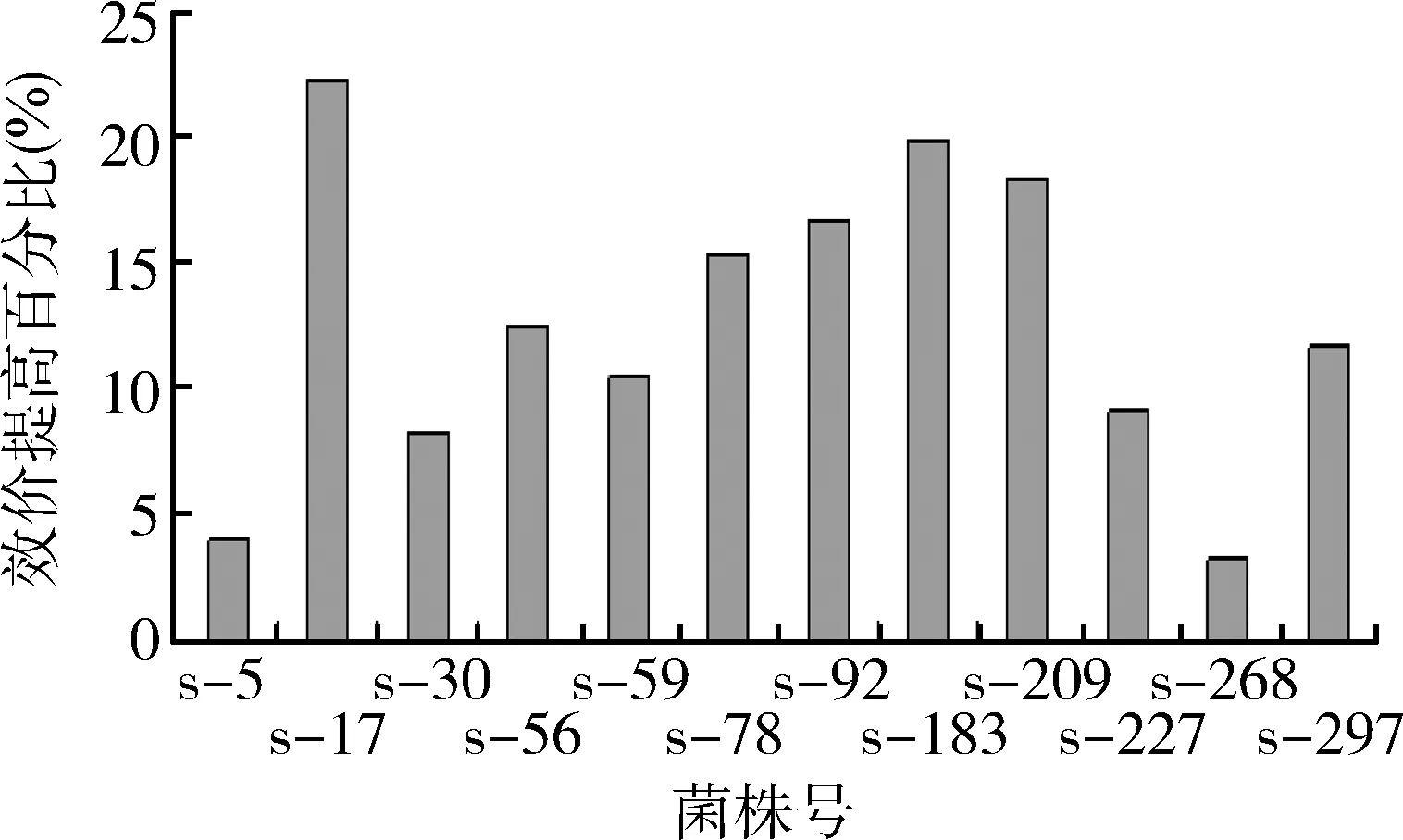
图2 耐受自身代谢产物突变株效价提高幅度
2.4 DMSO添加时间对红霉素效价的影响 分别在摇瓶发酵培养0、24、48、72、96、120 h时添加0.2%DMSO,考察其对红霉素效价的影响,结果见图3。

图3 DMSO添加时间对红霉素效价的影响
由图3可以看出,在发酵0、48、72 h时添加0.2%的DMSO均可提高红霉素效价,其中在发酵48 h添加DMSO时,红霉素效价达到最大。因此,确定DMSO最适添加时间为48 h。
2.5 等离子体诱变剂量的确定 从表3可以看出,在ARTP照射时间为80 s时,致死率达到98.9%,当照射时间为20 s和60 s时,致死率分别为38.8%和90.4%。对于不同的菌株,在不同的致死率下,其正突变的概率是不容易确定的,所以为了增加诱变筛选的几率,将ARTP诱变剂量为20、60、80 s三个不同致死率下的孢子悬液进行混合后涂布平板用于筛选。

表3 等离子体诱变死亡率
2.6 等离子体诱变结合耐DMSO突变株筛选 将菌株s-17经ARTP诱变后,在不同DMSO浓度的固体平板上的孢子萌发实验表明:ARTP诱变提高了部分突变株的DMSO耐受能力。从表4可以看出在培养5 d后,突变株sq-124、sq-205在DMSO达0.2%时仍可正常萌发,突变株sq-181、sq-210、sq-229孢子在DMSO高达0.25%时仍可正常萌发,而出发菌株在大于0.15%即不能萌发。

表4 菌株在不同浓度DMSO固体平板上的生长情况
对DMSO(体积分数分别为0.1%,0.15%,0.2%,0.25%)不同浓度平板上随机挑选得到的320个菌落进行发酵能力考察,统计菌群分布情况见图4。UV检测结果显示以DMSO体积分数0.2%进行筛选,高效价菌株群比例占优势。最终筛选出5株高产菌株,其中一株菌株sq-181比出发菌株s-17的效价提高10.1%(图5)。高产菌株与对照菌株的HPLC检测结果见表5。

图4 DMSO不同浓度筛选菌株摇效瓶价分布图
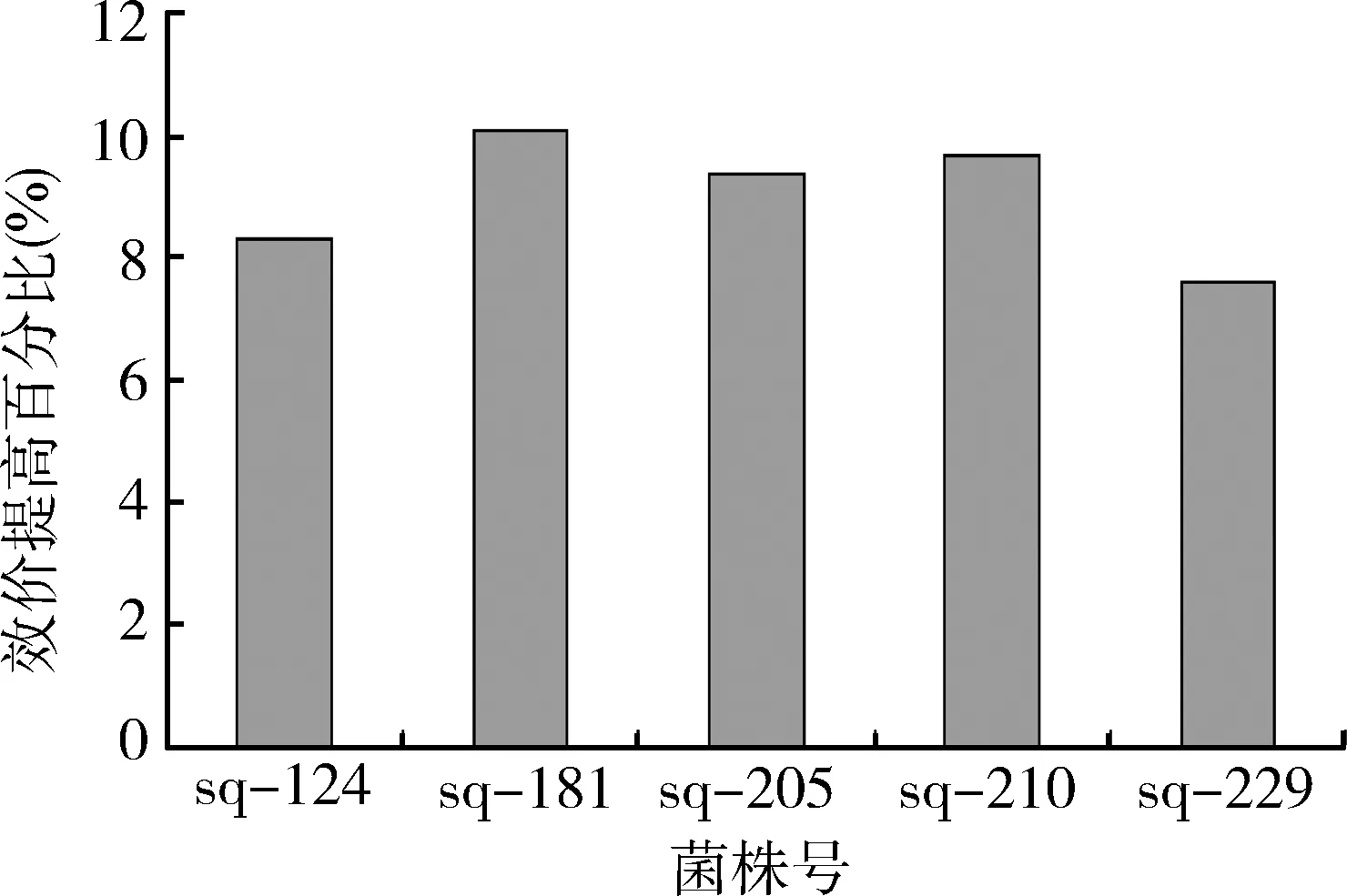
图5 耐DMSO突变株效价提高幅度
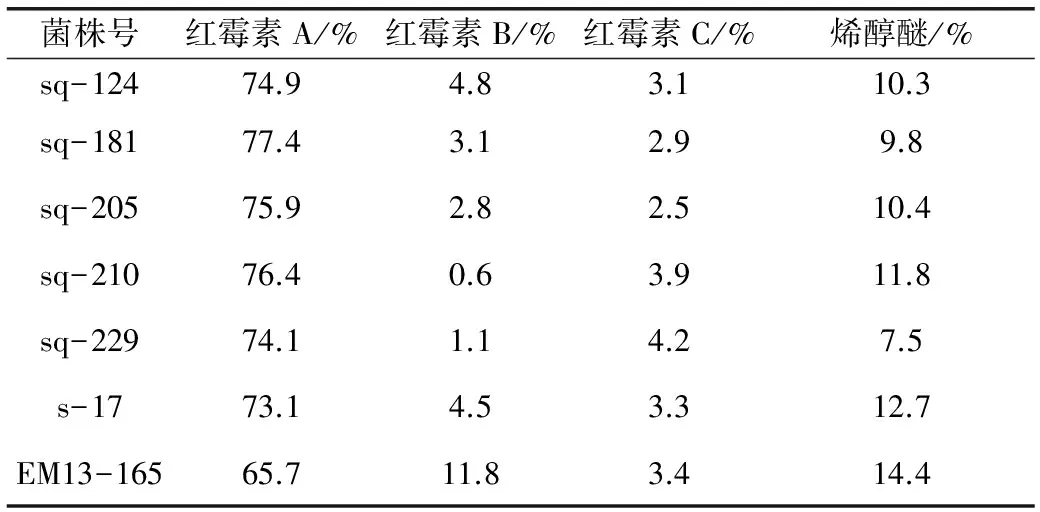
表5 高产菌株的红霉素A与其他相关物质的HPLC检测结果
2.7 高产突变株传代稳定性考察 将突变株sq-181、对照株EM13-165分别连续传4代,同批摇瓶验证,结果如表6。sq-181的F1~F3代发酵水平保持一致,未退化,与对照菌株相比传代稳定性有明显优势。
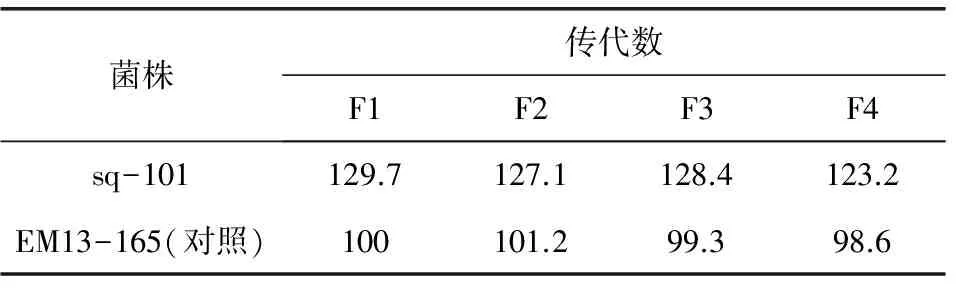
表6 新菌株传代稳定性考察
注:发酵水平相对对照菌株为100计算
3 讨论与小结
通过在红霉素发酵培养36 h时添加30000 μg/mL红霉素,筛选得到一株菌株s-17,其化学效价比对照提高22.4%。说明红色糖多孢菌对自身次生代谢产物的耐受程度与其产生抗生素水平有一定的内在联系。杜润泮等[12]对三株卡那霉素链霉菌进行直接筛选耐高浓度自身代谢产物的抗反馈和抗阻遏突变型,最终筛选出两株菌耐受卡那霉素水平提高近100倍,发酵单位比原始菌株分别提高33.3%和28.3%。于秀莲等[9]对一株降红小单孢菌进行摇瓶耐受自身代谢产物实验,得到一株新菌株,耐受庆大霉素的浓度大幅提高,生产能力提高22.8%。借鉴前人的经验,本文采用耐受高剂量红霉素的方法,直接淘汰低产菌株,取得了较好的效果。而本实验又将其与其他育种方法相结合,以s-17菌株为出发菌株进行耐受高浓度DMSO实验,同时使用ARTP作为新型的诱变手段,大大提高正变频率,筛选出一株菌株sq-181比出发菌株的效价提高10.1%。
DMSO是具有一定毒性的物质,添加量过多会导致红霉素效价显著下降,因此适时适量地添加DMSO才会在基本不影响菌体正常代谢的前提下提高红霉素效价。本实验未深入研究DMSO对菌体的负面影响,但因其毒性和化学性质,不可忽略可能带来的潜在不良后果。本文并未使用筛选得到的高产突变株进行发酵罐上罐验证,考察其增产效果,所以还有待今后更多的上罐发酵试验。但更重要的是摸索和改革发酵工艺,研究突变菌株的最适发酵条件,使得耐受高浓度自身代谢产物以及高浓度DMSO突变菌株的高产特性获得充分应用,为提高红霉素的发酵产量开辟一个新途径。
[1] Lambalot R H,Cane D E,Aparicio J J,etal.Overproduction and characterizat ion of the erythromycin C-12 hydroxylase,EryK [J].Biochemistry,1995,34(6) :1858.
[2] Shafiee A,Hutch inson C R. Macrolide antibioticbio synthesis: isolation and properties of two forms of 6-deoxyerythronolide B hydroxylase fromSaccharopolyspora[J]. Biochemistry,1987,26 (19) : 6204.
[3] Andersen J F,Tatsuta K,Gunji H,etal. Substrate specificity of 6-deoxy-eryth ronolide B hydroxylase,a bacterial cytochrome P450 of erythromycin A biosynthesis[J]. Biochemistry,1993,32: 1905.
[4] Stassi D, Donadio S,StaverM J,etal. Ident ification of aSaccharopolysporaerythraeagene required for the final hydroxylation step in eryth romycin biosynthesis[J]. J Bacteriol,1993,175 (1) : 182.
[5] 李安华,王艺军,王明道,等.绿僵菌羟基化16α,17α-环氧黄体酮的工艺研究[J].河南科学,2007,25(5):754—757.
[6] 丁盼盼,高淑红,陈长华,等.二甲基亚砜对红霉素合成的影响研究[J].化学与生物工程,2010,27(6):69-72.
[7] 于秀莲,方常福,于占祥.利用耐受自身代谢产物的方法提高庆大霉素的发酵单位[J].微生物学杂志,1994,14(2):55.
[8] 刘刚,刘必成,张卫兰,等.培养基中无机盐对红霉素A含量的影响[J].化学与生物工程,2009,26(8):80.
[9] 范代娣,党政,孙晓红,等. 红霉素摇瓶发酵实验工艺条件[J]. 西北大学学报,2000,30(1):43-44.
[10]南京药学院. 药物分析化学[M]. 南京:江苏科技出版社,l985:265-272.
[11]the United States Pharmacopoeia.30th Edition[S]. Rockuille M D: the United States Pharmacopoeia Convention,2007:3753-3754.
[12]杜润泮,赵静岩.卡那霉素链霉菌耐高浓度自身代谢产物的高产菌株的选育.抗生素[J].1983,8(1):24-28.
(编辑:侯向辉)
Screening of High Yield Erythromycin Producing Strain by Combined Drug Resistant Mutation
SHEN Xiao-jing, ZHANG Ping*, SHI Yan-peng
(NingxiaTairuiPharmaceuticalCo.,Ltd,StrainsInstitute,Yinchuan750101,China)
To improve the production of erythromycin,the mutated strains were selected by use of self-secondary metabolites.The mutant was further treated by ARTP and DMSO.The results showed that the chemical titre of erythromycin was increased by 22.4%of the control when 30000 μg/mL erythromycin was added into the medium at 36 h of fermentation ofSaccharopolysporaerythraea.The most suitable adding time of DMSO was at 48 h of fermentation and the most suitable volume fraction was 0.2%.Adding DMSO could increase the yield of erythromycin by 10.1%.
erythromycin;self-secondary metabolites resistant;dimethyl sulfoxide(DMSO); hereditary stability; atmospheric and room temperature plasma
沈小静,硕士,从事抗生素发酵菌种培养、选育研究。
张萍。E-mail: shiyanpeng@tairuiworld.com
2015-07-07
A
1002-1280 (2015) 09-0019-06
S859.796
