尼古丁乙醇脂质体的制备与体外透皮特性研究
2015-03-10张晓红杨苗苗戴尊孝西安市精神卫生中心西安710061
王 慧,张晓红,张 燕,杨苗苗,权 伟,戴尊孝(西安市精神卫生中心,西安 710061)
随着吸烟人数与日俱增,死于与吸烟有关疾病的人数也随之增加[1]。为此,世界卫生组织(WHO)提倡并于1996年向各国推荐了尼古丁替代法[2]。尼古丁替代法是采用非烟草的方式,向戒烟者提供小剂量安全性好的尼古丁制剂,使戒烟者尼古丁的摄取量达到最低,最终戒除香烟[3]。尼古丁是烟草的重要成分,研究表明,人体摄取尼古丁,反应性及注意力一定程度有所提高,焦虑明显降低[4]。尼古丁易透过人体皮肤,但其本身性质不稳定,很大程度上限制了其在药物研发中的应用。
乙醇脂质体凭借其良好的包封率及柔性,可携带药物进入皮肤深层,是皮肤局部用药较理想的载体[5]。为此,本实验研制了尼古丁乙醇脂质体并通过体外透皮实验研究其体外释药及透皮行为。
1 材料
1.1 仪器
高效液相色谱系统(日本岛津公司);JEM-1200EX型透射电镜(日本电子公司);激光动态光散射仪(英国马尔文仪器有限公司);Tcs Sp2型激光共聚焦显微镜(德国徕卡公司);RYJ-6B型药物透皮扩散试验仪(上海黄海药检仪器厂);RC-3B药物溶出仪(天津大学无线电厂);RE-52AA型旋转蒸发器(上海亚荣生化仪器厂)。
1.2 药品与试剂
尼古丁原料药(重庆博腾制药科技股份有限公司,批号:130211,纯度:>96%);大豆磷脂(PC,常州四药制药有限公司,批号:1208S02,含量:90%);罗丹明B(美国Sigma公司);水为去离子双蒸水。
1.3 动物
昆明种小鼠,♂,体质量为18~20 g,由兰州大学动物实验中心提供,合格证号为SCXK(甘)14-006。
透析袋(上海通善生物科技有限公司,截留分子质量:8 000~14 000)。
2 方法与结果
2.1 尼古丁乙醇脂质体的制备
采用注入法[6]制备尼古丁乙醇脂质体。精密称取尼古丁原料药0.3 mg、磷脂适量、乙醇4.5 ml,溶解,置于磁力搅拌器上,在密闭条件下边搅拌边缓慢注入5.5 ml磷酸盐缓冲液(PBS),搅拌30 min(整个过程温度保持在45~55 ℃范围内);超声20 min后,冷却至室温,微孔滤过,即得尼古丁乙醇脂质体。其中尼古丁含量为3%。采用透射电镜观察所制尼古丁乙醇脂质体的外观形态,结果显示,尼古丁乙醇脂质体外观为均一稳定的分散体系,大多数呈球形的双分子层囊泡结构,详见图1。

图1 尼古丁乙醇脂质体的电镜照片(×110 000)Fig 1 SEM photograph of nicotine ethosome(×110 000)
2.2 尼古丁脂质体和尼古丁乙醇溶液的制备
采用反相蒸发法制备尼古丁含量为3%的尼古丁脂质体。将尼古丁原料药溶于乙醇溶液中,制备尼古丁含量为3%的尼古丁乙醇溶液。
2.3 乙醇、磷脂用量对乙醇脂质体粒径和包封率的影响
由预试验可知,尼古丁乙醇脂质体受乙醇用量(占处方量的比例,V/V)和磷脂用量(占处方量的比例,m/V)的影响最大。本试验采用单因素试验考察0、25%、35%、45%乙醇和1%、2%、3%磷脂对尼古丁乙醇脂质体粒径和包封率的影响,粒径采用激光动态光散射仪测定,结果见表1。
表1 乙醇、磷脂用量对尼古丁乙醇脂质体粒径和包封率的影响()Tab 1 Effects of the amounts of ethanol and phospholipid on the particle size and encapsulation efficiency of the nicotine ethosome()

表1 乙醇、磷脂用量对尼古丁乙醇脂质体粒径和包封率的影响()Tab 1 Effects of the amounts of ethanol and phospholipid on the particle size and encapsulation efficiency of the nicotine ethosome()
由表1可见,与不含乙醇的处方10比较,加入乙醇的脂质体的粒径明显减小,包封率均增加。另外,固定乙醇浓度,增加磷脂含量,脂质体的粒径逐渐增大,包封率也随之增加;固定磷脂含量,增加乙醇浓度,脂质体的粒径逐渐减小,包封率逐渐增加。研究表明,粒径越小,包封率越大,脂质体越易携带药物经皮渗透[7]。因此筛选乙醇脂质体的处方为乙醇用量为35%,磷脂用量为3%。
2.4 尼古丁的含量测定
2.4.1 色谱条件 色谱柱:VP-ODS C18(150 mm×4.6 mm,5 μm);流动相:甲醇-0.02 mol/L醋酸铵-三乙胺(30 ∶60 ∶0.1,V/V/V),流速:1 ml/min;检测波长:365 nm;进样量:20 μl。
2.4.2 标准曲线的制备 精密称取尼古丁20 μg,置于50 ml量瓶,甲醇溶解,得质量浓度为400 μg/L的对照品溶液。用甲醇稀释适量对照品溶液,制备成质量浓度分别为6.25、12.5、25、50、75、100、200、400 μg/L的系列溶液,按“2.4.1”项下方法进样测定,记录峰面积。以质量浓度(x)为横坐标、峰面积(y)为纵坐标,进行线性回归,得标准曲线回归方程为y=87 345x+35 671(r=0.999 8)。结果表明,尼古丁检测质量浓度的线性范围为6.25~400 μg/L。
2.4.3 精密度试验 精密量取适量尼古丁对照品溶液,用甲醇稀释制备成低、中、高3种质量浓度(6.25、50、200 μg/L)的溶液,分别于同日内不同时间进样测定5次,考察日内精密度;另每日测定1次,连续测定3 d,考察日间精密度。结果显示,平均日内RSD为2.03%(n=5),平均日间RSD为2.18%(n=3),表明该方法精密度良好。
2.4.4 回收率试验 将空白乙醇脂质体置于5 ml量瓶,加入用甲醇稀释的6.25、50、200 μg/L尼古丁溶液,涡旋混合器上充分振荡混匀。取1 ml置于离心管中,10 000 r/min(离心半径为6 cm)离心5 min,吸取上清液,微孔滤膜滤过,取20 μl进样测定峰面积。计算平均回收率为99.70%,RSD为0.91%,表明该方法回收率良好。
2.5 尼古丁乙醇脂质体包封率测定
精密量取尼古丁乙醇脂质体4 ml,溶解于10 ml乙醇中,摇匀,微孔滤膜滤过,取20 μl进样测定,计算尼古丁总含量(H1)。再精密量取尼古丁乙醇脂质体4 ml,置于透析袋中,扎紧透析袋两头,放入100 ml含乙醇35%的PBS中,搅拌,达到平衡时间(6 h),量取透析液,微孔滤膜滤过,取20 μl进样测定峰面积,计算游离尼古丁含量(H2)。按公式计算尼古丁乙醇脂质体的包封率(EE,%)=(H1-H2)/H1×100%。
按“2.3”项下筛选的处方(磷脂、乙醇及尼古丁分别占处方量的3%、35%和3%)所制尼古丁乙醇脂质体的包封率为(89.13±6.12)%,RSD=0.28%(n=3)。
2.6 尼古丁乙醇脂质体的体外释放
取尼古丁乙醇脂质体、尼古丁脂质体及尼古丁乙醇溶液各3 ml,均含尼古丁90 mg,分别加至预处理好的透析袋中,扎紧两端袋口,固定于桨上[8]。释放条件:pH 7.4的PBS 500 ml,37 ℃,100 r/min。分别于0、3、6、8、10、12、14、16、18、20、24 h时取样2 ml,同时补充等量同温的PBS。取样液经微孔滤膜滤过,取20 μl进样测定峰面积,计算累积释放量,重复测定3次。3种制剂中尼古丁的累积释放曲线见图2。
由图2可知,在释放6 h时,尼古丁乙醇脂质体累积释放量为40%,而尼古丁脂质体释放量为62%,尼古丁乙醇溶液已达90%;经过24 h,尼古丁乙醇脂质体和尼古丁脂质体中的尼古丁基本达到完全释放。由此可见,尼古丁乙醇脂质体具有明显的缓释作用。
2.7 离体皮肤渗透试验
2.7.1 离体小鼠皮肤的制备 取健康小鼠,饲养1周,剪去背部毛,断颈处死,立即剥离背部皮肤,去除皮下组织,生理盐水冲洗、浸泡,贮藏于4 ℃冰箱中备用。
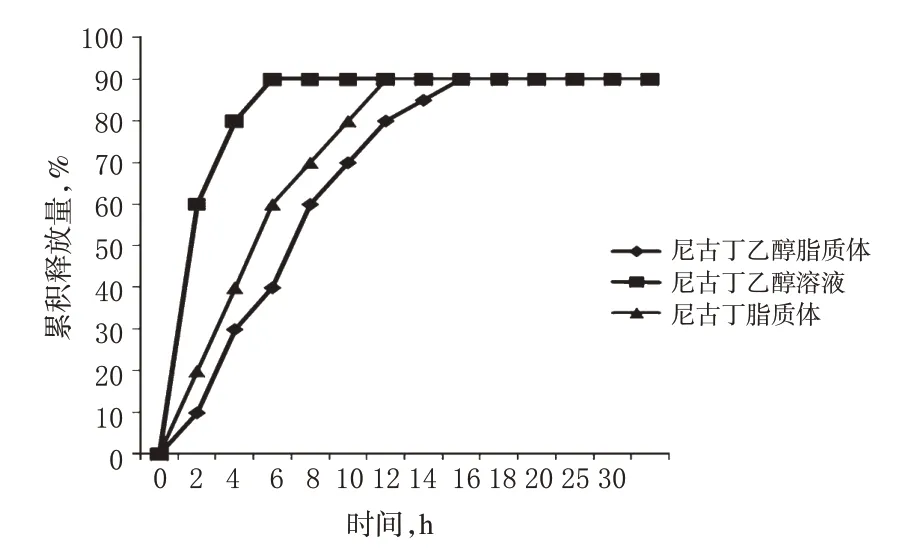
图2 3种制剂中尼古丁的累积释放曲线(n=3)Fig 2 Cumulative release curve of nicotine in 3 kinds of preparation(n=3)
2.7.2 体外经皮渗透试验[9]本试验在Franz扩散池中进行,供给室和接收室之间固定离体皮肤,有效渗透面积(扩散池)为2.5 cm2,接收液为pH 7.4的PBS,接收室体积为6 ml。分别取尼古丁乙醇脂质体、尼古丁脂质体和尼古丁乙醇溶液各0.3 ml,滴于与接收液接触的离体皮肤上,并将接收池置于(36±2)℃恒温水浴中,电磁搅拌(350 r/min)。分别于0、0.5、1、2、3、6、8、12、24 h精密量取2 ml接收液,同时补充等量恒温的接收液。取样液经微孔滤膜滤过,取20 μl进样测定含量,计算累积渗透量。重复测定3次。3种制剂中尼古丁的累积渗透曲线见图3。
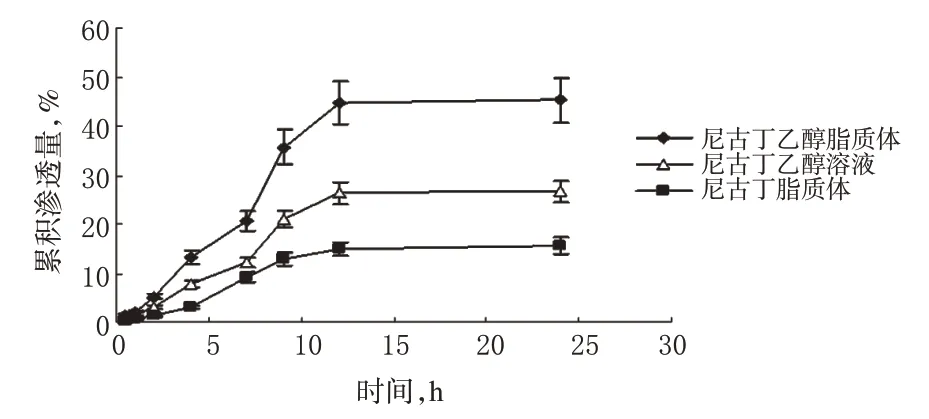
图3 3种制剂中尼古丁的累积渗透曲线(n=3)Fig 3 Cumulative penetrating curve of nicotine in 3 kinds of preparation(n=3)
由图3可知,12 h时尼古丁乙醇脂质体的累积渗透量最高(45%),尼古丁脂质体的累积渗透量最低(15%),但12 h时3种制剂的累积渗透量均达饱和。
2.8 渗透深度检测[10]
将含有0.03%罗丹明B的荧光剂分别加入尼古丁脂质体、尼古丁乙醇溶液和尼古丁乙醇脂质体中。将以上3种含有荧光剂的制剂及尼古丁乙醇脂质体分别均匀涂抹于同一只小鼠背部皮肤上,涂药面积约2 cm2。给药后12 h处死小鼠,取皮,立即用生理盐水冲洗涂药区域,剪取涂药中心区域约1 mm2,用共聚焦激光扫描显微镜对离体皮肤断层进行扫描并绘制曲线。4种制剂的共聚焦激光扫描图见图4,荧光强度-皮肤深度曲线见图5。
由图4、图5可见,尼古丁乙醇脂质体、尼古丁乙醇溶液及尼古丁脂质体在离体皮肤中最大荧光强度分别为168、75、36 AU,渗透深度分别为175、156、80 μm,而尼古丁乙醇脂质体(对照)几乎无荧光。表明与乙醇溶液和脂质体比较,乙醇脂质体可携带尼古丁进入皮肤深层。
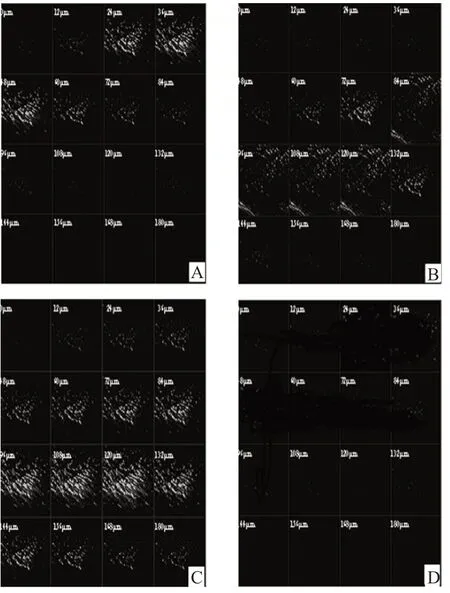
图4 4种制剂的共聚焦激光扫描图A.含罗丹明B的尼古丁脂质体;B.含罗丹明B的尼古丁乙醇溶液;C.含罗丹明B的尼古丁乙醇脂质体;D.尼古丁乙醇脂质体Fig 4 Confocal laser scanning micrograms of 4 kinds of preparationsA.rhodamine B-containing nicotine ethosome;B.rhodamine B-containing nicotine/ethanol solution;C.rhodamine B-containing nicotine ethosome;D.nicotine ethosome
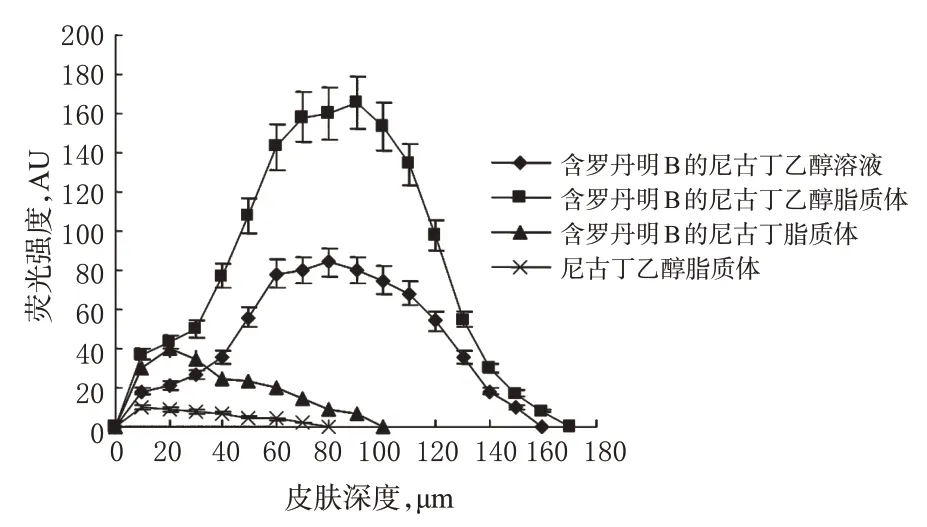
图5 4种制剂的荧光强度-皮肤深度曲线(n=5)Fig 5 Curves of fluorescence intensity-penetration depth in skin of 4 kinds of preparations(n=5)
2.9 稳定性试验
将尼古丁乙醇脂质体封装于锥形瓶中,放于冰箱(4 ℃)及室温下,每个月用动态光散射法测量样品的粒径及粒径分布,同时电镜观察乙醇脂质体结构,连续测定3个月。结果表明本品稳定性良好。
3 讨论
注入法制备的尼古丁乙醇脂质体形状均匀,平均粒径为105 nm。当磷脂与乙醇占处方量的3%和35%时为最佳处方,此时所制脂质体包封率最高(89.13±6.12)%,且室温及冰箱(4 ℃)放置3个月稳定性良好。体外释放实验表明,乙醇脂质体有明显的缓释作用。体外经皮渗透实验表明,乙醇脂质体透过离体皮肤进入PBS中的药量分别是乙醇溶液及脂质体的1.45倍和2.8倍。共聚焦激光扫描显微电镜试验表明,与乙醇溶液及脂质体相比,乙醇脂质体可携带药物进入皮肤深层,同时增大药物在皮内的滞留量。因而,尼古丁乙醇脂质体有望开发成为戒烟的有效制剂。
[1]欧汝威,郭晓燕,商慧芳.尼古丁治疗帕金森病的研究进展[J].中国神经精神疾病杂志,2013,39(11):703.
[2]Searles Nielsen S,Gallagher LG,et al.Environmental tobacco smoke and Parkinson disease[J].Mov Disord,2012,27(2):293.
[3]刘凤涛,贺蓉,赵远党,等.5-氟尿嘧啶乙醇脂质体的改性及其透皮吸收研究[J].中国药房,2008,19(25):1 938.
[4]Zhang JP,Wei YH,Zhou Y,et al.Ethosomes,binary ethosomes and transfersomes of terbinafine hydrochloride:a comparative study[J].Arch Pharm Res,2012,35(1):109.
[5]Zeng ZW,Wang XL,Zhang YD,et al.Preparagtion of matrine ethosome,its percutaneous permeation in vitro and anti-inflammatory activity in vivo in rats[J].J Liposome Res,2009,19(2):155.
[6]李国英,买尔旦·马合木提,古丽仙·胡加.新疆紫草提取物脂质体制备工艺的初步筛选[J].中国药房,2010,21(15):1 376.
[7]袁海玲,胡继民,魏玉辉,等.布洛芬二元醇脂质体的制备与评价[J].中国医院药学杂志,2012,32(14):1 111.
[8]王慧,魏玉辉,刘文静,等.盐酸阿莫罗芬乙醇脂质体的制备及评价[J].中国新药杂志,2010,19(13):75.
[9]袁海玲,胡继民,魏玉辉,等.布洛芬乙醇脂质体的制备及体外透皮特性研究[J].中国新药杂志,2013,22(3):351.
[10]Prasanthi D,Lakshm PK.Statistically optimised ethosomes for transdermal delivery of tolterodine tartrate[J].Pak J Pharm Sci,2013,26(6):1 117.
