灯盏乙素-PEG-PLGA载药纳米粒的制备及质量评价
2015-03-10祖洪碧李小华重庆市长寿区人民医院药学部重庆401220
祖洪碧,李小华(重庆市长寿区人民医院药学部,重庆 401220)
灯盏乙素(Scutellarin)即5,6,4′-三羟基黄酮-7-葡萄糖醛酸苷,是灯盏花素(Breviscapus)的主要有效成分,为菊科植物灯盏细辛(Erigeron breviscapus)的提取物。研究显示,灯盏乙素在降低血液黏度、降低外周阻力、扩张血管、增加动脉流量、减少血小板计数和抑制血小板凝集等方面都有很好的临床疗效[1-2]。目前,临床上其主要用于治疗脑供血不足、脑出血所致后遗症、脑血栓、冠心病、心绞痛等疾病[3]。但是,由于灯盏乙素水溶性很低、口服生物利用度差、半衰期短[4],使其临床使用受到了限制。聚乙二醇-聚乳酸/羟基乙酸共聚物(PEG-PLGA)为两亲性嵌段聚合物,具有较好的生物降解特征和生物相容性,几乎无细胞毒性,有利于提高药物的稳定性和透膜能力,达到缓释和长效的结果。基于此,本研究制备了灯盏乙素-PEG-PLGA载药纳米粒,以期改善灯盏乙素的体内特征,增加其药效。
1 材料
1.1 仪器
Agilent 1100型高效液相色谱仪(美国Agilent公司);Tecnai G2型透射电子显微镜(厦门亿辰科技有限公司);Zetasizer Nano ZS型纳米粒度及Zeta电位分析仪(英国Malvern仪器公司);RE-5250型旋转蒸发仪(上海亚荣生化仪器厂);GL-21M型高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);MS300型恒温磁力搅拌器(上海般特仪器有限公司);BS 210s型电子天平(德国Sartorius公司)。
1.2 药品与试剂
灯盏乙素对照品(批号:120914,纯度:99.58%)、灯盏乙素原料药(批号:120915,纯度:99.20%)均购自昆明龙津药业有限公司;PEG-PLGA(上海丽昂化学有限公司);泊洛沙姆188(P188,湖北武汉健源化工有限公司);聚山梨酯80和聚山梨酯20(天津市博迪化工有限公司);丙酮(东莞市乔科化学有限公司);乙酸乙酯、二氯甲烷购自深圳市科天化玻仪器有限公司,甲醇、乙腈为色谱纯,水为室验室自制的超纯水。
2 方法与结果
2.1 灯盏乙素的含量测定
2.1.1 色谱条件 色谱柱:WelchromTMC18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.2%磷酸溶液(20∶80,V/V),流速:1 ml/min;检测波长:335 nm;柱温:30 ℃;进样量:20 μl。该色谱条件下,灯盏乙素的出峰时间为9.7 min,其他辅料不干扰灯盏乙素的测定。
2.1.2 标准曲线制备 精密称取灯盏乙素对照品15.06 mg,用甲醇溶解并稀释成质量浓度分别为7.53、15.06、30.12、60.24、90.36、120.48 μg/ml的系列对照品溶液,按“2.1.1”项下色谱条件进样测定,记录峰面积。以峰面积(y)为纵坐标、质量浓度(c)为横坐标,进行回归分析,得回归方程为y=19 764.52c+583.74(r=0.999 7)。结果表明,灯盏乙素检测质量浓度的线性范围为7.53~120.48 μg/ml。
2.1.3 回收率试验 取质量浓度为15.06、30.12、90.36 μg/ml的灯盏乙素对照品溶液,按“2.1.1”项下色谱条件进样测定,记录峰面积,代入回归方程计算质量浓度,以实测值与真实值之比计算回收率。结果,低、中、高质量浓度灯盏乙素对照品溶液的回收率分别为(99.05±4.84)%、(99.58±3.70)%、(100.31±2.27)%,RSD均小于12%(n=5)。
2.1.4 稳定性试验 取质量浓度为15.06、30.12、90.36 μg/ml的灯盏乙素对照品溶液,于室温放置4 h后,进样测定。结果测定值与0 h的偏差分别为1.79%、1.27%、1.08%(n=5),表明该对照品溶液在室温条件下放置4 h稳定。
2.2 灯盏乙素-PEG-PLGA载药纳米粒的制备
采用复乳-溶剂蒸发法制备灯盏乙素-PEG-PLGA。首先将适量的灯盏乙素溶于水中,取适量体积的灯盏乙素水溶液加入一定体积的有机相中,水浴超声制得初乳,然后将初乳注入到一定体积的乳化剂水溶液中,超声20 min得到复乳。将复乳旋转蒸发,除去全部的有机溶剂,于4 ℃、离心半径10 cm、16 000 r/min低温高速离心40 min后,除去上清液,得到灯盏乙素-PEG-PLGA载药纳米粒。
2.3 指标检测
采用Zetasizer Nano ZS型纳米粒度及Zeta电位分析仪测定所制灯盏乙素-PEG-PLGA载药纳米粒的粒径和粒径分布指数(PDI)。采用高速离心法分离灯盏乙素-PEG-PLGA载药纳米粒,以甲醇破乳,以纳米粒的质量与游离药物质量进行包封率(ER)的考察[5],包封率计算公式为ER=(1-m游/m总)×100%。
2.4 单因素试验筛选处方
2.4.1 不同有机相对纳米粒的影响 以粒径、PDI、包封率为指标,分别以丙酮、乙酸乙酯和二氯甲烷为有机相,按“2.2”项下方法制备纳米粒,考察不同有机相对纳米粒的影响。结果显示,3种有机相所制纳米粒的粒径依次为(73.4±1.2)、(79.6±1.7)、(85.3±3.1)nm,PDI依次为0.102、0.137、0.294,包封率依次为(33.68±1.11)%、(29.12±1.36)%、(21.44±1.75)%,n=3。这表明采用丙酮制得的纳米粒具有较小的粒径和PDI值,且包封率较高,因此选择丙酮作为有机相。
2.4.2 内水相与有机相不同比例对纳米粒的影响 以粒径、PDI、包封率为指标,以内水相与有机相比例分别为1∶5、1∶10、1∶15,按“2.2”项下方法制备纳米粒,考察不同内水相与有机相比例对纳米粒的影响。结果显示,内水相与有机相3种比例所制纳米粒的粒径依次为(71.1±1.3)、(73.5±1.6)、(75.2±1.9)nm,PDI依次为0.104、0.102、0.199,包封率依次为(33.59±1.21)%、(30.22±1.19)%、(25.36±1.69)%,n=3。这表明内水相和有机相的比例为1∶5时所制纳米粒粒径较小,包封率较高。虽然比例为1∶10时所制纳米粒PDI略低于比例为1∶5时,但综合考虑,选择内水相和有机相的比例为1∶5。
2.4.3 不同乳化剂对纳米粒的影响 以粒径、PDI、包封率为指标,以泊洛沙姆、聚山梨酯80和聚山梨酯20为乳化剂,按“2.2”项下方法制备纳米粒,考察不同乳化剂对纳米粒的影响。结果显示,3种乳化剂所制纳米粒的粒径依次为(76.4±1.6)、(72.6±1.5)、(78.9±1.8)nm,PDI依次为0.103、0.105、0.176,包封率依次为(34.63±1.25)%、(35.82±1.33)%、(27.25±1.57)%,n=3。这表明采用聚山梨酯80为乳化剂时所制纳米粒具有较小的粒径和较高的包封率,综合考虑,选择聚山梨酯80为乳化剂。
2.4.4 聚山梨酯80不同体积分数对纳米粒的影响 以粒径、PDI、包封率为指标,以聚山梨酯80体积分数分别为0.2%、0.5%、1%,按“2.2”项下方法制备纳米粒,考察聚山梨酯80不同体积分数对纳米粒的影响。结果显示,3种体积分数的聚山梨酯80所制纳米粒的粒径依次为(74.5±1.6)、(73.8±1.5)、(75.3±1.9)nm,PDI依次为0.107、0.105、0.110,包封率依次为(32.35±1.28)%、(36.27±1.25)%、(35.96±1.38)%,n=3。这表明聚山梨酯80体积分数为0.5%时所制纳米粒包封率较高,且3种体积分数的聚山梨酯80对纳米粒的粒径和PDI值影响不大,因此聚山梨酯80的体积分数确定为0.5%。
2.4.5 初乳与外水相不同比例对纳米粒的影响 以粒径、PDI、包封率为指标,以初乳与外水相比例分别为1 ∶5、1 ∶10、1 ∶15,按“2.2”项下方法制备纳米粒,考察初乳与外水相不同比例对纳米粒的影响。结果显示,初乳与外水相3种比例所制纳米粒的粒径依次为(76.3±2.1)、(79.4±2.5)、(69.5±2.2)nm,PDI依 次 为0.101、0.126、0.103,包封率依次为(21.36±2.25)%、(33.57±2.67)%、(49.33±2.31)%,n=3。这表明初乳与外水相的比例为1 ∶15时所制纳米粒包封率较高、粒径较小,因此选择初乳与外水相的比例为1∶15。
2.4.6 不同质量浓度灯盏乙素对纳米粒的影响 以粒径、PDI、包封率为指标,以灯盏乙素质量浓度分别为5、10、20 mg/ml,按“2.2”项下方法制备纳米粒,考察不同质量浓度灯盏乙素对纳米粒的影响。结果显示,3种质量浓度灯盏乙素所制纳米粒的粒径依次为(81.2±2.3)、(76.6±1.8)、(79.2±2.1)nm,PDI依次为0.093、0.095、0.120,包封率依次为(31.59±1.05)%、(47.33±1.17)%、(34.86±2.01)%,n=3。这表明灯盏乙素质量浓度为10 mg/ml时所制纳米粒具有较高的包封率、较小的粒径。
2.4.7 不同质量浓度PEG-PLGA对纳米粒的影响 以粒径、PDI、包封率为指标,以PEG-PLGA质量浓度分别为5、15、25 mg/ml,按“2.2”项下方法制备纳米粒,考察不同质量浓度PEG-PLGA对纳米粒的影响。结果显示,3种质量浓度PEGPLGA所制纳米粒的粒径依次为(81.7±2.9)、(77.5±2.2)、(79.4±2.7)nm,PDI依次为0.131、0.117、0.119,包封率依次为(40.22±1.37)%、(45.76±1.25)%、(42.33±1.28)%,n=3。这表明PEG-PLGA质量浓度为15 mg/ml时所制纳米粒粒径较小、包封率较高,因此选择PEG-PLGA质量浓度为15 mg/ml。
2.5 正交试验优选处方
选取对包封率影响较大的初乳与外水相的比例(A)、灯盏乙素质量浓度(B)、PEG-PLGA质量浓度(C)为因素,以包封率为指标,进行正交试验优化处方。因素与水平见表1,正交试验结果见表2,方差分析结果见表3。
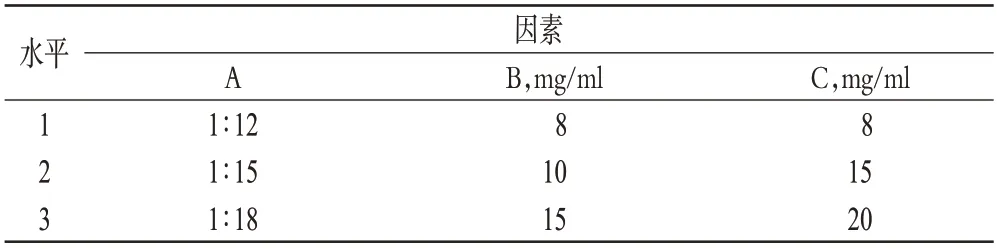
表1 因素与水平Tab 1 Factors and levels
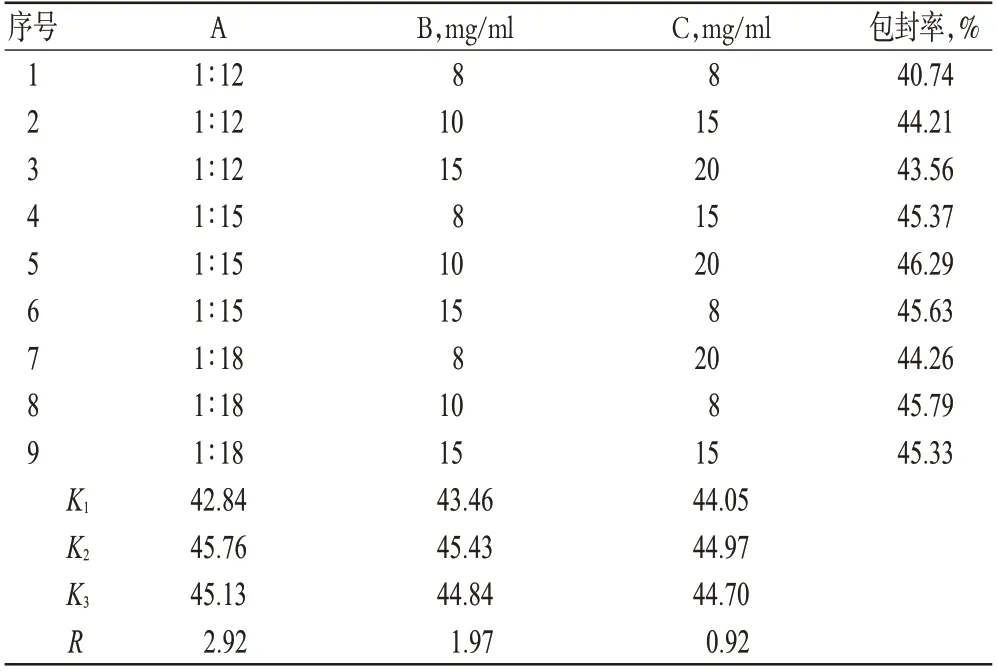
表2 正交试验结果Tab 2 Result of orthogonal test results and range

表3 方差分析结果Tab 3 Results of variance analysis
由表2和表3结果可知,影响包封率的因素依次为A>B>C,但相关因素对微乳的影响差异无统计学意义(P>0.05)。根据试验结果,选择最优处方为A2B2C2,即初乳与外水相的比例为1 ∶15,灯盏乙素质量浓度为10 mg/ml,PEG-PLGA质量浓度为15 mg/ml。
2.6 灯盏乙素-PEG-PLGA载药纳米粒的质量评价
2.6.1 表观形态 采用透射电镜观察纳米粒的形貌,结果显示,灯盏乙素-PEG-PLGA载药纳米粒为圆形或者椭圆形,粒径为70~80 nm。灯盏乙素-PEG-PLGA载药纳米粒的透射电镜图见图1。
2.6.2 粒径与Zeta电位 试验结果显示,灯盏乙素-PEGPLGA载药纳米粒的平均粒径为(78.54±2.21)nm,Zeta电位为(-23.07±1.39)mV。灯盏乙素-PEG-PLGA纳米粒的粒径分布图见图2。
2.6.3 包封率和载药量测定 试验结果显示,灯盏乙素-PEGPLGA载药纳米粒的载药量为(1.67±0.12)%,包封率为(45.32±1.29)%。
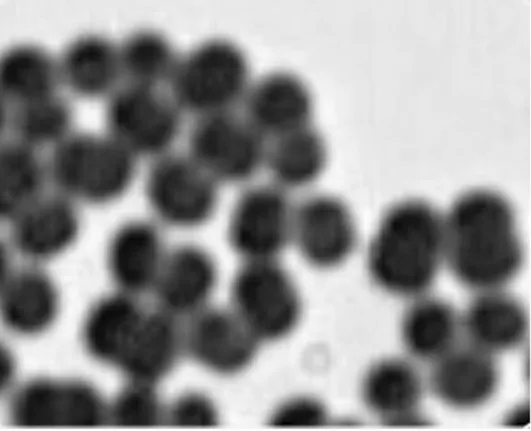
图1 灯盏乙素-PEG-PLGA载药纳米粒的透射电镜图Fig 1 Transmission electron microscopy figure of scutellarin-PEG-PLGA nanoparticles
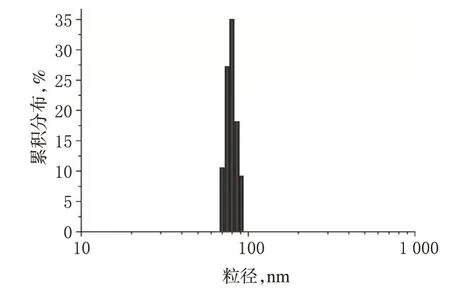
图2 灯盏乙素-PEG-PLGA纳米粒的粒径分布图Fig 2 Particle size distributions of scutellarin-PEG-PLGA nanoparticles
2.6.4 稳定性考察 将灯盏乙素-PEG-PLGA载药纳米粒分装于安瓿瓶中,于4 ℃条件下保存。分别在保存1、2、3个月时取出样品测定其粒径和包封率,评价其4 ℃条件下保存的稳定性。结果显示,在不同时间测定样品,其粒径和包封率都无明显变化,表明灯盏乙素-PEG-PLGA载药纳米粒在4 ℃条件下,3个月内能保持稳定。
3 讨论
目前,临床上用到的灯盏花素剂型主要为片剂、颗粒剂、注射剂、注射用无菌粉末等[6-7],此外,也有多种速释制剂以及缓控释制剂处于研发阶段。由于其理化性质制约着其疗效的发挥,各种新型制剂的研发、改善其体内过程以增加其疗效,成为灯盏花素药物研究当中的一个趋势[8-9]。
PEG-PLGA是以聚乙醇酸和聚乳酸聚合而成,其核心成分为PLGA,聚乳酸亲水性较差、降解较慢,而聚乙醇酸则亲水性较好、降解较快,两者结合在一起有利于完善其化学性质,可对药物产生较强的保护作用,且具有较强的靶向性[10-11]。将灯盏乙素制备成灯盏乙素-PEG-PLGA载药纳米粒有利于其被巨噬细胞吞噬到达网状内皮系统,延缓药物的释放,且可以使药物在肠道停留时间延长,增加其吸收;此外,有利于保护药物,减少胃酸对其破坏,提高药物的体内稳定性,有利于提高药物的透膜能力。目前,PEG-PLGA被公认为一种良好的生物可降解材料,广泛应用于药物新剂型的设计。
本试验制备灯盏乙素-PEG-PLGA载药纳米粒的工艺简单、制剂稳定性好,有利于实现灯盏乙素体内的长效循环以及增加其透过血脑屏障的量。后续将进一步对其体内外特征进行研究,为灯盏乙素新剂型的开发和临床使用提供参考。
[1]杨丽梅,顾军,林明建,等.灯盏花素的研究进展[J].天津药学,2010,22(1):56.
[2]韩俊江.灯盏花素的器官保护功能研究进展[J].天津药学,2011,23(5):42.
[3]周莉.灯盏花素的心脑血管药理及临床研究进展[J].中医药信息,2013(6):134.
[4]吴俊珠,严亚,高鹏飞.灯盏花素吸收与促进吸收策略的研究进展[J].中国实验方剂学杂志,2010,16(9):219.
[5]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录203.
[6]方睿,杜树山.灯盏花素制剂研究进展[J].中国实验方剂学杂志,2011,17(4):233.
[7]崔亚男,管华,张强.制剂新剂型新技术在灯盏花素研究中的应用进展[J].中国新药杂志,2013,22(18):2 152.
[8]钟海军,邓英杰,徐春莲,等.灯盏花素的理化性质研究[J].中国药房,2013,24(7):608.
[9]方睿,杜树山.灯盏花素制剂研究进展[J].中国实验方剂学杂志,2011,17(4):233.
[10]陈刚,李玉民,刘涛,等.PEG-PLGA纳米颗粒载体药物靶向治疗肿瘤的研究进展[J].国际外科学杂志,2010,37(6):417.
[11]刘布鸣,韦宝伟.聚乳酸乙醇酸在微球控释制剂中的研究进展[J].现代药物与临床,2012,27(2):155.
