褐藻素诱导人宫颈癌HeLa细胞的自噬作用机制研究
2015-03-10廖政邦于五辈东莞市第五人民医院广东东莞53900河南大学药学院化学生物学研究所河南开封475004
廖政邦,于五辈,赵 辉#(1.东莞市第五人民医院,广东东莞 53900;.河南大学药学院化学生物学研究所,河南开封 475004)
宫颈癌是病死率最高的常见妇科肿瘤,严重威胁着女性健康。复发的宫颈癌往往对临床常用的抗肿瘤药物耐药,因此亟需开发以新方式引起肿瘤细胞死亡的药物以克服耐药[1]。自噬是继凋亡和坏死后发现的第3种细胞死亡形式,虽然细胞通过自噬可以降解受损、衰老和失去功能的大分子或细胞器,维持细胞的内稳态,但自噬的过度激活又会损伤细胞器,促进自噬性细胞死亡。近年来发现很多药物可通过诱导肿瘤细胞自噬产生抗肿瘤作用,例如维生素K3可通过细胞外调节蛋白激酶(Extracellular regulated protein kinases,ERK)途径介导宫颈癌HeLa细胞发生自噬[2];麦冬皂苷B通过抑制蛋白激酶B(Protein kinase B,PKB,又称Akt)、哺乳动物雷帕雷素靶蛋白(mTOR)通路介导HeLa细胞自噬[3]。以上研究表明,诱导肿瘤发生自噬是研发抗肿瘤药物的一种有效策略[4]。
褐藻素(Fucoxanthin)是一种具有独特结构的海洋类胡萝卜素成分,具有消痰、软坚散结、利水作用。现代医学研究表明,褐藻素具有抗肿瘤、促凋亡、抗炎及清除自由基等药理作用。已有研究表明,褐藻素可通过抑制Akt、mTOR的磷酸化来诱导肝癌HepG2细胞发生凋亡和自噬[5]。由于药物抗肿瘤作用机制往往取决于肿瘤类型,因而褐藻素是否对宫颈癌具有抗肿瘤作用尚不得而知,本研究对褐藻素抗宫颈癌作用及其分子机制进行了研究。
1 材料
1.1 仪器
FACSCalibur型流式细胞仪(美国BD公司);DMI3000B型倒置荧光显微镜(德国徕卡公司);Multiskan Spectrum型全波长酶标仪(美国热电公司)。
1.2 药品与试剂
胰蛋白酶、RPMI1640培养液、胎牛血清(美国Gibco公司);褐藻素(纯度:98.0%)、洛霉素A1(Baf A1,纯度:98.0%)、新雷素(纯度:>98%)、氯化铵(NH4Cl)、MTT、核糖核酸酶(RNase)A、吖啶橙、3-甲基腺嘌呤(3-MA,纯度:98.0%)、U0126(纯度:98.0%)、碘化丙啶、一抗均购自美国Sigma公司;细胞裂解液试剂盒、Lyso-Tracker Red、Hoechst33342、AnnexinⅤ-FITC凋亡试剂盒均购于上海碧云天生物技术有限公司;Akt一抗、phospho-Akt(p-Akt)一抗、p21一抗、CDK2一抗、Cyclin D1一抗、Phospho-p70S6 kinase(p-p70S6K,Thr389)一抗、PTEN一抗、Phospho-mTOR(p-mTOR)一抗均购于美国Cell Signaling Technology公司;Beclin-1、LC3及相应二抗均购自美国Santa Cruz公司。
1.3 细胞
HeLa细胞购于中国科学院上海细胞生物学研究所。
2 方法
2.1 细胞的培养[5]
细胞冻存液清洗后,加入RPMI1640培养液重悬细胞沉淀至细胞培养瓶中,置37 ℃、5%CO2培养箱中培养。
2.2 细胞抑制率测定
取对数生长期的细胞,调整细胞密度为5×105ml-1并接种于96孔培养板,培养12 h使细胞贴壁。以1、10、20、40、80 μmol/L褐藻素,1、10、20、40、80 μmol/L褐藻素+3-MA(5 mmol/L)培养细胞48 h。于试验终止前4 h每孔加入MTT(5 mg/ml)10 μl,37 ℃下继续孵育4 h后,终止培养。每孔加入二甲基亚砜100 μl,37 ℃下振荡30 min后,以酶标仪于570 nm波长处测定光密度(OD),以OD代表细胞活力并计算细胞抑制率与半数抑制浓度(IC50)[5]。
2.3 细胞周期与凋亡测定
取对数生长期的细胞,调整细胞密度为5×105ml-1并接种于96孔培养板,培养12 h使细胞贴壁。以0(空白对照)、10、20、40 μmol/L褐藻素培养细胞48 h。同一浓度重复3孔。培养细胞结束后以70%冰冷乙醇固定过夜,RNase A(50 μg/ml)处理后碘化丙啶(100 g/ml)避光染色,以流式细胞仪分析细胞周期分布;培养细胞结束后按照Annexin V-FITC凋亡检测试剂盒说明书处理细胞,以流式细胞仪分析细胞凋亡率[5]。
2.4 细胞自噬测定(自噬剂:3-MA)
2.4.1 吖啶橙染色法 取对数生长期的细胞,以5 000个/孔细胞接种于6孔板,以40 μmol/L褐藻素培养细胞48 h,弃去培养基。同一浓度重复3孔。吖啶橙(1 mg/ml)避光染色15 min,荧光显微镜观察并拍照,当细胞内酸性小囊泡增多时吖啶橙由绿色荧光转变成红色荧光。自噬抑制性试验则加入自噬抑制剂3-MA(5 mmol/L)培养细胞2 h后,再加入40 μmol/L褐藻素培养细胞48 h,弃去培养基,染色方法同上[6]。试验设空白对照(0 μmol/L)。
2.4.2 Lyso-Tracker Red染色法 取对数生长期的细胞,以5 000个/孔细胞接种于6孔板,以40 μmol/L褐藻素培养细胞48 h,弃去培养基。同一浓度重复3孔。加入Lyso-Tracker Red(50 nmol/L)37 ℃避光染色45 min,Hoechst 33342(1 μmol/L)复染15 min,荧光显微镜观察并拍照,当溶酶体数量增加时红色荧光增强。自噬抑制性试验则加入自噬抑制剂3-MA(5 mmol/L)培养细胞2 h后再加入40 μmol/L褐藻素培养细胞48 h,弃去培养基,染色方法同上[6]。试验设空白对照(0 μmol/L)。
2.4.3 稳定转染HeLa-GFP-LC3细胞测试法 选择对数生长期细胞加入自噬抑制剂3-MA(5 mmol/L)培养细胞2 h,进行pGFP-LC3质粒转染,用新霉素筛选细胞克隆。收获HeLa-GFP-LC3细胞以5 000个/孔接种于6孔板,40 μmol/L褐藻素培养细胞48 h后,磷酸盐缓冲液(PBS)洗3次,荧光显微镜观察并拍照。细胞内绿色荧光呈点状分布则说明细胞发生自噬,反之呈弥散性绿色荧光。对于自噬抑制性试验则为加入自噬抑制剂3-MA(5 mmol/L)培养细胞2 h后再加入40 μ mol/L褐藻素培养细胞48 h,弃去培养基,染色方法同上[7]。试验设空白对照(0 μmol/L)。
2.5 细胞自噬相关蛋白的测定
以Western blot法测定蛋白表达。取对数生长期的细胞,调整细胞密度为5×105ml-1并接种于96孔培养板,培养12 h使细胞贴壁,单独加入40 μmol/L褐藻素或者先加入自噬抑制剂3-MA(5 mmol/L)或U0126(10 μmol/L)培养细胞2 h后再加入40 μmol/L褐藻素,继续培养细胞48 h后,PBS洗3次,以离心半径为13.5 cm、1 000 r/min离心5 min后用细胞裂解液裂解细胞。同一浓度重复3孔。蛋白定量后取50 μg蛋白加入上样缓冲液,95 ℃变性10 min。8%聚丙烯酰胺-十二烷基磺酸钠(SDS)凝胶电泳,电转移至硝酸纤维素膜上,5%脱脂奶粉封闭后依次加入相应的一抗和二抗,室温孵育2 h,TBST缓冲液洗涤5次,每次10 min。凝胶成像系统分析细胞自噬相关蛋白条带[5]。试验设空白对照(0 μmol/L)。
2.6 自噬流量测定
取对数生长期的细胞,调整细胞密度为5×105ml-1并接种于96孔培养板,培养12 h使细胞贴壁。单独加入10 μmol/L褐藻素或先加入自噬抑制剂Baf A1或NH4Cl后,再加入10 μmol/L褐藻素,继续培养细胞48 h,测定LC-3Ⅰ、LC-3Ⅱ、p62表达水平。对于溶酶体内Cathepsin D检测,则分别加入10、20、40 μmol/L褐藻素培养细胞48 h后,PBS洗3次,以离心半径为13.5 cm、1 000 r/min离心5 min,用细胞裂解液裂解细胞后,测定Cathepsin D表达水平。同一浓度重复3孔。蛋白定量后取50 μg蛋白加入上样缓冲液,95 ℃变性10 min。8%聚丙烯酰胺-SDS凝胶电泳,电转移至硝酸纤维素膜上,5%脱脂奶粉封闭后依次加入相应的一抗和二抗,室温孵育2 h,TBST缓冲液洗涤5次,每次10 min。凝胶成像系统分析蛋白条带[5]。试验设空白对照(0 μmol/L)。
2.7 统计学方法
采用SPSS 12.0软件处理试验数据。各组数据均为计量资料,以表示,采用t检验进行分析。P<0.05为差异有统计学意义。
3 结果
3.1 细胞抑制率测定结果
1、10、20、40、80 μmol/L褐藻素培养细胞48 h后,对细胞生长具有明显抑制作用,且呈浓度依赖关系,IC50为(55.1±7.6)μmol/L。细胞抑制率测定结果见表1。
表1 细胞抑制率测定结果(,n=3)Tab 1 Determination results of cell inhibition rate(,n=3)

表1 细胞抑制率测定结果(,n=3)Tab 1 Determination results of cell inhibition rate(,n=3)
3.2 细胞周期与凋亡测定结果
与空白对照比较,10、20、40 μmol/L褐藻素培养细胞48 h后,可剂量依赖性地阻滞细胞于G0/G1期,但对细胞凋亡无显著影响。细胞周期与凋亡测定结果见表2。

表2 细胞周期与凋亡测定结果Tab 2 Determination results of cell cycle and apoptosis
3.3 细胞自噬测定结果
吖啶橙染色结果表明,经40 μmol/L褐藻素处理48 h后,HeLa细胞内红色荧光明显增强,提示细胞内的酸性小囊泡增多;Lyso-Tracker Red染色结果进一步提示褐藻素可诱导溶酶体数量的增多及活性的增强;HeLa-GFP-LC3细胞内点状绿色荧光明显增多,而空白对照细胞内呈现弥散性绿色荧光。细胞自噬测定结果见图1。
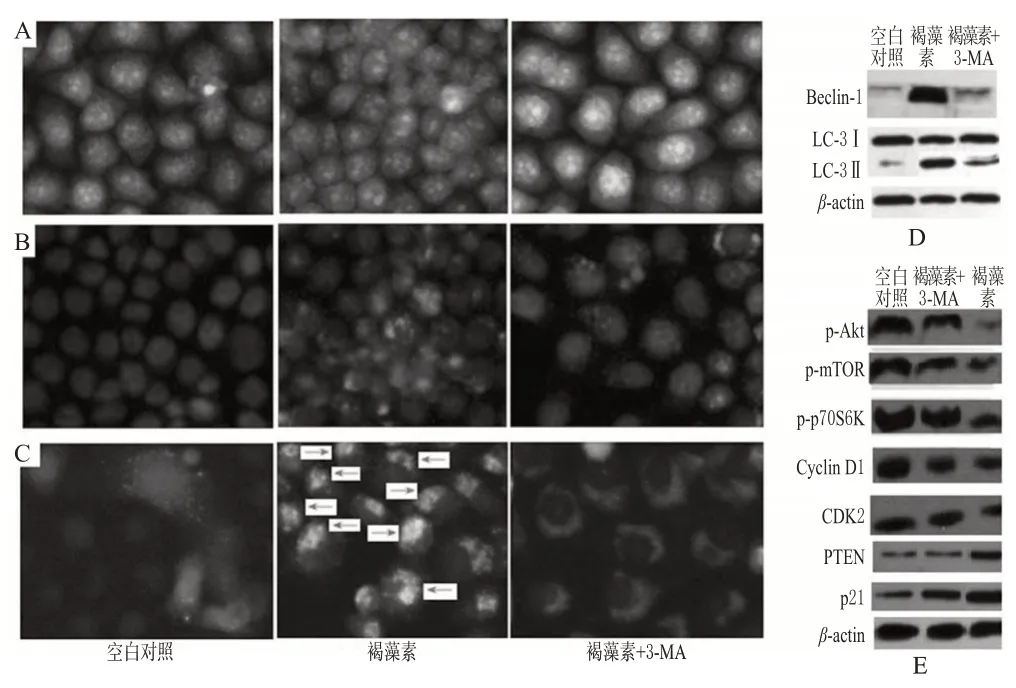
图1 细胞自噬与相关蛋白测定结果(×20)A.吖啶橙染色;B.LysoTracker Red染色;C.HeLa-GFP-LC3细胞测试法;D.Beclin-1和LC3Ⅰ、LCⅡ表达;E.p-Akt、p-mTOR、p-p70S6K、Cyclin D1、CDK2、PTEN、p21表达Fig 1 Determination results of autophagy and related protein(s×20)A.acridine orange staining;B.LysoTracker Red staining;C.HeLa-GFPLC3 cell method;D.Beclin-1 and LC3Ⅰ,LCⅡexpression;E.p-Akt,p-mTOR,p-p70S6K,Cyclin D1,CDK2,PTEN,p21 expression
3.4 细胞自噬相关蛋白的测定结果
40 μmol/L褐藻素可增强自噬标志性蛋白Beclin-1的表达,可促进LC3 Ⅰ转变为LC3 Ⅱ,提示褐藻素诱导细胞发生了自噬。与空白对照比较,40 μmol/L褐藻素作用细胞48 h后,p-Akt及其下游靶蛋白p70S6K和p-mTOR表达减弱,总Akt蛋白表达并无明显改变;Akt信号通路的负调控蛋白PTEN表达增强,提示褐藻素通过Akt/mTOR信号通路诱导HeLa细胞发生了自噬。与空白对照比较,40 μmol/L褐藻素可抑制CDK2、Cyclin D1蛋白表达,增强p21蛋白表达。自噬抑制剂3-MA几乎完全逆转褐藻素对HeLa细胞的生长抑制作用,但对细胞凋亡无明显影响,提示褐藻素的生长抑制作用取决于自噬的发生。此外,3-MA部分逆转褐藻素对自噬相关蛋白表达的调控。细胞自噬相关蛋白的测定结果(自噬剂:3-MA)见图1。
3.5 细胞自噬流量测定结果
自噬的发生是一个连续的动态过程,自噬流量的检测能反映该过程。Baf A1是囊泡H+ATPases特异性抑制剂,可抑制酸性溶酶体和自噬体/溶酶体的形成。结果显示Baf A1可明显增加褐藻素诱导的LC3 Ⅱ蛋白的表达。NH4Cl通过抑制溶酶体酸化可以抑制自噬底物的降解,结果显示NH4Cl明显逆转了褐藻素诱导的p62表达降低。此外,褐藻素浓度依赖性地诱导分布在溶酶体内Cathepsin D表达上调。细胞自噬流量测定结果(自噬剂:Baf A1或NH4Cl)见图2。
3.4 细胞自噬相关蛋白测定结果(自噬剂:U0126)
综合上述试验可知,自噬发生的分子机制涉及多种信号通路。由于3-MA并不完全抑制褐藻素对AKT/mTOR信号通路中关键蛋白的调控,提示可能有其他信号通路参与褐藻素诱导的细胞自噬。经过筛选,笔者发现褐藻素活化MEK/ERK信号通路,而MEK抑制剂U0126不仅可以抑制MEK/ERK信号通路的活化,而且可以部分逆转褐藻素诱导的Beclin-1表达增强及LC3 Ⅰ转变为LC3 Ⅱ,提示MEK/ERK信号通路也参与了褐藻素诱导的细胞自噬。细胞自噬相关蛋白测定结果(自噬剂:U0126)见图3。
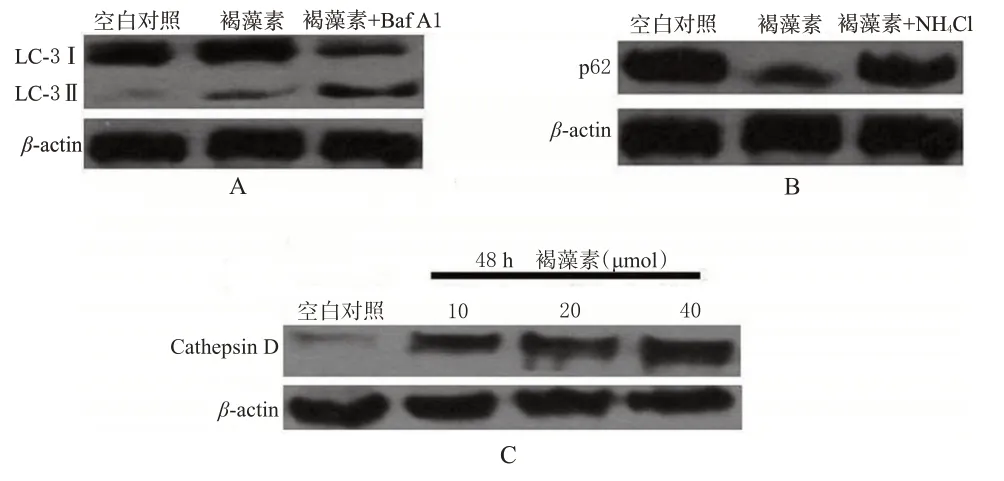
图2 细胞自噬流量测定结果(自噬剂:Baf A1或NH4Cl)A.褐藻素+Baf A1;B.褐藻素+NH4Cl;C.褐藻素Fig 2 Determination results of autophagy flow of cell(sautophagy agent:Baf A1 or NH4Cl)A.fucoidan+Baf A1;B.fucoxanthin+NH4Cl;C.fucoxanthin
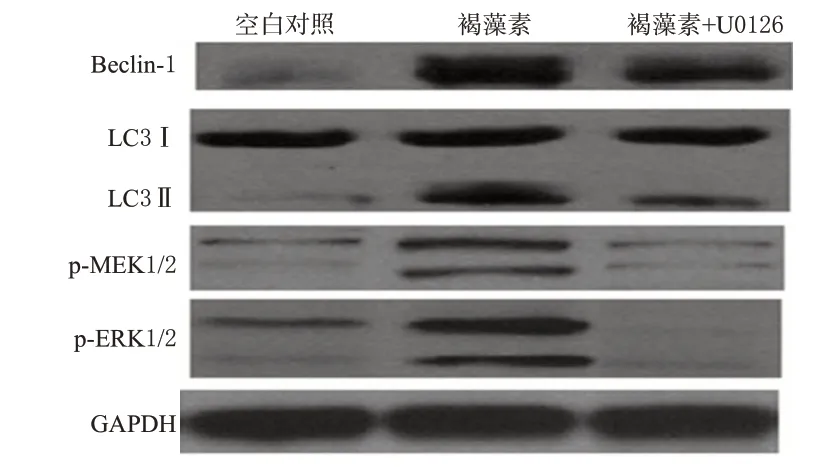
图3 细胞自噬相关蛋白测定结果(自噬剂:U0126)Fig 3 Determination results of autophagy related proteins(autophagy agent:U0126)
4 讨论
自噬在肿瘤化疗中的作用目前仍未完全阐明,肿瘤细胞通过发生自噬得以存活并对抗药物的治疗作用,抑制自噬可以促进细胞凋亡,而一些抗肿瘤药物通过诱导肿瘤细胞发生自噬从而产生治疗作用[8]。本研究表明,褐藻素的抗HeLa细胞增殖作用几乎完全被自噬抑制剂3-MA逆转,说明其抗增殖作用是通过自噬产生的。此外,褐藻素并不诱导HeLa细胞发生凋亡,这与以前的研究结果不同:褐藻素诱导人肝癌HepG2细胞同时发生自噬和凋亡,且自噬是抑制凋亡[5]。以上结果提示褐藻素可通过不同的机制产生抗肿瘤作用,具有肿瘤细胞特异性。
自噬的发生是一个动态的连续过程,待降解物质由双层膜包裹而形成自噬体,随后与溶酶体融合并形成自噬溶酶体,溶酶体内的酸性水解酶消化水解待降解物质并释放回细胞质中,从而实现物质的循环利用[9]。褐藻素引起HeLa细胞内吖啶橙的红色荧光和Lyso-Tracker Red的红色荧光增强,提示褐藻素诱导HeLa细胞发生了自噬。此外,Beclin-1表达增加、LC3Ⅰ转变为LC3Ⅱ和HeLa-GFP-LC3转染细胞试验均进一步证实褐藻素诱导HeLa细胞发生了自噬。
Akt/mTOR信号通路往往参与细胞自噬的发生[10]。研究结果表明,褐藻素能明显调控Akt/mTOR信号通路中一些关键蛋白,如Akt、mTOR、p70S6K的磷酸化以及上调PTEN(Akt/mTOR信号通路的负调控蛋白)的表达,提示褐藻素诱导HeLa细胞发生的自噬是通过抑制该信号通路中关键蛋白的活化产生的。由于3-MA并不完全抑制褐藻素对Akt/mTOR信号通路中关键蛋白的调控,提示可能有其他信号通路参与褐藻素诱导的细胞自噬。经过筛选发现,褐藻素通过使MEK1/2和ERK1/2磷酸化从而活化MEK/ERK信号通路,进一步研究表明MEK抑制剂U0126不仅可以抑制MEK/ERK信号通路的活化,而且可以部分逆转褐藻素诱导的Beclin-1表达增加及LC3 Ⅰ转变为LC3 Ⅱ,提示MEK/ERK信号通路也参与了褐藻素诱导的细胞自噬,即褐藻素通过抑制AKT/mTOR信号通路和激活MEK/ERK信号通路共同介导了HeLa细胞的自噬。此外,褐藻素是通过抑制p53、CDK2、Cyclin D1的表达以及促进p21的表达从而诱导HeLa细胞周期阻滞于G0/G1期。实验结果表明,褐藻素可诱导宫颈癌HeLa细胞发生自噬和细胞周期阻滞于G0/G1期,但并不诱导细胞凋亡。预孵自噬抑制剂3-MA后,褐藻素抗增殖作用被逆转,提示褐藻素抗HeLa细胞的作用取决于自噬,进一步研究表明褐藻素是通过抑制Akt信号通路以及激活MEK/ERK信号通路诱导HeLa细胞自噬。
本研究进一步完善了褐藻素抗肿瘤作用的分子机制,并为其应用于临床提供了理论基础和实验依据。
[1]Shigetomi H,Higashiura Y,Kajihara H,et al.Targeted molecular therapies for ovarian cancer:an update and future perspectives[J].Oncol Rep,2012,28(2):395.
[2]于春艳,刘希,于春荣,等.维生素K3诱导氧化应激经ERK信号途径介导HeLa细胞发生自噬[J].吉林大学学报,2014,40(2):229.
[3]许秋菊,侯莉莉,胡国强,等.麦冬皂苷B诱导人宫颈癌HeLa细胞自噬的机制[J].药学学报,2013,48(6):855.
[4]Ouyang L,Shi Z,Zhao S,et al.Programmed cell death pathways in cancer:a review of apoptosis,autophagy and programmed necrosis[J].Cell Prolif,2012,45(6):487.
[5]廖政邦,李明,谢松强.褐藻素诱导肝癌HepG2细胞凋亡和自噬的机制[J].中国实验方剂学杂志,2014,20(15):181.
[6]张艳霞,吴勇杰,李文广.蛇葡萄素钠协同卡铂对人肺腺癌GLC-82细胞增殖的抑制作用[J].中国药房,2015,26(4):488.
[7]童洋飞,郭奉洁,潘夕春,等.雷公藤甲素对大鼠心肌H9c2细胞肥大的抑制作用[J].中国药房,2015,26(7):878.
[8]Abrahamsen H,Stenmark H,Platta HW.Ubiquitination and phosphoryla tion of Beclin 1 and its binding partners:tuning class Ⅲphosphatidylinositol 3-kinase activity and tumor suppression[J].FEBS Lett,2012,586(11):1 584.
[9]Gordy C,He YW.The crosstalk between autophagy and apoptosis:where does this lead[J].Protein Cell,2012,3(1):17.
[10]Zou CY,Smith KD,Zhu QS,et al.Dual targeting of AKT and mammalian target of rapamycin:a potential therapeutic approach for malignant peripheral nerve sheath tumor[J].Mol Cancer Ther,2009,8(5):1 157.
