缺血预适应对局灶性脑缺血再灌注大鼠海马CA1区血管内皮生长因子及存活素表达的影响
2015-03-10张会玲张晋霞贺永贵李世英
张会玲 ,李 峥,张晋霞,贺永贵,余 红,李世英,刘 斌
血管内皮生长因子(vascular endothelial growth factor,VEGF)是作用最强、特异性最高的成血管因子,可以促进新生血管形成。存活素是新发现的作用最强的凋亡抑制蛋白。近年来,VEGF、存活素与脑缺血的关系日益受到关注。VEGF 通过上调存活素的表达发挥抗神经细胞凋亡的作用[1],存活素在VEGF 和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)的调控下表达增加,促进血管生成[2]。本实验观察脑缺血预适应后再灌注不同时间点海马CA1区VEGF、存活素的表达,探讨脑缺血预适应的脑保护作用机制。
1 材料与方法
1.1 实验动物及试剂 雄性8 周龄SD 大鼠130 只,体重200~250 g,购自北京华阜康生物科技股份有限公司。随机分为SO 组(n=10)、MCAO 组(n=60)和BIP 组(n=60),后两组按缺血后再灌注时间不同分为再灌注2 h、6 h、12 h、24 h、48 h 和72 h 6 个亚组。兔抗VEGF 多克隆抗体、兔抗存活素多克隆抗体(北京博奥森生物技术有限公司);免疫组织化学试剂盒(pv-6001)(北京中山金桥生物技术有限公司);β-actin 抗体(碧云天生物技术研究所);快速SDS-PAGE 凝胶制备试剂盒(北京庄盟国际生物基因科技有限公司)。
1.2 模型制备 (1)BIP 组:10% 水合氯醛(0.3 ml/100 g)腹腔注射麻醉大鼠,颈部正中行纵行切口,暴露右侧颈总动脉(CCA),分离颈内动脉(ICA)、颈外动脉(ECA)。经ECA-ICA 插入栓线,阻断大脑中动脉起始部。以分叉处为标记,栓线插入深度为(18.0 ±0.5)mm,感觉到阻力时停止插线。缺血10 min 后拔出栓线形成再灌注,完成缺血预适应。24 h 后拆除皮肤缝线,再次分离CCA、ICA,栓线经CCA-ICA 栓至大脑中动脉造成缺血2 h,拔出栓线形成第2 次再灌注,实现两次缺血再灌注。(2)MCAO 组:除第一次栓线插入深度小于10 mm 外,余步骤同BIP 组。(3)SO 组:两次栓线插入深度均小于10 mm。
1.3 免疫组化检测 取前囱前1 mm 至前囱后2 mm 之间的脑组织切块,4%多聚甲醛磷酸盐缓冲液固定,去离子水冲洗,梯度乙醇脱水,二甲苯透明、浸蜡,石蜡包埋,取厚度4 mm 冠状脑组织切片。应用免疫组化二步法检测VEGF、存活素阳性细胞的表达。首先在低倍镜下选择6 个视野,然后在高倍镜下计数阳性细胞,取其平均数作为该大鼠阳性细胞的表达数量。
1.4 Western blot 检测 成功麻醉大鼠,立即断头取脑,冰盘上快速剥离右侧海马区脑组织,-80 ℃冰箱中冻存。脑组织匀浆取上清,BCA 法行蛋白定量,上样量50 μg,经SDS-PAGE 凝胶电泳,湿转法转至硝酸纤维素膜,一抗工作液(1∶ 500)4 ℃孵育过夜,二抗工作液(1∶ 2000)室温孵育2 h,ECL 试剂显影。以β-actin 蛋白作为参照,按公式计算目的蛋白表达量=目的条带灰度值/β-actin 条带灰度值。
2 结果
2.1 各组VEGF、存活素阳性细胞表达VEGF、存活素阳性细胞呈棕黄色,主要表达于胞浆。SO 组有少量阳性细胞表达VEGF(5.27±0.45)、存活素(5.33±0.52),两者于缺血后再灌注2 h 表达即开始增多,24 h 表达至各时间高峰,随后表达逐渐减少,72 h 表达仍维持在较高水平。BIP 组各时间点VEGF、存活素阳性细胞表达均高于MCAO 组,差异有统计学意义(P <0.05)。两组组内各相邻时间点比较,差异有统计学意义(P <0.05)(见表1、表2)。
2.2 各组VEGF、存活素蛋白表达 SO 组VEGF、存活素蛋白表达少(0.31 ± 0.04,0.37 ±0.03)。两者均于再灌注2 h 表达增加,24 h 表达至各时间点峰值。BIP 组各时间点VEGF、存活素表达均高于MCAO 组,两组比较差异有统计学意义(P <0.05)。两组组内各相邻时间点比较,差异有统计学意义(P <0.05)(见表3、表4;见图1~图4)。
表1 各组海马CA1区VEGF 阳性细胞数比较()

表1 各组海马CA1区VEGF 阳性细胞数比较()
与MCAO 组比较△P <0.05;与同组上一时间点比较* P <0.05
表2 各组海马CA1区存活素阳性细胞数比较()
与MCAO 组比较△P <0.05;与同组上一时间点比较* P <0.05
表3 各组海马CA1区VEGF 蛋白表达比较()
与MCAO 组比较*△P <0.05;与同组上一时间点比较* P <0.05
表4 各组海马CA1区存活素蛋白表达比较()
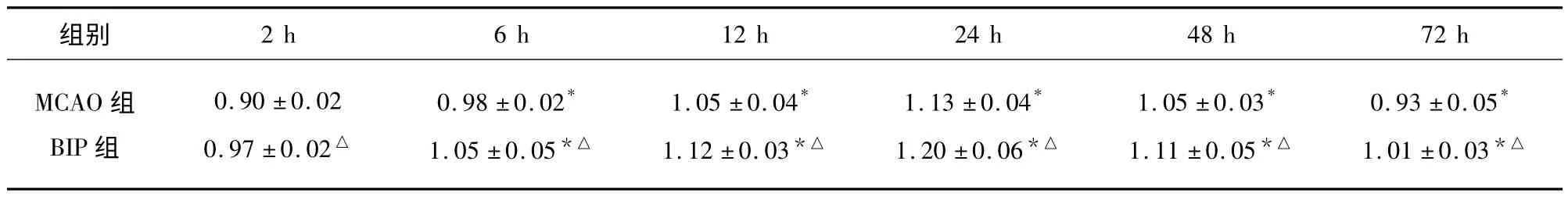
表4 各组海马CA1区存活素蛋白表达比较()
与MCAO 组比较△P <0.05;与同组上一时间点比较* P <0.05

图1 MCAO 组VEGF 蛋白表达

图2 BIP 组VEGF 蛋白表达

图3 MCAO 组存活素蛋白表达
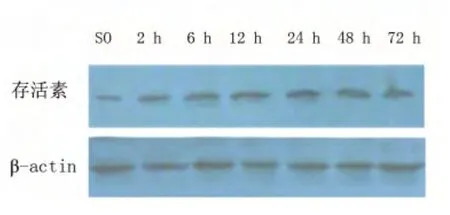
图4 BIP 组存活素蛋白表达
3 讨论
缺血性脑血管病主要是由于各种原因引起的脑部血液供应减少致微循环障碍,最终脑组织缺血缺氧发生坏死。因此,血管重建、改善微循环供血是缺血后的首要任务。VEGF 是促进血管内皮细胞有丝分裂的生长因子,不仅能够选择性作用于内皮细胞膜上的血管内皮生长因子受体,诱发血管内皮细胞增殖、迁移,而且能够增加内皮细胞的间隙引起血浆蛋白外渗,诱导间质产生[3],从而促进血管新生,改善局部血液循环,延缓组织坏死[4]。Lu 等[5]利用基因转移法发现VEGF 可以促进梗死周边区新生血管的表达,12 h 开始出现,72 h 达到高峰。除此之外,VEGF 还能够通过下调凋亡基因的表达发挥神经保护作用[6]。体外培养的细胞在无血清、低氧等环境中的存活率与VEGF 发挥抗凋亡作用密切相关[7]。丛丽等[8]通过脑缺血预适应诱导脑缺血耐受实验观察到,预适应组1 d、3 d、7 d 亚组脑梗死体积较非预适应组相应亚组明显减小,提示脑缺血预适应诱导产生脑缺血耐受。本研究显示,预缺血10 min 处理后,VEGF 表达较MCAO 组明显增加,推测可能与脑缺血预适应的脑保护机制有关。
存活素被认为是目前最强大的凋亡抑制蛋白,能够促进细胞增殖、有丝分裂,进而促进血管新生[9]。Conway 等[10]建立大鼠大脑中动脉闭塞模型发现,再灌注48 h 梗死灶周边区可见新生血管,血管内皮细胞中存活素显著表达,且存活素的表达量与微血管生成密度呈正相关,提示存活素参与了血管的生成。Zhang 等[11]建立低氧预适应的脑缺血耐受模型,发现预先给予低氧预适应的细胞存活素的表达明显高于对照组,且细胞生存率提高了50%,说明存活素参与脑缺血耐受的发生。另有研究证实,存活素可以调控癌细胞自我吞噬[12]。
目前关于VEGF、存活素两者关系的报道集中在肿瘤疾病的研究中,而在脑血管病方面少见报道。李秋玲等[13]建立永久性大鼠脑缺血模型,发现VEGF 和存活素在时空表达上具有协同性,表达高峰在2 w 左右,主要表达在大脑皮质和海马神经元、胶质细胞及血管内皮细胞。本研究结果显示,缺血后脑组织VEGF 和存活素的表达增加,且二者表达趋势一致。缺血侧海马CA1区VEGF 和存活素的表达随缺血再灌注时间延长呈现先升高后降低的趋势,再灌注24 h 表达至各时间点最高水平,提示VEGF和存活素在表达部位及表达时间上具有一致性。Marti 等[14]制备啮齿类动物的大脑中动脉闭塞模型观察缺血后脑组织血管新生,结果发现,VEGF 能上调存活素的表达,而且是调控存活素表达的重要因子,二者在血管新生过程中发挥重要作用。目前研究认为,VEGF 通过上调存活素表达实现抗凋亡作用,而存活素作为血管生成中的保护性基因,能够在VEGF、bFGF 的调控下表达增加,促进细胞增殖和血管生长。
本研究给予预缺血10 min 处理后,观察到VEGF 和存活素的表达被进一步上调,推测脑缺血预适应通过促进两者的表达发挥脑保护作用。
综上所述,脑缺血预适应能促进VEGF、存活素的表达上调,两者相互促进,协调发挥脑保护作用,这为研究脑缺血预适应的脑保护机制提供了新的思路。
[1]何 凡,韩晓书,曲 方,等.阿司匹林对大鼠脑缺血VEGF 和Survivin 表达的影响[J].中风与神经疾病杂志,2012,29(9):819-823.
[2]Wang P,Zhen H,Zhang J,et al.Survivin promotes glioma angiogenesisthrough vascular endothelial growth factor and basic fibroblast growth factor in vitro and in vivo[J].Mol Carcinog,2012,51(7):586 -595.
[3]Kajdaniuk D,Marek B,Foltyn W,et al.Vascular endothelial growth factor (VEGF)-part 1:in physiology and pathophysiology[J].Endokrynol Pol,2011,62(5):444 -455.
[4]Greenberg DA,Jin K.Vascular endothelial growth factors (VEGFs)and stroke[J].Cell Mol Life Sci,2013,70(10):1753 -1761.
[5]Lu RY,Luo DF,Xiao SH,et al.Kallikrein gene transfer induces angiogenesis and further improves regional cerebral blood flow in the early period after cerebral ischemia/reperfusion in rats[J].CNS Neurosci Ther,2012,18(5):395 -399.
[6]杨冀萍,刘怀军,刘瑞春,等.Caspase-3,-9,-12 及c-jun 在VEGF介导的神经保护作用中的调控机制[J].脑与神经疾病杂志,2009,17(2):114 -117.
[7]Cui W,Li W,Han RV,et al.PI3-K/Akt and ERK pathways activated by VEGF play opposite roles in MPP-induced neuronal apoptosis[J].Neurochem Int,2011,59(6):945 -953.
[8]丛 丽,王春霞,赵仁亮,等.缺血预处理对脑缺血耐受大鼠血管内皮生长因子和血管生成素-1 表达的影响[J].中国医药指南,2012,35:449 -451.
[9]李 娜,李世英,夏 静,等.亚低温对局灶性脑缺血再灌注大鼠脑皮质神经元凋亡及存活素、脑源性神经营养因子表达的影响[J].中风与神经疾病杂志,2012,29(3):239 -242.
[10]Conway EM,Zwerts F,Eygen VV,et al.Srvivin dependent angiogenesis in ischemic brain:molecular mechanisms of hypoxiainduced upregulation[J].Am J Pathol,2003,163(3):935 -946.
[11]Zhang Y,Park TS,Gidday JM,et al.Hypoxic preconditioning protects human brain endothelium from ischemic apoptosis by Akt-dependent survivin activation[J].Am J Physiology,2007,292(6):2573 -2581.
[12]王红霞,李世英.低氧诱导因子-1α、存活素与脑缺血耐受[J].临床神经病学杂志,2014,(3):237 -238.
[13]李秋玲,张博爱,朱红灿,等.脑缺血大鼠脑组织中存活素、血管内皮生长因子、微血管密度检测[J].郑州大学学报(医学版),2008,43(3):509 -512.
[14]Marti HJ,Bernaudin M,Bellail A,et al.Hypoxia-induced vascular endothelial growth factor expression precedes neovascularization after cerebral ischemia[J].Am J Pathol,2009,156(3):965 -976.
