4-氨基水杨酸麦芽糖苷盲结肠定位给药系统的体外评价Δ
2015-03-09吴国丽李飞飞刘锐玲曲婷丽赵正保山西医科大学药学院药化教研室太原03000山西职工医学院病生教研室太原03069
吴国丽,李飞飞,刘锐玲,曲婷丽,李 夏,赵正保#(.山西医科大学药学院药化教研室,太原 03000;.山西职工医学院病生教研室,太原 03069)
4-氨基水杨酸(4-aminosalicylic acid,4-ASA)在20世纪80年代作为抗结核药物运用于临床,后期又发现其可治疗溃疡性结肠炎(Ulcerative colitis,UC),且安全稳定、耐受性良好、廉价易得,疗效与传统抗UC 药物5-氨基水杨酸(5-aminosalicylic acid,5-ASA)相比更强[1],不会产生5-ASA引起的急性胰腺炎[2]。此外,糖类分子现在被广泛用于口服剂型的开发,用于将药物靶向释放到结肠部位发挥治疗作用[3]。糖类分子能够靶向释药的理论基础是:糖结合型药物对于大量存在于结肠中菌群产生的糖苷酶非常敏感,糖苷酶可以使前体药物的糖苷键断裂并释放母体药物[4]。
为了避免和减少4-ASA口服后在胃肠道上部吸收并代谢失活,提高其在结肠的药物浓度并减少用药剂量,本课题制备了4-ASA 麦芽糖苷(4-aminosalicylic acid-maltoside,4-ASAMal)酶依赖型结肠靶向口服前药。本文为了验证4-ASA-Mal的结肠靶向性,对其进行了体外释放度的研究。
1 材料
1.1 仪器
1200 型高效液相色谱(HPLC)仪(美国Agilent 公司);TU-1901 型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);TGL-16G 型高速离心机(上海飞鸽仪器公司);HH-2型电子恒温水浴锅(苏州威尔实验用品有限公司);AL104 型电子天平(梅特勒-托利多仪器有限公司);PHS-3C型pH 计(上海雷磁仪器厂)
1.2 药品与试剂
4-ASA-Mal(山西医科大学药化教研室自制,批号:20130501、20130502、20130503,纯度:≥98%);4-ASA 对照品(美国Sigma公司,批号:20130904,纯度:≥98%);甲醇为色谱纯;试验用水为去离子双蒸馏水;其余试剂均为分析纯。
1.3 动物
2 方法与结果
2.1 色谱条件
色谱柱:Innoval C18(250 mm×4.6 mm,4.6µm);流动相:甲醇-磷酸盐缓冲液(PBS,pH 2.7)(10∶90,V/V),流速:1.0 ml/min;检测波长:263 nm;柱温:30 ℃;进样量:20 μl。
2.2 内容物样品处理
取大鼠,实验前禁食不禁水12 h,用乙醚麻醉,剪开腹腔,分离胃、小肠、盲肠和结肠,剪开,收集各段内容物于具塞塑料离心管,按1 ∶4(m/V)分别加入0.1 mol/L HCl、pH 6.8 PBS、pH 7.4 PBS、pH 7.4 PBS,匀浆[5],-20 ℃冷冻备用(盲结肠内容物的处理及离心管和缓冲液预先用氮气处理好)。
2.3 方法专属性试验
分别精密吸取4-ASA 对照品溶液,正常大鼠胃、小肠、盲肠、结肠的空白内容物液和内容物样品液,进样测定,记录色谱。结果显示,4-ASA 的保留时间约为10 min,空白内容物不干扰其测定。色谱图见图1。
2.4 线性关系考察
分别精密量取“2.2”项下空白内容物液0.2 ml,置于1.5 ml离心管中,加入0.8 ml不同质量浓度的4-ASA 对照品溶液,制成含4-ASA终质量浓度为2.0、8.0、32.0、64.0、160.0、200.0µg/ml的样品溶液,混匀,涡旋,以3 000×g离心10 min,吸取上清液,用0.45 µm 滤膜过滤,取20 µl 进样测定,记录峰面积。以4-ASA 峰面积(A)对4-ASA 质量浓度(c)进行回归分析,得各段内容物的标准曲线方程和相关系数见表1。
结果表明,上述各段胃肠道内容物液中的4-ASA 质量浓度在2.0~200.0µg/ml范围内线性关系良好。
2.5 准确度和精密度试验
取大鼠不同部位空白胃肠道内容物液,按“2.4”项下方法制备高、中、低质量浓度(160、64、8µg/ml)的4-ASA质控样品,进样测定,记录峰面积,计算回收率。同日测定5次,考察计算日内精密度;每日测定1 次,连续测定5 d,考察日间精密度。结果,本法的回收率为(89.54±0.60)%~(97.02±0.20)%;日内RSD均小于4.58%,日间RSD均小于5.48%(n=5)。
2.6 稳定性试验
制备大鼠不同部位空白胃肠道内容物液中含4-ASA终质量浓度为64µg/ml的质控样品,在37 ℃、自然光条件下放置,分别于0、2、4、6、8、12 h依法测定,记录峰面积。结果显示,峰面积的RSD均小于2.17%,表明大鼠胃、小肠、盲肠、结肠内容物质控样品中4-ASA在12 h内稳定。
2.7 4-ASA-Mal体外靶向释药研究
2.7.1 不同pH 缓冲液 取7 只离心管加入0.1 mol/L HCl 0.2 ml、4-ASA-Mal 溶液0.8 ml(相当于4-ASA 250 µg/ml)[6],涡旋混匀。于37 ℃水浴孵育0.5、1、2、4、6、8、12 h 后,用混匀器振荡20 s,以3 000×g离心10 min,吸取上清液,用0.45µm滤膜过滤,取20µl 进样测定,计算4-ASA 的累积释放率。同法测定4-ASA-Mal 在pH 6.8 和pH 7.4 PBS 中4-ASA的累积释放率。4-ASA-Mal在不同pH缓冲液中的释放曲线见图2。
由图2 可知,4-ASA-Mal 在不同pH 缓冲液中孵育后几乎未检测到4-ASA。结果表明,4-ASA-Mal 在不同pH 条件下几乎不释放4-ASA。
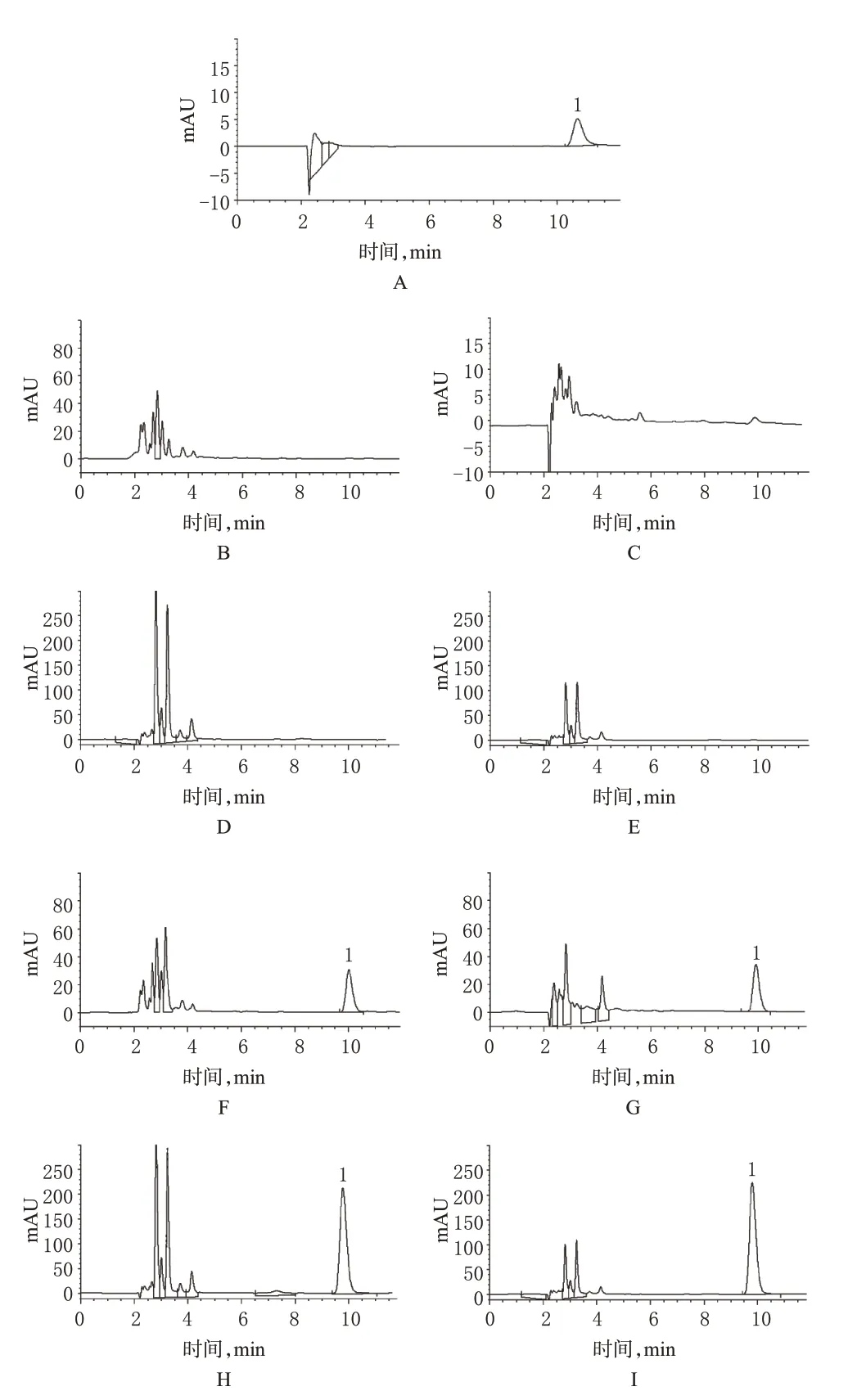
图1 高效液相色谱图A.4-ASA对照品;B.胃空白内容物;C.小肠空白内容物;D.盲肠空白内容物;E.结肠空白内容物;F.胃内容物样品;G.小肠内容物样品;H.盲肠内容物样品;I.结肠内容物样品;1.4-ASAFig 1 HPLC chromatogramA.4-ASA control;B.blank stomach content;C.blank small intestinal content;D.blank cecum content;E.blank colon content;F.sample of stomach content;G.sample of small intestinal content;H.sample of cecum content;I.sample of colon content;1.4-ASA

表1 回归方程及其相关系数Tab 1 Regression equations and the correlation coefficients
2.7.2 正常大鼠内容物液 分别取“2.2”项下胃、小肠、盲肠、结肠内容物液0.2 ml,置于塑料离心试管中,加入4-ASA-Mal药物溶液0.8 ml(相当于4-ASA 250 µg/ml),混匀。然后按“2.7.1”项下操作计算累积释放率。4-ASA-Mal 在正常大鼠不同内容物液中的释放曲线见图3。
由图3可知,4-ASA-Mal在正常大鼠胃和小肠内容物液中孵育12 h,4-ASA 累积释放率小于8%;在正常盲肠和结肠内容物液中孵育12 h,累积释放率分别约为55%和81%。

图2 4-ASA-Mal在不同pH缓冲液中的释放曲线(n=3)Fig 2 Release curves of 4-ASA-Mal in the buffer solutions of different pHs(n=3)
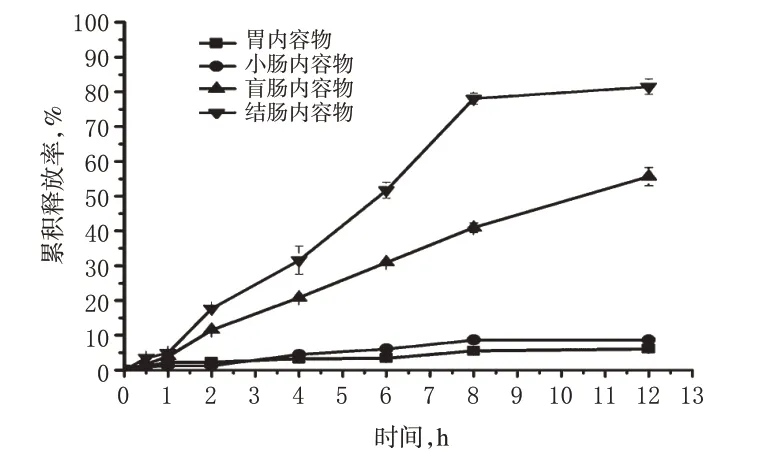
图3 4-ASA-Mal 在正常大鼠不同内容物液中的释放曲线(n=3)Fig 3 Release curves of 4-ASA-Mal in different aqueous contents in normal rats(n=3)
以上结果表明,4-ASA-Mal 在不同pH 条件下不释放4-ASA,只在特定酶的作用下释放4-ASA,从而在盲结肠形成高浓度药物浓度,达到靶向释药目的,发挥其抗溃疡性结肠炎的治疗作用。
2.7.3 溃疡性结肠炎模型大鼠胃肠道内容物液 取大鼠,实验前禁食不禁水12 h,用2,4,6-三硝基苯磺酸(TNBS)灌肠复制溃疡性结肠炎模型[7]。复制模型成功后第3天,用乙醚麻醉,从腹中线切开分别取出胃、小肠、盲肠、结肠的模型大鼠内容物,后续处理同“2.7.2”项,计算累积释放率。4-ASA-Mal 在模型大鼠不同内容物液中的释放曲线见图4。
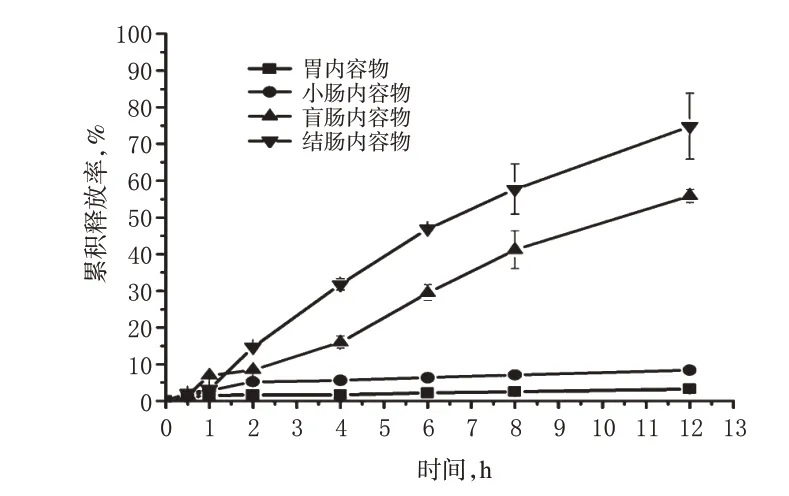
图4 4-ASA-Mal 在模型大鼠不同内容物液中的释放曲线(n=3)Fig 4 Release curves of 4-ASA-Mal in different aqueous contents in model rats(n=3)
由图4可知,4-ASA-Mal在模型大鼠胃和小肠内容物液中孵育12 h,4-ASA 累积释放率小于8%;在模型大鼠盲肠和结肠内容物液中孵育12 h,累积释放率分别为55%和74%。上述结果表明,4-ASA-Mal在模型大鼠胃肠道内容物液中的体外孵化中,可大量释放母药4-ASA。
3 讨论
对于结肠定位制剂的体外测定,《中国药典》的方法也不能完全模拟胃肠的环境(肠道pH、细菌数量、酶的活性、流体容量和内容物的混合强度);即使相关研究[8]同时考察了胃肠道的特异性酶系对药物释放的影响,也只单纯地加入了几种纯化酶,进行体内生理环境的简单模拟,不能充分反映药物在正常和溃疡性结肠炎体内的真实环境,其方法有一定的局限性。本实验综合考虑药物在正常大鼠和溃疡性结肠炎模型大鼠胃肠道转运过程中的各种生理环境和体内影响因素,在不同pH 缓冲液的基础上加入了正常或溃疡性结肠炎模型大鼠胃肠道相应部位的内容物,更真切地模拟了体内胃肠道的菌和酶的生存环境;同时充入氮气模拟了盲肠和结肠的无氧环境,能更真实地反映药物的结肠靶向释放程度。
在体外孵化产物中未能检测出有乙酰化4-ASA,说明在体外大鼠胃肠道内容物内缺乏乙酰化酶,不能生成乙酰化4-ASA。
4-ASA-Mal在0.1 mol/L HCl和pH 6.8、pH 7.4 PBS中几乎不释药,而在与人体盲结肠部位酶环境非常类似的大鼠盲结肠内容物中检测到大量4-ASA,初步证明基于糖苷键合成的4-ASA-Mal 并无pH 依赖性,其分解与内容物中酶的作用有关。后续将进一步对4-ASA-Mal进行大鼠体内代谢研究。
[1]靳宝芬.4-氨基水杨酸和5-氨基水杨酸抗炎作用及作用机制研究[D].太原:山西医科大学,2014.
[2]Dhaneshwar SS.Colon-specific prodrugs of 4-aminosalicylic acid for inflammatory bowel disease[J].World J Gastroenterol,2014,20(13):3 564.
[3]张建伟,刘力,徐德生.多糖作为载体在结肠靶向制剂中的研究和应用[J].山东医药,2013,53(22):82.
[4]Shah N,Shah T,Amin A.Polysaccharides:a targeting strategy for colonic drug delivery[J].Expert Opin Drug Deliv,2011,8(6):779.
[5]奚苗苗,张三奇,顾宜,等.RP-HPLC 法测定大鼠血浆及胃肠道内容物、黏膜中酮洛芬的浓度[J].中国药房,2010,21(1):35.
[6]Zou MJ,Okamoto H,Cheng G,et al.Synthesis and properties of polysaccharide prodrugs of 5-aminosalicylic acid as potential colon-specific delivery systems[J].Eur J Pharm Biopharm,2005,59(1):155.
[7]陈佳奇,陈村龙,王继德,等.2,4,6-三硝基苯磺酸诱导小鼠炎症性肠病模型的建立[J].中国组织工程研究与临床康复,2007,11(21):4 174.
[8]王少静,张学顺.结肠定位给药系统的体内外评价方法[J].中国新药杂志,2014,23(12):1 398.
