胰岛素注射液质量现状及相关标准研究
2015-03-09丁晓丽李湛军辛中帅梁成罡中国食品药品检定研究院北京100050
丁晓丽,李湛军,辛中帅,张 慧,梁成罡(中国食品药品检定研究院,北京 100050)
1921年,Banting和Best首次成功提取胰岛素,使糖尿病的治疗成为可能;1923年,胰岛素开始应用于临床[1]。从来源上,胰岛素制剂可分为动物胰岛素、人胰岛素和胰岛素类似物[2]。胰岛素注射液是从动物(猪、牛或羊)胰脏中提取的[3],属动物胰岛素,而由于动物胰岛素氨基酸序列与人胰岛素的差异[4]以及生产工艺本身的缺陷[5],其对人体来说是异种蛋白,长期使用会引起不同程度的免疫反应[6],易出现过敏反应和注射部位皮下脂肪萎缩等[7]。2013 年,艾美仕市场研究公司(IMS Health)市场调研数据显示,中国仍有10.2%的动物胰岛素使用量,其中中小城市占比高于大城市[8]。笔者曾委托国家药品不良反应监测中心对胰岛素制剂2009年的临床不良反应进行了检索。报告显示,当年胰岛素制剂临床不良反应病例共339例,其中动物胰岛素报告250 例,人胰岛素报告89 例,而动物胰岛素中胰岛素注射液报告213例,占总数的62.8%。这一数据说明,胰岛素注射液的不良反应发生率远高于其他胰岛素制剂,应引起重视。
胰岛素注射液的原料主要是猪胰岛素,该品种pH 呈酸性,因此又称酸性胰岛素注射液。该药于2009 年列入我国基本药物目录[9],属医保甲类药物。《中国药典》自2000年版开始已不再收载此品种,但截止2010年,市场上仍在广泛流通和使用,生产企业22家,批准文号27个。
本研究以市场抽验的32 批胰岛素注射液为对象,按照本品法定检验标准进行了全检,并参照同类产品的法定检验标准,对有关物质、含量、苯酚、高分子蛋白质及锌等关键质控项目进行了分析,以为了解胰岛素注射液的质量现状及提高相关检验标准提供参考。
1 材料
1.1 仪器
LC-20AD 型高效液相色谱(HPLC)仪,包括20AD 泵、SPD-20A紫外可见检测器、LC-Solution色谱工作站(日本岛津公司);AA6800 原子吸收分光光度计(日本岛津公司);XS205DU电子天平(瑞士Mettler-Toledo公司)。
1.2 对照品
猪胰岛素对照品(批号:140720-200901,规格:15 mg/支,纯度:90.85%)、胰岛素单体-二聚体对照品(批号:140634-201303,规格:约4 mg/瓶,用于系统适用性试验)均购自中国食品药品检定研究院;苯酚对照品(批号:141436340309273,纯度≥99.5%)购自美国Sigma 公司;锌单元素标准溶液(批号:GB08620,规格:1 000µg/ml)购自中国计量科学院。
1.3 药品与试剂
胰岛素注射液(规格:10 ml∶400 U,原料均为猪胰岛素)样品共32批,分别抽自18个省,涉及3个生产企业和3个批准文号;中性胰岛素注射液(规格:10 ml∶400 U,原料均为猪胰岛素),样品共8 批。乙腈为色谱纯,购于美国Fisher 公司;磷酸、无水硫酸钠、醋酸、精氨酸、乙醇胺、盐酸均为分析纯,购于国药集团化学试剂有限公司;水为Millipore 超纯水机制备的去离子水。
2 方法
2.1 法定检验标准
胰岛素注射液的法定检验标准为1995 年版《中国药典》(二部),具体项目见表1。

表1 胰岛素注射液法定检验标准Tab 1 Statutory specification of Insulin injection
2.2 关键质控项目
参照2010年版《中国药典》(二部)重组人胰岛素注射液及中性胰岛素注射液的法定检验标准[10],对胰岛素注射液分别进行有关物质、含量、苯酚、高分子蛋白质、锌等关键质控项目的考察。
2.2.1 有关物质 采用RP-HPLC 法进行测定。色谱柱为Grace Vydac C18(250 mm×4.6 mm,5 μm,300 Å);流动相A 为0.2 mol/L硫酸盐缓冲液(取无水硫酸钠28.4 g,加水溶解后,加磷酸2.7 ml、水800 ml,用乙醇胺调节pH 至2.3,加水至1 000 ml)-乙腈(82∶18,V/V),流动相B 为乙腈-水(50∶50,V/V),采用梯度洗脱(0~36 min,22%→22%B;36~61 min,22%→67%B;61~67 min,67%→67%B,调节流动相B的比例,使重组人胰岛素主峰的保留时间约为25 min);检测波长为214 nm;流速为1.0 ml/min;柱温为40 ℃;进样量为20 μl。以胰岛素注射液作为供试品溶液。采用面积归一化法,计算A21脱氨胰岛素及其他有关物质的含量。
2.2.2 含量测定 采用RP-HPLC 法进行测定。色谱柱为Grace Vydac C18(250 mm×4.6 mm,5 μm,300 Å);流动相为0.2 mol/L硫酸盐缓冲液(pH 2.3)-乙腈(74∶26或适宜比例,V/V);检测波长为214 nm;流速为1 ml/min;柱温为40 ℃;进样量为20 μl。精密称取猪胰岛素对照品适量,加0.01 mol/L盐酸溶液溶解并制成质量浓度约为0.35 mg/ml 的溶液,作为对照品溶液;精密量取胰岛素注射液2.5 ml,加0.01 mol/L 盐酸稀释至10 ml,作为供试品溶液。采用外标法,以胰岛素主峰峰面积与A21脱氨胰岛素峰面积之和计算含量。
2.2.3 高分子蛋白质 采用高效液相分子排阻色谱(HPSEC)法进行测定。色谱柱为Waters Insulin HMWP(300 mm×7.8 mm,10 μm,125 Ǻ);流动相为冰醋酸-乙腈-0.1%精氨酸溶液(15∶20∶65,V/V/V);检测波长为276 nm;流速为0.5 ml/min;进样量为100 μl。以胰岛素注射液作为供试品溶液。采用面积归一化法,计算高分子蛋白质的含量。
2.2.4 苯酚 采用RP-HPLC法进行测定。色谱条件同“2.2.2”项,但检测波长为270 nm。精密称取苯酚对照品适量,加0.01 mol/L盐酸溶液溶解并制成质量浓度约为0.25 mg/ml的溶液,作为对照品溶液;精密量取胰岛素注射液1 ml,加0.01 mol/L盐酸稀释至10 ml,作为供试品溶液。采用外标法,计算苯酚的含量。
2.2.5 锌 精密量取锌单元素标准溶液适量,用0.01 mol/L盐酸溶液分别稀释成锌质量浓度为0.20、0.40、0.60、0.80、1.00 μg/ml的系列标准溶液。精密量取胰岛素注射液1 ml,加0.01 mol/L 盐酸稀释至25 ml,作为供试品溶液。按照2010 年版《中国药典》(二部)附录ⅣD 第一法原子吸收分光光度法[10]测定,并计算锌的含量。
3 结果与讨论
3.1 法定检验
32 批样品检验结果均符合规定。其中,生物法测定胰岛素效价的结果分布在91%~116%,详见图1。
3.2 有关物质
胰岛素注射液的有关物质色谱见图2。结果表明,32批样品中杂质A21脱氨胰岛素含量分布在15.6%~39.2%,超出同类产品规定的5.0%的限度标准,详见图3。其他有关物质含量分布在0.4%~0.6%,低于同类产品规定的6.0%的限度标准。
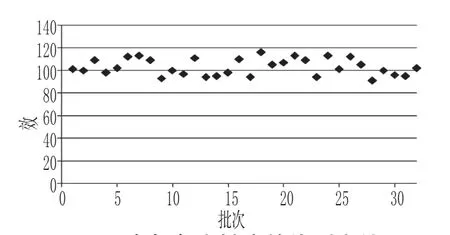
图1 胰岛素注射液效价测定结果Fig 1 Titer determination results of Insulin injection
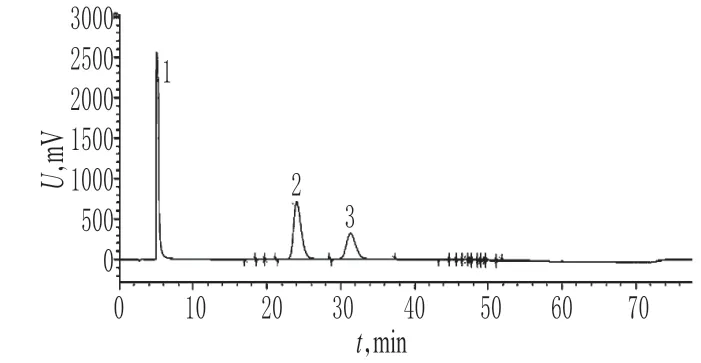
图2 胰岛素注射液有关物质色谱图1.防腐剂;2.胰岛素;3.A21脱氨胰岛素Fig 2 Chromatograms of related impurities in Insulin injection1.preservative;2.insulin;3.A21desamido insulin

图3 胰岛素注射液中A21脱氨胰岛素测定结果Fig 3 Determination results of A21desamido insulin in Insulin injections
A21脱氨胰岛素是胰岛素注射液常见的杂质,A21脱氨胰岛素含量过高会影响胰岛素的疗效及稳定性[11]。现行各国药典胰岛素原料及相关制剂品种项下,均对A21脱氨胰岛素及其他有关物质有严格的限度规定[12]:“A21脱氨胰岛素不得过5.0%,其他有关物质总和不得过6.0%。”本研究结果显示,胰岛素注射液中A21脱氨胰岛素含量普遍偏高。分析发现,这是由胰岛素注射液的生产工艺及处方导致的。胰岛素注射液是一个比较老的品种,由于早期纯化工艺的局限性,胰岛素注射液中含有一定量的蛋白水解酶,而酸性环境可以抑制蛋白水解酶对胰岛素的降解[13],因此胰岛素的处方是酸性的,pH 保持在2.5~3.5。但是胰岛素在酸性条件下不稳定,易引起A21位门冬酰胺的脱氨基反应,形成A21脱氨胰岛素,导致A21脱氨胰岛素含量较高,使胰岛素注射液的稳定性降低,货架期质量不可控。
目前,动物胰岛素的生产工艺经历了从粗提胰岛素、结晶胰岛素到高纯胰岛素的进步[8],随着胰岛素纯化工艺的提高,蛋白水解酶的含量已经大大降低,蛋白水解酶对胰岛素的降解已变成次要因素,胰岛素注射液的处方也无须再保持酸性环境,于是研制出了中性胰岛素注射液。本研究同时抽取了8批中性胰岛素注射液并对其进行有关物质检查,样品中A21脱氨胰岛素的含量均小于0.1%。与胰岛素注射液相比,中性胰岛素注射液的A21脱氨胰岛素含量较低,稳定性较好,详见图4。
3.3 含量测定
RP-HPLC 测定方法中,胰岛素的含量是以胰岛素主峰峰面积与A21脱氨胰岛素峰面积之和进行计算,因此含量过高的A21脱氨胰岛素没有对胰岛素注射液的含量测定结果产生影响,32批样品含量测定结果为93.2%~102.7%,符合同类产品规定的90.0%~110.0%限度标准,详见图5。
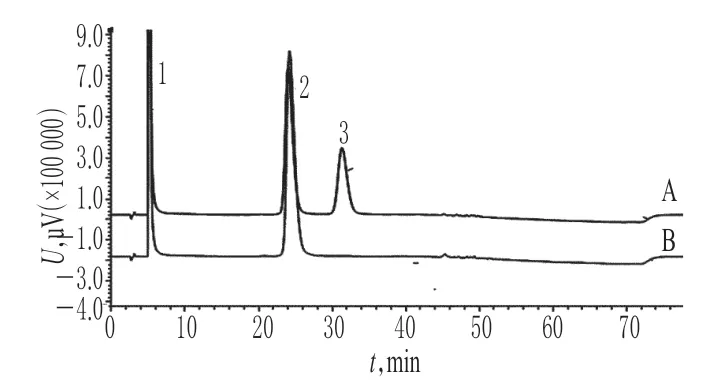
图4 胰岛素注射液与中性胰岛素注射液有关物质色谱图A.胰岛素注射液;B.中性胰岛素注射液;1.防腐剂;2.胰岛素;3.A21脱氨胰岛素Fig 4 Chromatograms of related impurities in Insulin injection and Neutral insulin injectionA.Insulin injection;B.Neutral insulin injection;1.preservative;2.insulin;3.A21desamido insulin
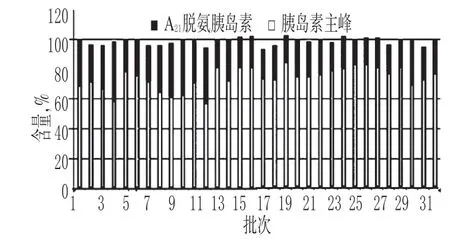
图5 胰岛素注射液含量测定结果Fig 5 Contents determination results of Insulin injection
然而,RP-HPLC法含量测定结果也显示,胰岛素主峰已降解为59.9%~83.8%,但由于A21脱氨胰岛素具有与胰岛素相似的生物活性,生物法测定胰岛素效价的结果仍为91%~116%。说明胰岛素注射液的法定标准中仅仅采用生物法测定胰岛素效价,胰岛素主峰大量降解的现象会被掩盖。目前,各国现行药典及我国进口注册标准对胰岛素原料及制剂均采用RP-HPLC 法进行含量测定,该方法能更加及时并准确地反映出胰岛素注射液的稳定性变化情况,适用于胰岛素注射液产品的放行标准及对其有关物质及主峰含量进行监控。
3.4 其他
胰岛素注射液中高分子蛋白质的测定结果分布在0.5%~0.6%,符合同类产品标准规定的不得过2.0%的限度,详见图6;苯酚测定结果在2.34~2.51 mg/ml,符合同类产品标准规定的2.00~2.75 mg/ml 的限度,详见图7;锌测定结果分布在12.3~14.8µg/100 U,符合同类产品标准规定的10~40µg/100 U的限度,详见图8。胰岛素分子具有复杂的自聚合特性[14],易形成二聚体及多聚体等高分子蛋白质,有可能引起过敏反应。胰岛素注射液是通过2个锌离子(Zn2+)把6个分子聚集在一起形成六聚体结晶体,Zn2+和苯酚能够显著增强六聚体的稳定性[15],因此,高分子蛋白质、苯酚及锌含量的控制与胰岛素的药效作用密切相关,应对其进行监控。本研究结果显示,各厂家产品在高分子蛋白质、苯酚及锌含量等方面整体上控制较好。
4 结论
4.1 质量标准
胰岛素注射液自2000 年版《中国药典》开始就不再收载,其法定检验标准一直执行1995年版《中国药典》。该法定检验标准缺少有关物质、含量测定、苯酚、高分子蛋白质、锌含量测定等多个关键质控项目,无法对产品质量实现有效控制。
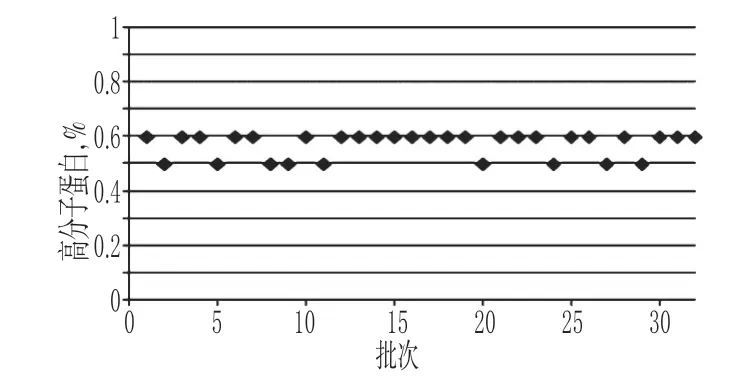
图6 胰岛素注射液中高分子蛋白质测定结果Fig 6 Determination results of protein polymer in Insulin injection
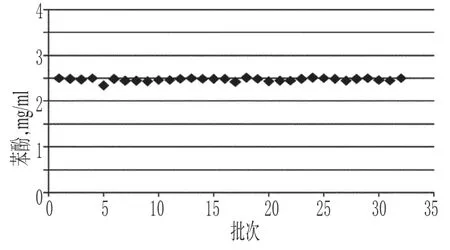
图7 胰岛素注射液中苯酚测定结果Fig 7 Determination results of phenol in Insulin injection
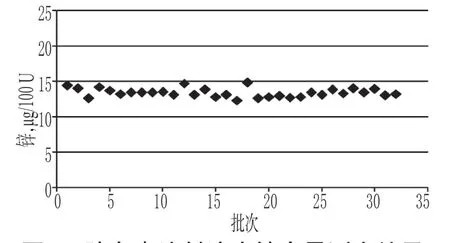
图8 胰岛素注射液中锌含量测定结果Fig 8 Content determination results of Zn in Insulin injection
4.2 产品质量现状
抽验的各批胰岛素注射液中,A21脱氨胰岛素含量普遍较高,尽管其具有与胰岛素相似的生物活性,但胰岛素的不断降解致使产品稳定性降低,货架期质量不可控,存在潜在的安全隐患,故不容轻视。
4.3 标准提高
本研究结果上报了国家食品药品监督管理总局,鉴于胰岛素注射液的质量标准及产品质量状况,总局发布实施了国家药品标准修订件(XGB2011-094),对1995 年版《中国药典》(二部)胰岛素注射液及2010年版《中国药典》(二部)中性胰岛素注射液两品种合并,执行标准均为2010年版《中国药典》(二部)中性胰岛素注射液质量标准,为公众用药的安全性及有效性提供了保障。
4.4 思考
在胰岛素制剂缺乏的年代,胰岛素注射液对于满足患者尤其是低收入群体患者的用药可及性起到了重要的历史作用。但目前,随着基因工程技术的发展,重组人胰岛素将逐步取代动物胰岛素,同时胰岛素制剂及胰岛素类似物也在不断开发与研制[18],各种胰岛素产品相继问世,为不同群体的糖尿病患者提供了更多的选择空间。2013年《中国2型糖尿病防治指南(基层版)》建议:在胰岛素种类的选择上推荐使用人胰岛素,尽量不用动物胰岛素[17]。但对于经济状况确实比较困难、医疗保障及医疗条件较差的群体,建议考虑使用稳定性相对较好且安全系数相对较高的动物胰岛素品种。
[1]Roth J,Qureshi S,Whitford I,et al.Insulin’s discovery:new insights on its ninetieth birthday[J].Diabetes Metab Res Rev,2012,28(4):293.
[2]田雅晨,陈在余,马爱霞.我国胰岛素市场状况浅析[J].北方药学,2013,10(5):110.
[3]饶建华,陈廷胜,禹腾波.糖尿病治疗药物-胰岛素研究进展[J].中国实用医药,2009,4(29):220.
[4]庞媛尹.人胰岛素和动物胰岛素治疗糖尿病的对比观察[J].广西医科大学学报,2000,17(4):676.
[5]Akram M,Naqvi SB,Khan A.Design and development of insulin emulgel formulation for transdermal drug delivery and its evaluation [J].Pak J Pharm Sci,2013,26(2):323.
[6]孔毅,乔德水.重组人胰岛素生产工艺监控方法研究进展[J].药物生物技术,2003,10(2):121.
[7]李媛红,贾树尔,马晓萍.胰岛素泵小剂量胰岛素脱敏治疗的效果分析[J].吉林医学,2015,36(3):417.
[8]母义明,赵家军,朱大龙,等.人胰岛素和动物胰岛素的临床使用专家意见[J].药品评价,2014,11(15):8.
[9]卫生部.国家基本药物目录[M].2012 年版.北京:中国法制出版社,2013:31.
[10]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:24、569、846、附录ⅣD.
[11]张莹.重组人胰岛素中的脱酰胺胰岛素的检验[J].天津药学,2001,13(5):14.
[12]Robbins DC,Andersen L,Bowsher R,et al.Report of the American diabetes association’s task force on standardization of the insulin assay[J].Diabetes,1996,45(2):242.
[13]乔德水,毛璞.胰岛素注射液的稳定性考察[J].中国生化药物杂志,1993(2):20.
[14]辛中帅,苑方圆,吕萍,等.地特胰岛素高分子蛋白质定性和定量分析[J].药物分析杂志,2014,34(6):1 033.
[15]李代禧,刘宝林,郭柏松,等.胰岛素聚合反应过程的分子模拟研究[J].生物医学工程学杂志,2013,30(5):934.
[16]李俊德,刘少华,唐蜜.临床研究中的胰岛素类药物进展[J].煤炭与化工,2014,12(37):28.
[17]中华医学会糖尿病学分会.中国2型糖尿病防治指南:基层版[J].中华全科医师杂志,2013,12(8):675.
