我院开展丹参多酚酸盐等中药注射剂上市后安全性再评价的实践Δ
2015-03-09吕世文郭佳奕朱亚兰浙江大学金华医院药剂科浙江金华321000
吕世文,郭佳奕,朱亚兰(浙江大学金华医院药剂科,浙江金华 321000)
当前,我国中药注射剂达1 000 余种[1],伴随用量增多,其药品不良反应/不良事件(ADR/ADE)迅速增加。据统计,2014年国家ADR 监测中心共收到中药注射剂ADR/ADE 报告12.7万例次,同比增长5.3%;其中严重报告占6.7%,同比增长26.0%[2]。近年来,因生产及质量控制等方面原因发生了多起中药注射剂质量安全事件,如鱼腥草、双黄连、刺五加事件[3-5]等,使得中药注射剂的安全性受到越来越广泛的关注。而中药注射剂的安全性监测与评价工作,一直作为我国上市后药品风险管理的重点工作之一,也是医药工作者所面临的重要课题之一[6]。为此,我院通过开展中药注射剂上市后安全性再评价工作,探索再评价的研究思路、方法与实施方案,考察其在临床使用中出现或可能出现的ADR/ADE,从而确保患者安全、合理用药。
1 资料与方法
1.1 研究思路
构建科学、合理、可行的安全性再评价方法,变ADR/ADE被动监测为主动监测,探索医疗机构开展药品上市后安全性再评价的方法。基于我院现状,研究遵循以下思路:(1)充分利用现有的医疗资源,设计科学且切实可行的中药注射剂安全性再评价方法;(2)利用医院信息系统(HIS),如门诊系统、住院患者电子病历系统、嵌入HIS的合理用药评价系统等,对上述方法进行补充与优化,使评价方法更便捷、客观、全面;(3)针对被研究的药品,重点观察其ADR/ADE发生率、主要临床表现、主要累及器官和发生ADR/ADE后的处理及主要影响因素等信息,以供临床参考。
1.2 评价方法
采用队列内病例-对照研究,观察中药注射剂在我院临床中使用的安全性,如ADR/ADE发生率、主要临床表现、主要影响因素等。
1.3 资料收集
将符合被研究药物说明书适应证且无使用禁忌证的患者作为研究队列,收集每个成员的基础资料(患者的基本人口学资料、食物药物过敏史、诊断疾病与原患疾病、原患疾病治疗详细过程及处理情况等)、相关暴露资料、协变量资料(被观察药物的用药时间、剂量、用药速度、配伍用药、给药途径、合并用药情况等)。
1.4 受试人群
1.4.1 病例组纳入标准 对研究队列进行随访,以确定在预定观察期内所有发生中药注射剂ADR/ADE的病例,将其作为研究的病例组。
1.4.2 对照组纳入标准 采用危险集抽样。在每个ADR/ADE 病例发病时,立即在队列中选择一定数量的到该病例发生ADR/ADE 时尚未发生ADR/ADE 的患者,按与病例组原患疾病相同(相似)、疾病严重程度相近、基本治疗措施相同(相似)、性别相同、年龄相近(±5岁)、入院时间相近(±7 d)等进行匹配。每个病例可选择1~10个匹配对照。
1.5 观察周期及指标
1.5.1 观察周期 观察覆盖整个用药时间,终末观察时间根据药物的半衰期确定,至少超过6.6 个半衰期,以确保药物在人体内已完全清除。从开始用药即第一滴药水进入人体开始就密切观察30 min,观察ADR/ADE 的发生情况;给药30 min后护士每6 h观察1次,并接受患者主动报告,患者出院后即停止主动观察;患者出院后及观察周期外,仍接受患者主动报告,但此时需注意ADR/ADE与药物的关联性,并加以记录。
1.5.2 观察指标 ①ADR/ADE 名称和累及器官、系统;②ADR/ADE 开始、结束时间;③ADR/ADE 级别;④ADR/ADE的临床表现、转归;⑤ADR/ADE的处理等。
1.6 评价工具及研究人员
以《中药注射剂临床安全性病例报告表》为评价工具,包括填表须知、患者基本信息、用药信息、ADR/ADE信息和关联性评价等部分。研究人员由主要研究者、临床观察员和评价人员组成。主要研究者由临床药学室人员承担,参与项目设计;临床观察员由各涉药科室护理人员组成,负责用药观察以及病例报告的填写;评价人员由药学人员组成,负责病例报告表的收集、整理、录入及统计分析等。
1.7 ADR/ADE判定与研究技术路线
ADR/ADE 判定根据《ADR 报告和监测管理办法》采用的标准[7],判断该例ADR/ADE 的关联性:(1)用药与ADR/ADE时间的出现有无合理的时间关系;(2)是否为已知的ADR 类型;(3)停药或减量后,ADR/ADE是否消失或减轻;(4)再次使用可疑药品后是否再次出现同样的ADR/ADE;(5)反应时间是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释。ADR/ADE 关联性判断见表1(注:表中“+”表示肯定;“-”表示否定;“±”表示难以肯定或否定;“?”表示不明);ADR/ADE 发生率根据其发生率判定标准判定,具体见表2;ADR/ADE研究技术路线见图1。

表1 ADR/ADE关联性判断Tab 1 Relevance judgments of ADR/ADE

表2 ADR/ADE发生率判定Tab 2 Judgment of the incidence of ADR/ADE
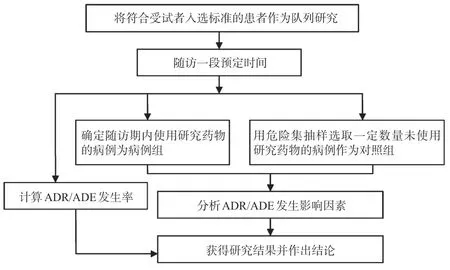
图1 ADR/ADE研究技术路线Fig 1 Technology roadmap of ADR/ADE research
1.8 统计学方法
采用SPSS 20.0软件协助分析,所有的统计检验均采用双侧检验,P<0.05为差异有统计学意义。对年龄等计量资料描述其均数、中位数、最小值、最大值;对分类指标如性别、药物过敏史、有无ADR/ADE 发生等描述其各类的例数及构成比;分别以ADR/ADE、合理用药为应变量,以性别、年龄、合并用药等因素为自变量,采用非条件Logistic回归分析或Poisson回归分析ADR/ADE发生的各影响因素及其标准回归系数。
2 结果
通过采用上述中药注射剂上市后安全性再评价方法,我院已完成多个中药注射剂的安全性再评价工作,促进了临床医师合理用药,并有效降低了其ADR/ADE的发生率。现以注射用丹参多酚酸盐为例进行说明。
2.1 患者的基本信息及用药情况
选取我院2012年5月至2013年10月1 000例使用注射用丹参多酚酸盐的冠心病心绞痛患者为研究队列,观察其ADR/ADE 的发生情况;病例组与对照组以1∶4 进行对照。患者的基本信息及用药情况见表3(注:“其他”表示超说明书用法用量使用)。
2.2 用药科室分布情况
用药科室分布情况见表4。
2.3 ADR/ADE的发生情况
研究队列共发生ADR/ADE者6例,按1∶4选取诊断为冠心病心绞痛、性别相同、入院时间相近(±7 d)、年龄相近(±5岁)使用注射用丹参多酚酸盐但未发生ADR/ADE 的患者进行。病例组与对照组的基本情况见表5;ADR/ADE的类型/累及系统及临床表现见表6(注:同一病例的ADR/ADE表现可能同时累及多个器官);ADR/ADE 的出现时间见表7(注:出现ADR/ADE 的时间从第一滴药水进入人体开始计时);停药后ADR/ADE的转归情况见表8。

表3 患者基本信息及用药情况Tab 3 Patient’s basic information and medications

表4 用药科室分布情况Tab 4 Distribution of drug use in departments
2.4 相关参数统计
经采用SPSS 20.0 软件分析,病例组中共发生ADR/ADE者6例,发生率为0.6%。按Poisson 分布估计注射用丹参多酚多酚酸盐ADR/ADE 发生率的95%置信区间(CI)为(0.22%,1.31%),均为偶见(0.1%~1%)。进行非条件Logistic回归分析,分别以ADR/ADE、合理用药为应变量,以性别、年龄、合并用药药物过敏史、家族过敏史等因素为自变量,最终得出危险因素分别为性别、年龄、合并用药。相关参数的估计值见表9。

表5 病例组与对照组基本情况Tab 5 General information of case group and control group

表6 ADR/ADE的类型/累及系统及临床表现Tab 6 Types and systems of ADR/ADE and clinical manifestations

表7 ADR/ADE的出现时间Tab 7 The onset time of ADR/ADE

表8 停药后ADR/ADE的转归情况Tab 8 The outcome of ADR/ADE after drug withdrawal
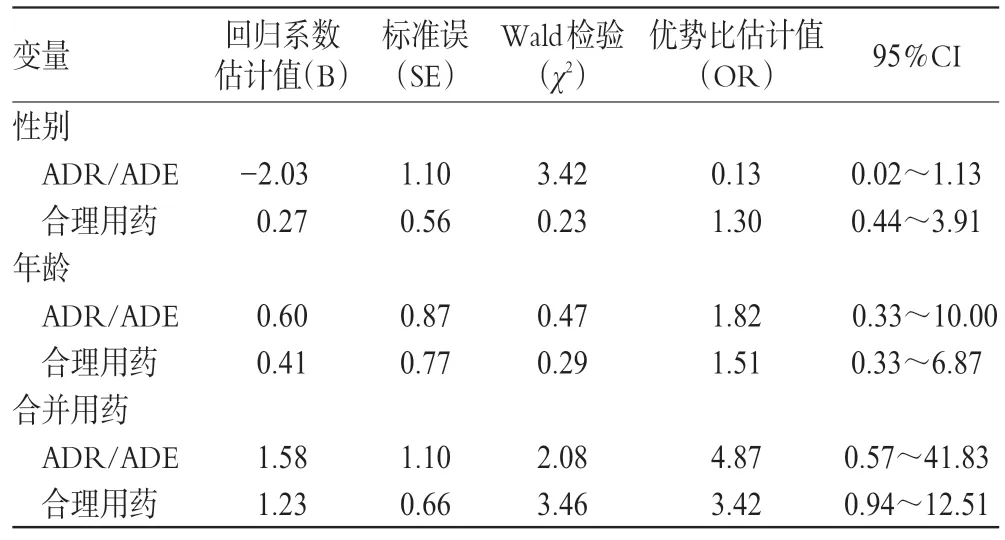
表9 非条件Logistic回归分析Tab 9 Non conditional Logistic regression analysis
2.5 存在的问题
通过对注射用丹参多酚酸盐的安全性再评价表明,我院在使用该药的过程中虽未见新的、严重的ADR/ADE,但临床在使用过程中仍存在不合理现象:(1)适应证不适宜。在选择病例组病例时,符合药品说明书适应证为纳入标准之一。药品说明书规定其主要适应证为冠心病和心绞痛,但在实际操作中发现我院有相当一部分患者因超适应证使用而被排除,如诊断为腔隙性脑梗死、大隐静脉曲张、脂肪肝、胆囊结石胆囊炎、心肌梗死、骨折、糖尿病、高脂血症、肝癌、斜疝等使用者,究其原因为中药西用。有报道称,某些综合性医院中药注射剂由西医处方使用的情况高达95%[8],很多西医师没有从中医的角度辨证使用注射用丹参多酚酸盐,而是简单地认为其具有活血祛瘀的功效而使用。(2)用法用量不适宜。表现为常见给药剂量和溶剂选用不适宜。如药品说明书规定给药剂量每日1 次,每次200 mg,溶剂剂量为250~500 ml,但使用时存在单次仅使用100 mg或选用溶剂剂量100 ml的情况。剂量不足或过大,可能导致疗效降低或ADR/ADE 明显增加;溶剂选用不当可能会导致配制药液不溶性微粒增加和pH、离子强度等的变化而发生变性,直接影响用药的安全性[9]。(3)存在禁忌使用情况。其均为与胰岛素注射剂2单位混合使用,用于抵消5%葡萄糖注射液250 ml中所含的12.5 g糖对血糖的影响。根据《中药注射剂临床使用基本原则》要求,中药注射剂应单用,禁忌与其他药物混合配伍使用[10]。
3 讨论
中药注射剂的ADR具有多发性和普遍性、临床表现多样、不可预知性及批间差异性等特点。如何在中医理论指导下紧密结合现代科学技术,进一步规范中药安全性评价方法,完善安全性评价标准及体系,并以立法的形式加大中药安全性评价规范执行的力度使其常态化值得探索。
根据《药物临床试验质量管理规范》的要求,新药Ⅵ期临床试验样本量应≥2 000 例,但某些迟发的、严重的ADR 和药物相互作用可能无法通过上述样本量显现,因此新药上市后还应对更广泛的人群、更复杂的用药条件、更长的用药时间、更多样的用药方案以及用药前后的各项指标进行考察,以弥补中药注射剂在药品上市前评价的不足[11]。医疗机构为临床用药一线单位,建立一套切实可行的中药注射剂安全性再评价方法,进而完善中药注射剂上市后再评价体系,不仅可为探索建立药品上市后再评价标准提供参考,而且可为临床合理用药提供依据,最终确保临床安全、有效、经济用药。
[1]张娜,李林森.藏红花药理作用研究进展[J].药物评价研究,2013,36(5):394.
[2]国家食品药品监督管理总局.国家药品不良反应监测年度报告:2014[S].2015-07-17.
[3]国家食品药品监督管理局.关于暂停使用和审批鱼腥草注射液等7个注射剂的通告[S].2006-06-01.
[4]国家食品药品监督管理局.卫生部办公厅、国家食品药品监督管理局办公室关于立即暂停使用和销售黑龙江乌苏里江制药有限公司佳木斯分公司生产的双黄连注射液的紧急通知[S].2009-02-12.
[5]国家食品药品监督管理局.关于开展刺五加注射液药品生产企业整顿工作的通知[S].2008-11-19.
[6]孙世光,石亚飞,王苏会,等.应用德尔菲法构建中药注射剂安全性评价指标体系[J].中国药房,2015,26(6):729.
[7]卫生部.药品不良反应报告和监测管理办法[S].2011-05-04.
[8]李忠华.中药注射剂在临床应用中的注意事项[J].基层医学论坛,2013,17(22):2 959.
[9]张奇兵,袁珺,赵寿宁.我院干预前后中药注射剂使用合理性分析[J].中国药房,2015,26(8):1 030.
[10]卫生部.中药注射剂临床使用基本原则[S].2008-12-24.
[11]国家食品药品监督管理局.药物临床试验质量管理规范[S].2003-08-06.
