扇贝糖胺聚糖对OX-LDL 诱导血管内皮细胞氧化应激损伤的抑制作用机制研究Δ
2015-03-09鞠传霞丛培阳王嘉怡孙福生青岛大学药学院山东青岛660威海卫人民医院山东威海6400
鞠传霞,侯 琳,丛培阳,王嘉怡,孙福生,王 蕾,张 芳,刘 赛(.青岛大学药学院,山东 青岛 660;.威海卫人民医院,山东 威海 6400)
目前公认血管内皮细胞的损伤及其功能异常是多种心血管事件发生的始动、关键性环节[1]。氧化应激是氧化低密度脂蛋白(OX-LDL)、肾素-血管紧张素系统、同型半胱氨酸等危险因素导致内皮细胞损伤的共同通路[2]。青岛大学医学院药理教研室从栉孔扇贝裙边中提取出有效成分——扇贝糖胺聚糖(Scallop skirt glycosaminoglycan,SS-GAG),已获得发明专利(ZL 200410035656.3)。前期研究发现50、100、200 mg/L SSGAG能对抗OX-LDL、多聚阳离子、Fenton体系和过氧化氢诱导的人脐静脉血管内皮细胞(HUVEC)氧化应激损伤[3-6],保护血管内皮细胞。本研究拟通过OX-LDL 复制HUVEC 损伤模型,从细胞和分子水平进一步研究其作用机制。
1 材料
1.1 仪器
FACS Calibur型流式细胞仪(美国BD公司);7600型全自动生化分析仪(日本Hitachi 公司);RG 3000 型实时荧光聚合酶链反应(RT-PCR)仪(德国Qiagen公司);2100 C型自动酶标仪(美国Rayto 公司);Trans-Blot SD 型半干电转膜仪(美国Bio-Rad公司)。
1.2 药品与试剂
SS-GAG(青岛大学医学院药理教研室,纯度:96%);RPMI 1640 培养基、胎牛血清(美国Hyclone 公司);MTT(美国Sigma 公司);乳酸脱氢酶(LDH)、活性氧(ROS)测试盒(上海碧云天生物科技有限公司);Trizol(上海Invitrogen公司);反转录试剂盒(美国Promega 公司);小鼠抗人NOX4 单克隆抗体、小鼠抗人β-actin单克隆抗体(美国Santa Cruz公司);辣根过氧化物酶标记山羊抗小鼠免疫球蛋白G(IgG,北京中杉金桥生物技术有限公司)。
1.3 细胞
HUVEC购自中国科学院细胞库。
2 方法
2.1 OX-LDL制备及鉴定
利用CuSO4修饰低密度脂蛋白制备OX-LDL,采用硫代巴比妥酸法鉴定[3]。
2.2 细胞培养与分组
HUVEC 接种于培养瓶内,用含10%胎牛血清、1×105u/L青/链霉素双抗的RPMI 1640 培养基,置于37 ℃、5%CO2条件下培养细胞。试验分为阴性对照(无血清培养基处理12 h)组、模型(50 mg/L OX-LDL处理24 h)组与SS-GAG高、中、低浓度(分别以质量浓度为200、100、50 mg/L的SS-GAG预处理12 h,后均用50 μmol/L OX-LDL处理24 h)组。
2.3 细胞活力测定[6]
取对数生长期细胞,调整细胞密度至1×108L-1,接种于96孔板中,每个浓度设6个复孔。按“2.2”项下方法处理细胞后,加入10 g/L MTT 10 μl培养4 h,每孔加入150 μl MTT溶解,用酶标仪于490 nm波长处测定光密度(OD)以代表细胞活力。
2.4 LDH活性测定
按“2.2”项下方法处理细胞后,收集上清培养液,取6 μl样品与200 μl LDH测试盒R1 试剂混匀,37 ℃孵育3 min;再加入100 μl R2 试剂,37 ℃孵育90 s,全自动生化分析仪连续监测2 min吸光度(A)变化,计算ΔA/min。LDH活性(U/L)=ΔA/min×F,式中F为常数(8 095)。
2.5 ROS水平测定
荧光定量法测定ROS 水平。2′,7′-二氯荧光二乙酸盐穿过细胞膜后,在胞内水解生成还原型二氯荧光素(DCFH)。细胞内ROS能氧化DCFH生成有荧光的氧化型二氯荧光素。将细胞与1 ml 二氯荧光黄二乙酸酯(DCFH-DA)置于37 ℃培养箱中,避光孵育20 min。按“2.2”项下方法处理细胞后,常规洗细胞2 遍,流式细胞仪检测ROS 水平(激发光波长488 nm,发射光波长525 nm)。
2.6 氧化低密度脂蛋白受体1(LOX-1)mRNA表达测定
RT-PCR 法测定LOX-1 mRNA 表达。按“2.2”项下方法处理细胞后,Trizol 试剂提取总RNA,反转录生成cDNA后,进行SYBR Green 荧光定量PCR。LOX-1 上游引物:5′-GAGAGTAGCAAATTGTTCAGCTCCTT-3′,下 游 引 物:5′-GCCCGAGGAAAATAGGTAACAGT-3′;GAPDH 上游引物:5′-TGGCCTCCAAGGAGTAAGAAAC-3′,下游引物:5′-GGCCTCTCTCTTGCTCTCAGTATC-3′。反应条件:95 ℃预变性1 min,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,共40 次循环。荧光值以ct值表示,LOX-1 mRNA的表达水平以LOX-1与GAPDHct的相对值表示,以2-ΔΔct法统计分析。
2.7 NOX4蛋白表达测定
Western blot测定NOX4蛋白表达。按“2.2”项下方法处理细胞后,收集细胞,加细胞裂解液冰浴20 min,12 000×g离心5 min,超声裂解,取上清,用Bradford法蛋白定量。十二烷基苯磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白,转膜和封闭,与小鼠抗人NOX4 单克隆抗体(1∶1 000)、小鼠抗人βactin单克隆抗体(1∶1 000)于4 ℃摇床过夜孵育,然后与辣根过氧化物酶标记山羊抗小鼠IgG(1∶5 000)室温孵育1 h。加入显色底物,显影后读片,并进行扫描分析。
2.8 统计学方法
采用SPSS 13.0 软件处理试验数据。各组数据均为计量资料,以表示,采用LSD 检验进行分析。P<0.05 为差异有统计学意义。
3 结果
3.1 各组细胞活力与LDH活性测定结果
与阴性对照组比较,模型组细胞活力降低,LDH 活性增强,差异有统计学意义(P<0.01);与模型组比较,SS-GAG高、中、低浓度组细胞活力增强,LDH 活性减弱,差异有统计学意义(P<0.01)。各组细胞活力与LDH活性测定结果见表1。
表1 各组细胞活力与LDH活性测定结果(,n=3)Tab 1 Determination results of the viability and LDH activity of cells in all groups(,n=3)

表1 各组细胞活力与LDH活性测定结果(,n=3)Tab 1 Determination results of the viability and LDH activity of cells in all groups(,n=3)
注:与阴性对照组比较,*P<0.01;与模型组比较,#P<0.01Note:vs.negative control group,*P<0.01;vs.model group,#P<0.01
3.2 各组细胞ROS水平测定结果
与阴性对照组比较,模型组细胞内ROS水平升高,差异有统计学意义(P<0.01);与模型组比较,SS-GAG高、中、低浓度组细胞ROS水平降低,差异有统计学意义(P<0.01)。各组细胞ROS水平测定结果见图1、表2。
3.3 各组细胞LOX-1 mRNA表达测定结果
与阴性对照组比较,模型组细胞LOX-1 mRNA表达增强,差异有统计学意义(P<0.01);与模型组比较,SS-GAG高、中、低浓度组细胞LOX-1 mRNA 表达减弱,差异有统计学意义(P<0.01)。各组细胞LOX-1 mRNA表达测定结果见表2。
3.4 各组细胞NOX4蛋白表达测定结果
与阴性对照组比较,模型组细胞NOX4蛋白表达增强,差异有统计学意义(P<0.01);与模型组比较,SS-GAG高、中、低浓度组细胞NOX4 蛋白表达减弱,差异有统计学意义(P<0.01)。各组细胞NOX4蛋白表达测定结果见图2。

图1 各组细胞ROS水平测定结果(,n=3)Fig 1 Determination results of the ROS level in cells in all groups(,n=3)
表2 各组细胞ROS 和LOX-1 mRNA 水平测定结果(,n=3)Tab 2 Determination results of the levels of ROS and LOX-1 mRNA in cells in all groups(,n=3)
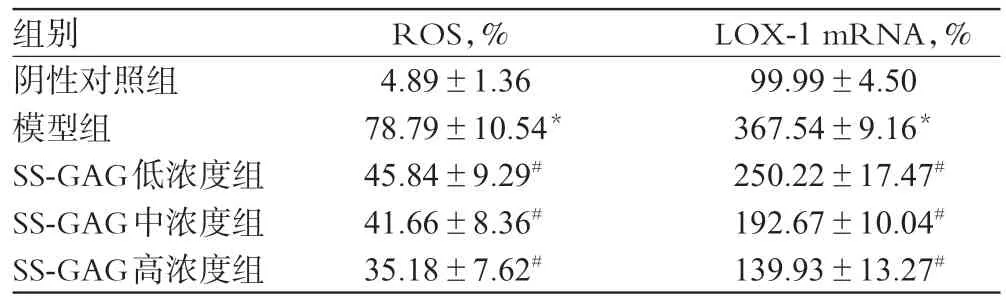
表2 各组细胞ROS 和LOX-1 mRNA 水平测定结果(,n=3)Tab 2 Determination results of the levels of ROS and LOX-1 mRNA in cells in all groups(,n=3)
注:与阴性对照组比较,*P<0.01;与模型组比较,#P<0.01Note:vs.negative control group,*P<0.01;vs.model group,#P<0.01
4 讨论
OX-LDL 诱导的血管内皮细胞的损伤及其功能异常是动脉粥样硬化发生的始动和关键性环节。氧化应激是OX-LDL导致内皮细胞损伤的主要通路[2]。氧化应激破坏细胞膜,增加膜通透性,释放胞内LDH,LDH释放量可反映膜的完整性。本研究结果表明,经OX-LDL 处理后,模型组细胞活力减弱,LDH 释放量增多;而SS-GAG 能促进细胞增殖,抑制LDH 释放,保护血管内皮细胞。
在正常情况下,体内ROS 的产生和清除处于动态平衡。一旦内源性氧化酶如NADPH氧化酶(NOX)[7]产生过多ROS,超过体内抗氧化体系的清除能力,体内氧自由基代谢就会失衡,发生氧化应激反应[8]。因此,清除ROS 是保护血管内皮细胞免受损伤的关键。本研究结果表明,OX-LDL能明显升高细胞内ROS 水平,不同质量浓度的SS-GAG 均可抑制ROS 的水平升高。

图2 各组细胞NOX4蛋白表达测定结果(,n=3)A.电泳图;B.柱形图注:与阴性对照组比较,*P<0.01;与模型组比较,#P<0.01Fig 2 Determination results of NOX4 protein expression in cells in all groups(,n=3)A.electrophoresis chart;B.columnNote:vs.negative control group,*P<0.01;vs.model group,#P<0.01
LOX-1 是血管内皮细胞摄取和代谢OX-LDL 的主要受体[9],在动脉硬化发生过程中起重要作用[10-11]。LOX-1 和OX-LDL 结合后通过NADPH 氧化酶途径,促进ROS 生成[12]。研究表明,NOX4是血管内皮细胞最主要的内源性ROS来源[13]。本研究结果表明,OX-LDL 处理后细胞LOX-1 mRNA 表达增强,NOX4 蛋白表达增强;SS-GAG 可抑制LOX-1 mRNA 和NOX4蛋白表达的增强。
综上所述,SS-GAG 可经LOX-1/NOX4 途径抑制ROS 产生,发挥保护OX-LDL 诱导的血管内皮细胞损伤的作用。本研究为海洋活性物质发挥保护血管内皮作用提供了直接的试验依据,为将SS-GAG研制开发成具有自主知识产权的具有血管保护活性的保健品或药品提供更多的理论和试验依据。
[1]Mudau M,Genis A,Lochner A,et al.Endothelial dysfunction:the early predictor of atherosclerosis[J].Cardiovasc J Afr,2012,23(4):222.
[2]Puca AA,Carrizzo A,Villa F,et al.Vascular ageing:the role of oxidative stress[J].Int J Biochem Cell Biol,2013,45(3):556.
[3]张俊玲,刘赛.扇贝裙边糖胺聚糖对OX-LDL导致的血管内皮细胞损伤的抑制作用[J].中国药理学通报,2004,20(12):1 389.
[4]高莹,刘赛,王海桃.扇贝裙边糖胺聚糖对过氧化氢损伤的内皮细胞释放血管活性物质的影响[J].中国药房,2008,19(7):496.
[5]张杰,刘赛,苏玉文,等.扇贝糖胺聚糖对受氧化损伤的内皮细胞功能的影响[J].中国药学杂志,2006,41(13):990.
[6]张杰,刘赛.扇贝糖胺聚糖对氧自由基损伤的血管内皮细胞的保护作用[J].中国海洋药物,2004,23(6):18.
[7]Dworakowski R,Alom-Ruiz SP,Shah AM.NADPH oxidase-derived reactive oxygen species in the regulation of endothelial phenotype[J].Pharmacol Rep,2008,60(1):21.
[8]Ray PD,Huang BW,Tsuji Y.Reactive oxygen species(ROS)homeostasis and redox regulation in cellular signaling[J].Cell Signal,2012,24(5):981.
[9]Morawietz H.LOX-1 receptor as a novel target in endothelial dysfunction and atherosclerosis[J].Dtsch Med Wochenschr,2010,135(7):308.
[10]Mehta JL,Chen J,Hermonat PL,et al.Lectin-like,oxidized low-density lipoprotein receptor-1(LOX-1):a critical player in the development of atherosclerosis and related disorders[J].Cardiovasc Res,2006,69(1):36.
[11]Mehta JL,Sanada N,Hu CP,et al.Deletion of LOX-1 reduces atherogenesis in LDLR knockout mice fed high cholesterol diet[J].Circ Res,2007,100(11):1 634.
[12]Chen XP,Xun KL,Wu Q,et al.Oxidized low density lipoprotein receptor-1 mediates oxidized low density lipoprotein-induced apoptosis in human umbilical vein endothelial cells:role of reactive oxygen species[J].Vascul Pharmacol,2007,47(1):1.
[13]Ago T,Kitazono T,Ooboshi H,et al.Nox4 as the major catalytic component of an endothelial NADPH oxidase[J].Circulation,2004,109(2):227.
