白芍醇提物及不同极性部位的体外抗氧化作用研究Δ
2015-03-09秦亚东汪荣斌周娟娟安徽中医药高等专科学校药学系安徽芜湖24002安徽中药资源研究所安徽芜湖247安徽芜湖市中医医院制剂中心安徽芜湖24000
秦亚东,汪荣斌,周娟娟,杨 茜(.安徽中医药高等专科学校药学系,安徽 芜湖 24002;2.安徽中药资源研究所,安徽芜湖 247;.安徽芜湖市中医医院制剂中心,安徽芜湖 24000)
白芍(Paeonia radix alba)为毛茛科植物芍药Paeonia lactifloraPall.的干燥根,具有养血调经、敛阴止汗、柔肝止痛、平抑肝阳之功效[1]。现代药理研究表明,白芍在免疫系统、消化系统、心血管系统均具有调节作用,并具镇静、解热、抗疲劳、抗肿瘤、抗氧化等功效[2-3]。
自由基在体内大量堆积后通过发生过氧化反应进而引发多种严重疾病[4]。随着对中药多糖抗氧化作用的研究,发现许多中药多糖具有清除自由基的作用。中药多糖来源广泛、毒性较低、安全性好,其抗氧化作用的发现,为体内发生过氧化反应而致的机体损伤等相关疾病的治疗提供了新的途径和方法。秦亚东等[5-6]对白芍多糖提取方式及含量进行了报道;徐晓燕等[7]比较了白芍各部位的还原能力及抗植物油脂氧化方面的作用;夏颖等[8]使用1,1-二苯基-2-三硝基苯肼自由基(DPPH·)清除法、Fe3+-三吡啶三吖嗪(FAAP)法考察了白芍粗提物的抗氧化活性。但白芍醇提物(CREt)及不同极性部位的体外抗氧化作用的系统研究尚未见报道,故笔者选用DPPH·、超氧阴离子自由基(O2-·)、羟基自由基(·OH)这3种常见的体外抗氧化活性试验模型,筛选白芍体外抗氧化活性有效部位,以期为白芍在抗氧化剂研发方面的研究奠定基础。
1 材料
1.1 仪器
MS104S 型万分之一电子天平[瑞士梅特勒-托利多仪器(中国)有限公司];Cary60 型紫外-可见分光光度计(美国Agilent公司);FD8-10型冷冻干燥机(美国Gold-Sim公司);3-18K型离心机(德国Sigma公司)。
1.2 药品与试剂
DPPH·(美国Sigma 公司,批号:1898-66-4,纯度:≥97.0%);抗坏血酸(VC,上海国药集团,批号:20120902,纯度:≥99.7%);水杨酸、邻苯三酚(天津市科密欧化学试剂开发中心,批号:20130905、20131107,纯度:≥99.5%、≥99.0%);三羟甲基氨基甲烷盐酸盐(Tris-HCl,上海研生生化试剂有限公司,批号:1183-55-1,纯度:≥99.5%);30%过氧化氢(南京奥佳化工有限公司);水为蒸馏水,其余试剂均为分析纯。
1.3 药材
白芍购自安徽亳州中药材市场(批号:201306),由安徽中药资源研究所刘晓龙研究员鉴定为毛茛科植物芍药Paeonia lactifloraPall.的干燥根。
2 方法
2.1 CREt及各部位浸膏的制备
取白芍干燥根500 g,粉碎后过80目筛,以15倍量95%乙醇浸泡1 d,收集滤液,重复2次,合并滤液后减压浓缩,低温真空干燥即得CREt浸膏,得率为6.20%[得率(%)=提取物干浸膏质量(g)/药材质量(g)×100%,下同]。另分别取白芍干燥根500 g,粉碎成粗粉后经50%乙醇回流提取2 次,合并滤液,分别以石油醚、乙酸乙酯、正丁醇萃取,萃取液经旋蒸后低温干燥,即得石油醚部位(CRP部位)浸膏,得率为0.73%;乙酸乙酯部位(CRE部位)浸膏,得率为1.27%;正丁醇部位(CRB部位)浸膏,得率为1.85%;水部位(CRW部位)浸膏,得率为2.86%。
2.2 DPPH·及VC溶液的制备
精密称取DPPH·5 mg、VC 10 mg 分别溶于10 ml 95%乙醇中,超声处理5 min,充分振摇,分别制备成质量浓度为0.5 mg/ml 的DPPH·贮备液和1.00 mg/ml 的VC 贮备液,根据试验情况再用95%乙醇将贮备液进行梯度稀释。
2.3 DPPH·清除能力的测定[9-10]
精密称量“2.1”项下制备的各部位浸膏12 mg,以95%乙醇为溶剂,分别制备成质量浓度为0.75、1.5、3、6、12 mg/ml 的样品溶液。分别取0.2 ml 样品溶液和2.8 ml 0.05 mg/ml 的DPPH·溶液于10 ml具塞试管中,摇匀,在避光条件下反应60 min 后,于517 nm 波长处测定吸光度(As);同时测定2.8 ml DPPH·溶液与0.2 ml 蒸馏水混合液的吸光度(A0),2.8 ml DPPH·溶液与0.2 ml 95%乙醇混合液的吸光度(A1)。清除率(%)=[1-(As-A1)/A0]×100%,并计算半数抑制浓度(IC50)。同时以VC(0.2 mg/ml)为阳性对照,每组试验平行测定3次。
2.4 O2-·清除能力的测定[10]
精密称量“2.1”项下制备的各浸膏6 mg,以95%乙醇为溶剂,分别制备成质量浓度为0.5、1、2、4、6 mg/ml 的样品溶液。取上述样品溶液1 ml,分别加入5 ml Tris-HCl 缓冲液(pH 7.8),摇匀,置于25 ℃水浴中反应20 min 后加入0.2 ml 1.25 mg/ml 的邻苯三酚溶液,反应5 min,加入1 ml 0.3 mg/ml HCl终止反应,分别于325 nm 波长处测定吸光度(As);以蒸馏水(未加样品溶液)为空白对照,测定溶液吸光度(A0)。清除率(%)=(A0-As)/A0×100%,并计算IC50。同时以VC(0.2 mg/ml)为阳性对照,每组试验平行测定3次。
2.5 ·OH清除能力的测定[10]
精密称量“2.1”项下制备的各浸膏6 mg,以95%乙醇为溶剂,制备成质量浓度分别为1.25、2.5、5、10、15 mg/ml 的样品溶液。取各部位浸膏上述样品溶液1 ml,分别加入1 ml 0.8 mg/ml 的硫酸亚铁铵溶液、1 ml 1 mg/ml 的水杨酸溶液、2 ml 0.5%的过氧化氢溶液,并以95%乙醇补足体积至10 ml,置37 ℃水浴中反应20 min 后,于510 nm 波长处测定溶液吸光度。未加样品溶液的反应体系吸光度为A0;因供试液具有颜色,故应扣除未加供试液的背景吸光度A;各样品溶液在反应体系中测定的吸光度为As。清除率(%)=[A0-(As-A)]/A0×100%,并计算IC50。同时以VC(0.2 mg/ml)为阳性对照,每组试验平行测定3次。
2.6 统计学方法
3 结果
3.1 CREt及不同极性部位对DPPH·的清除作用
在相同质量浓度下,CREt和CRE部位清除DPPH·的作用较强,12 mg/ml 时最大清除率分别可达(97.55±0.25)%、(82.54±0.36)%;CRP、CRB、CRW 部位对DPPH·的清除率相对较低,均未超过40%;各部位最大清除率均不及VC(0.2 mg/ml)组,差异均有统计学意义(P<0.01 或P<0.05)。CRP、CRB、CRW部位对3种自由基的清除作用不及CREt和CRE部位,差异均有统计学意义(P<0.01)。CREt 和CRE 部位对DPPH·的清除作用呈现一定的量效关系,IC50分别为1.629、2.481 mg/ml,结果见表1。
3.2 CREt及不同极性部位对O2-·的清除作用
相同质量浓度下,CREt和CRE部位对O2-·的清除作用较强,6 mg/ml 时最大清除率可达81.45%、77.74%;CRP 部位、CRB部位及CRW部位对DPPH·的清除率相对较低,均未超过45%;各部位最大清除率均不及VC(0.2 mg/ml)组,差异有统计学意义(P<0.01);CRP部位、CRB部位、CRW部位清除作用不及CREt 和CRE 部位,差异有统计学意义(P<0.01)。CREt和CRE部位对O2-·的清除作用呈现一定的量效关系,IC50分别为1.789、1.918 mg/ml,结果见表2。
表1 CREt 及不同极性部位对DPPH·的清除试验结果(,n=3,%)Tab 1 The elimination results of CREt and different polar parts to DPPH·(,n=3,%)

表1 CREt 及不同极性部位对DPPH·的清除试验结果(,n=3,%)Tab 1 The elimination results of CREt and different polar parts to DPPH·(,n=3,%)
注:与VC 比较,*P<0.05,**P<0.01;与CREt 比较,#P<0.01;与CRE部位比较,ΔP<0.01Note:vs.VC,*P<0.05,**P<0.01;vs.CREt,#P<0.01;vs.CRE part,ΔP<0.01
表2 CREt 及不同极性部位对O2-·的清除试验结果(,n=3,%)Tab 2 The elimination results of CREt and different polar parts to O2-·(,n=3,%)
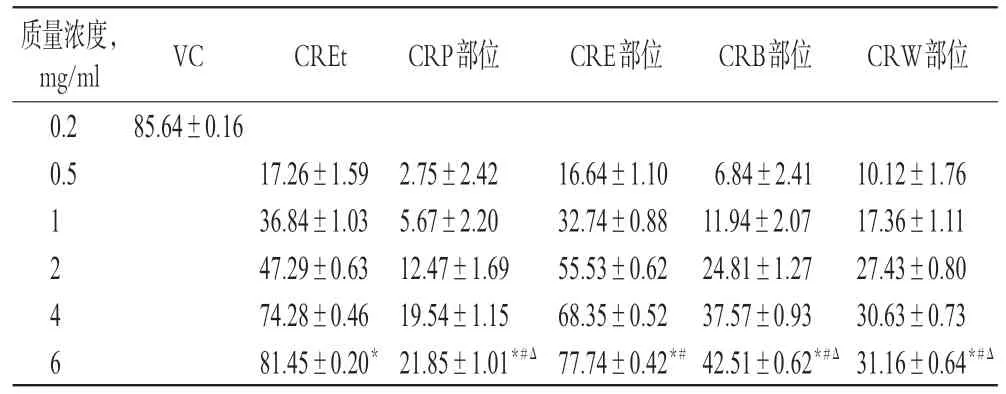
表2 CREt 及不同极性部位对O2-·的清除试验结果(,n=3,%)Tab 2 The elimination results of CREt and different polar parts to O2-·(,n=3,%)
注:与VC比较,*P<0.01;与CREt比较,#P<0.01;与CRE部位比较,ΔP<0.01Note:vs.VC,*P<0.01;vs.CREt,#P<0.01;vs.CRE part,ΔP<0.01
3.3 CREt及不同极性部位对·OH的清除作用
在相同质量浓度下,CREt、CRE 部位、CRB 部位清除·OH的作用较强,最大清除率可达75.28%、72.16%、62.53%;CRP部位、CRW部位对·OH的清除率相对较低,均未超过30%;各组最大清除作用均不及VC(0.2 mg/ml)组,差异有统计学意义(P<0.01)。CRP 部位、CRB 部位及CRW 部位清除作用不及CREt、CRE部位,差异有统计学意义(P<0.01)。CREt和CRE部位对·OH 的清除作用呈现一定的量效关系,CREt、CRE 及CRB部位IC50分别为5.268、6.005、7.232 mg/ml,结果见表3。
表3 CREt 及不同极性部位对·OH 的清除试验结果(,n=3,%)Tab 3 The elimination results of CREt and different polar parts to·OH(,n=3,%)

表3 CREt 及不同极性部位对·OH 的清除试验结果(,n=3,%)Tab 3 The elimination results of CREt and different polar parts to·OH(,n=3,%)
注:与VC比较,*P<0.01;与CREt比较,#P<0.01;与CRE部位比较,ΔP<0.01Note:vs.VC,*P<0.01;vs.CREt,#P<0.01;vs.CRE part,ΔP<0.01
3.4 阳性对照VC对3种自由基的清除作用
按照“2.3”“2.4”“2.5”项下方法分别测定不同质量浓度VC对DPPH·、·OH、O2-·的清除作用。结果显示,VC质量浓度在0.02~0.2 mg/ml之间时,对3种自由基的清除作用随着质量浓度的增加而增加,呈现浓度依赖性。其中当VC 质量浓度为0.1 mg/ml时,对DPPH·的清除率达92.31%;当VC质量浓度为0.08 mg/ml 时,对·OH、O2-·的清除率分别达到81.68%、82.05%。
4 讨论
为了提高试验结果的可比性,试验中应注意以下几点:第一,试验过程中应严格保持试验条件的一致性,包括试剂的配制应一次完成,测试不能分批进行等;第二,应排除样品溶液本身颜色带来的影响;第三,由于各组样品溶解性不同,在制备高浓度样品溶液时可采取超声、静置、滤过等方法促进各部位浸膏溶解。
试验表明,CREt、CRE 部位对3 种自由基清除率较强,最大清除率均超过70%,其余部位较弱。CREt 组质量浓度为6 mg/ml 时,与0.1 mg/ml VC 对DPPH·的清除作用大致相当;CREt、CRE 部位质量浓度为6 mg/ml 时,与0.08 mg/ml VC 对O2-·清除作用大致相当;CREt、CRE部位、CRB部位对·OH最大清除率均未达到0.08 mg/ml VC 对·OH 的清除率(81.68%)。各试验组的抗氧化作用均较VC弱,但各组间对3种自由基的清除作用又存在差异,且大致呈现浓度依赖。关于抗氧化作用不强的原因,可能是由于各试验组中的抗氧化成分纯度不高造成的。夏颖等[8]采用现代分离提取方法从白芍中提取出了单一化学成分五没食子酰基葡萄糖(PCG),对DPPH·的清除作用就大于VC。PCG 为小分子化合物(CREt中的一个化合物),极性较大,可溶于极性较大的乙醇中,而CREt 在本研究中抗氧化活性也较高,因此夏颖等的结论一定程度上在本试验中得到了验证。尽管文中选取的3种经典体外抗氧化模型具有很大的代表性[10-12],但仍不能代表白芍抗氧化的全部活性,且体外模型抗氧化作用不能真正代表体内抗氧化作用,体内、体外抗氧化作用之间的相关性也有待进一步研究。
使用不同极性溶剂提取中药,获得各部位提取物,然后通过所选指标进行药效活性部位的筛选和排除,是中药药效物质基础研究常用手段之一[11]。本研究初步排除了CRP、CRW部位,确定了CREt、CRE部位为抗氧化活性有效部位,在此基础上笔者将进一步对活性部位进行研究。
[1]国家药典委员会.中华人民共和国药典:一部[S].2010年版.北京:中国医药科技出版社,2010:96.
[2]张利.白芍的药理作用及现代研究进展[J].中医临床研究,2014,6(29):25.
[3]汪芸,陶移文,田庚元.白芍多糖的制备、理化性质及抗肿瘤活性研究[J].中国现代中药,2013,15(8):645.
[4]邓薏.近五年国内中药抗氧化作用研究进展:上[J].中药药理与临床,2012,28(6):155.
[5]秦亚东,李飞,周宙.不同提取方式对白芍化学成分含量的影响[J].现代中药研究与实践,2014,28(4):50.
[6]秦亚东,周娟娟,李飞,等.白芍生品及其炮制品中多糖及总糖的含量测定[J].长春中医药大学学报,2014,30(5):804.
[7]徐晓燕,吴兆喜.不同极性白芍提取物的抗氧化活性研究[J].食品与药品,2011,13(9):322.
[8]夏颖,殷志爽,石晨,等.白芍提取物及其有效成分抗氧化活性的研究[J].首都医科大学学报,2013,34(1):120.
[9]Mensor LL,Menezes FS,Leitao GG,et al.Screening of Brazilian plant extracts for antioxidant activity by the use of DPPH free radical method[J].Phytother Res,2001,15(2):127.
[10]刘志东,郭本恒,王荫榆.抗氧化活性检测方法的研究进展[J].天然产物研究与开发,2008,20(3):563.
[11]于海平,孔祥密,施余杰,等.荆条花不同提取物抗氧化活性的比较研究[J].中国药房,2013,24(39):3 672.
[12]曹玉娜,宋志前,魏征,等.抗氧化剂的抗氧化活性测定方法研究进展[J].中国药房,2013,24(1):86.
