LAPTM4β在人结直肠癌耐药细胞株中的表达及意义
2015-03-09黄跃南宁丽李云龙游柳平王春敬刘家麒
黄跃南 宁丽 李云龙 游柳平 王春敬 刘家麒
LAPTM4β在人结直肠癌耐药细胞株中的表达及意义
黄跃南宁丽李云龙游柳平王春敬刘家麒
【摘要】目的建立耐奥沙利铂(L-OHP)的人结直肠癌耐药细胞株(HT-29/L-OHP),检测相关耐药基因LAPTM4β的表达,探讨其在L-OHP耐药中的作用机制。方法采用药物浓度梯度递增间歇诱导法建立人结直肠癌耐药株HT-29/L-OHP;应用LAPTM4β-35蛋白抑制剂作用于HT-29/L-OHP细胞株后,流式细胞技术检测细胞凋亡,比较其与HT-29/L-OHP细胞株对于L-OHP的耐药情况;应用RT-PCR检测LAPTM4β mRNA的表达;应用Western blot测定LAPTM4β-35蛋白的表达。结果成功建立人结直肠癌耐药细胞株HT-29/L-OHP,流式细胞技术检测结果表明应用LAPTM4β-35蛋白抑制剂作用于HT-29/L-OHP细胞株后,其对于L-OHP的耐药明显低于HT-29/L-OHP细胞株。HT-29/L-OHP细胞株中LAPTM4β mRNA表达水平明显高于亲本细胞株HT-29,分别为5.613±0.139和1.105±0.187,(P<0.05),LAPTM4β-35蛋白在HT-29/L-OHP细胞和HT-29细胞的相对表达量2.203±0.080和1.033±0.070,(P<0.05)。结论LAPTM4β在结直肠癌耐药细胞株中过表达,与结直肠癌奥沙利铂耐药密切相关,可以作为结直肠癌耐药的一个敏感的生物学标志物。
【关键词】结直肠肿瘤;抗药性,肿瘤;奥沙利铂;LAPTM4β
Expression and significance of LAPTM4β in L-OHP resistant human colorectal cancer cell line
HUANGYue-nan*,NINGLi,LIYun-long,
YOULiu-ping,WANGChun-jing,LIUJia-qi*.Departmentofgeneralsugery,theSecondAffiliatedHospitalofMedicalUniversity,Harbin150086,China
Correspondingauthor:LIUJia-qi,Email:hljljq@qq.com
【Abstract】ObjectiveTo establish L-OHP resistant human colorectal cancer cell line(HT-29/L-OHP),and detect the expression of related drug resistant gene LAPTM4β,and probe its role in the mechanism of L-OHP resistant.MethodDrug concentration gradient increasing intermittent induction method was used to establish L-OHP resistant human colorectal cancer cell line(HT-29/L-OHP);LAPTM4β-35 protein inhibitor was used in HT-29/L-OHP cell line,flow cytometry was adopted to detect cell apoptosis,and to compare L-OHP resistant of it with other HT-29/L-OHP cell line;RT-PCR was adopted to detect the expression of LAPTM4βmRNA;Western blot was used to detect the expression of LAPTM4β-35 protein.ResultL-OHP resistant human colorectal cancer cell line(HT-29/L-OHP)was established successfully.The flow cytometry result showed that LAPTM4β-35 protein inhibitor use in HT-29/L-OHP cell line lead to significantly lower L-OHP resistance than that of HT-29/L-OHP cell line.The expression of LAPTM4βmRNA of HT-29/L-OHP was significantly higher than parental cell plant HT-29,5.613+0.139 and 1.105+0.187,respectively(P<0.05).The relative expression level of LAPTM4-35 in HT-29/L-OHP cell line and HT-29 cell line was 2.203+0.080 and 1.033+0.070,(P<0.05).ConclusionLAPTM4β is overexpressed in HT-29/L-OHP cell line,and it is closely related with L-OHP resistant of colorectal cancer,it could be used as a sensitive biomarker for drug resistance of colorectal cancer.
【Key words】Colorectal neoplasms;Drug resistance,neoplasm;Oxaliplatin;LAPTM4β
作者单位:150081哈尔滨医科大学附属第二医院普外科(刘家麒、游柳平、王春敬、黄跃南),妇产科(宁丽),重症监护病房(李云龙)
结直肠癌(colorectal carcinoma,CRC)包括结肠癌和直肠癌,是消化道的恶性肿瘤之一,在肿瘤相关致死疾病中位列第3名[1]。目前对转移性结直肠癌患者的治疗仍然是以化疗为主的综合治疗[2],以奥沙利铂为主的FOLFOX方案是结直肠肿瘤化学性治疗的主要方案,近期效果确切,但最终会产生耐药导致肿瘤的复发和转移,是导致肿瘤病人死亡的主要原因。溶酶体相关4次跨膜蛋白(lysosome-associated protein transmembrane-4 beta,LAPTM4β)是一个新发现的与癌症相关的基因,其mRNA和编码后蛋白质LAPTM4β-35的表达在各种癌症中明显升高[3]。在肿瘤组织中的LAPTM4β-35的表达水平是CRC患者一个独立的预后因素,其上调促进细胞增殖、迁移和侵袭[4]。本研究建立体外CRC奥沙利铂耐药细胞株,检测LAPTM4β基因和LAPTM4β-35的表达,为研究奥沙利铂耐药机制和寻找敏感的生物标志物提供基础。
材料和方法
一、材料
人结直肠癌细胞株HT-29(中国科学院上海生命科学研究所),RPMI1640培养基(Gibco BRLtrogen公司),RT试剂盒(TakaRa公司),兔抗人LAPTM4β-35多克隆抗体(美国Abcam公司),鼠抗人β-actin单克隆抗体、Western细胞裂解液、Western blot一抗稀释液、Western blot二抗稀释液(上海碧云天公司),Annexin V-FITC 细胞凋亡试剂盒(南京凯基公司)。奥沙利铂(江苏恒瑞医药股份有限公司)。PCR引物(上海生工生物工程有限公司),RNA提取试剂Trizol提取液(Invitrogen公司)。
二、方法
1.亲本细胞培养和耐药细胞株建立:HT-29亲本细胞株在含有10%胎牛血清、100 U/ml青霉素、100 μg·ml-1链霉素的RPMI1640培养基中培养。取对数生长期HT-29细胞,调整细胞数为1×105/ml,取10 ml细胞悬液接种至培养瓶中。为建立稳定的耐药细胞株,培养液中间歇加入奥沙利铂溶液,初始浓度为4 μmol/L,并且逐渐提高浓度。48 h后换液去除药物,3 d换液一次,待存活细胞开始增殖、细胞融合度达80%左右时开始传代,逐步提高L-OHP浓度间歇诱导,反复换液、传代,连续培养12个月,获得能在L-OHP浓度为15 μmol/L的培养液稳定生长的耐药细胞株,命名为HT-29/L-OHP,传5代后用于后续实验研究,并将其维持培养在含4 μmol/L L-OHP的完全培养液中。
2.流式细胞术检测细胞凋亡:按照传代的方法收集HT-29/L-OHP细胞,接种于6孔板,每孔1×106个,培养24 h后用冷的PBS重悬,使用PBS洗涤2次,离心300 g,5 min;使用1×buffer配成1×106/ml悬液;取100 μl加入5 ml的流式管;按体积加入 5μl Annexin V和5 μl PI;轻轻混匀,室温避光孵育15 min;各试管中加入400 μl的1×buffer;1h内上机检测。设立流式检测对照管,阴性对照:双阴染色;补偿1:只染Annexin V;补偿2:只染PI;(6孔板,每孔一个样品)。
3.Real-TimePCR检测LAPTM4β mRNA表达:用Trizol提取试剂提取各组细胞的总RNA,并使用RT试剂盒(TakaRa公司)将其逆转录成cDNA,SYBR Green染料法进行实时定量PCR反应,采用20 μL体系扩增,反应条件为:95℃预变性3 min,然后为95℃10 s、60℃30 s共40个循环,最后70℃依次递增0.5℃至90℃,每次5 s,进行熔解曲线检测。每次检测设立3个复孔,重复3次以上。采用2-ΔΔCt方法计算目的基因表达的相对水平,使用β-actin做为内参。LAPTM4β上游引物5'-GGAAGCAGGACAGCCAACTT-3',下游引物5'-TTATTCTCGATCTCACAACCAAAC-3';β-actin上游引物5'-CCTGTGGCATCCACGAAACT-3',下游引物5'-GAAGCATTTGCGGTGGACGAT-3'。
4.Western blot法检测LAPTM4β-35蛋白的表达:收集各组对数生长期细胞,提取总蛋白,BCA法测定蛋白浓度,-80℃保存。按每孔50 μg的等蛋白含量上样,SDS-聚丙烯酰胺凝胶电泳分离,恒流湿转至PVDF膜上。5%脱脂奶粉室温封闭1 h,TBST洗膜3次,每次10 min。加入按适当比例稀释的一抗,4℃过夜。TBST洗膜3次,每次10 min,加入相应二抗孵育1 h,再用TBST洗膜3次,每次10 min。ECL发光试剂盒暗室显色,X光胶片压片后进行显影、定影。对曝出的条带进行扫描保存,用ImageJ分析软件对条带进行灰度分析。
三、统计学处理
结果
一、耐药细胞及亲本细胞的形态比较结果

注:a图为HT-29细胞镜下形态图像;b图为HT-29/L-OHP细胞镜下形态图像图1 耐药细胞及亲本细胞镜下形态图像(×50)

注:a图为HT-29细胞株流式细胞图;b图为L-OHPHT-29细胞株流式细胞图图2 AnnexinV-FITC/PI 双染色法检测细胞凋亡流式图
耐药细胞及亲本细胞的形态比较取对数生长周期细胞在倒置荧光显微镜下照相。如图1可见,HT-29细胞间距很小,呈聚集成团生长,细胞形态不规则的三角形,而HT-29/L-OHP细胞间距明显增大,呈散在生长,三角形细胞减少,多边形和长条形细胞增多。
二、流式细胞技术检测耐药细胞凋亡情况
应用LAPTM4β-35蛋白抑制剂作用于HT-29/L-OHP细胞株后,流式细胞技术检测细胞凋亡,比较其与HT-29/L-OHP细胞株对于L-OHP的耐药情况,AnnexinV-FITC/PI双荧光染色法检测结果见图2,细胞总凋亡率为Q4_UR与Q4_LR之和,结果显示HT-29/L-OHP组的细胞凋亡率(11.7%)低于HT-29/L-OHP细胞株的细胞凋亡率(17.7%),说明应用LAPTM4β-35蛋白抑制剂作用于HT-29/L-OHP细胞株后,再应用奥沙利铂作用后细胞凋亡率明显升高,L-OHP的耐药性明显下降。
三、RT-PCR测定LAPTM4β基因mRNA表达
Real time PCR技术检测47例HT-29/L-OHP细胞及31例HT-29细胞的LAPTM4β mRNA的表达,LAPTM4β mRNA在HT-29/L-OHP细胞、HT-29细胞的相对表达量(RQ值)见表1,LAPTM4β mRNA在HT-29/L-OHP细胞中的表达明显高于HT-29细胞(图3),差异具有统计学意义(P<0.05)。
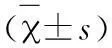
表1 LAPTM4β mRNA表达水平在两组的比较表

图3 Real time PCR检测HT-29/L-OHP细胞和HT-29细胞中LAPTM4β水平柱形图
四、Western blot法检测LAPTM4β的表达
Western blot检测结果显示,HT-29细胞LAPTM4β的相对表达量(1.033±0.070)而在HT-29/L-OHP细胞中表达明显增高(2.203±0.080),二者表达的差异具有统计学意义(P<0.05,图4~5)。
讨论
CRC是一种常见的消化道恶性肿瘤,晚期复发和转移性CRC通常需要化疗, 但作用效果往往不
佳,病人获益很少[5],而肿瘤对化疗药物的多药耐药(multidrugresistance,MDR)是制约化疗效果的重要原因。MDR是在临床肿瘤化疗中的一个主要障碍,各国学者都在积极寻找逆转MDR的方法[6-12]。经典的MDR蛋白是ATP结合盒(ABC)家族转运蛋白过表达的结果,导致药物外排在ATP结合结构域的转运分子介导的多药转运及家属由ATP水解所释放的能量,并因此降低细胞内的药物浓度亚致死水平[13-14]。LAPTM4β是一个新发现的癌症相关基因(NM_018407),定位于染色体8q22.1,并且编码35 kDa的穿膜糖蛋白。LAPTM4β基因编码蛋白LAPTM4β-35在多种肿瘤表达上调,并发挥重要的作用[3]。Lee等[15]发现LAPTM4B-35的上调与PI3K/AKT信号传导通路的激活密切相关相关。越来越多的研究证实PI3K/AKT信号传导途径的激活可调节或增强多药耐药性[16-18],宫颈癌细胞使用PI3K/AKT信号传导抑制剂LY294002可以有效地抑制药物耐药性,并诱导HeLa细胞凋亡[19]。因此,我们推测LAPTM4β-35与结直肠癌的MDR密切相关。
耐药细胞株的构建是进行肿瘤多药耐药的研究的前提和基础,可为其发生机制、逆转策略提供良好的研究对象[20-22]。我们课题组成功构建了稳定的CRC耐奥沙利铂细胞株,并命名为HT-29/L-OHP,细胞株在L-OHP浓度为15 μmol/L的培养液稳定生长。本实验运用RT-PCR技术检测亲本细胞HT-29和耐药细胞株HT-29/L-OHP中LAPTM4β的表达,使用Western blot法检测两组细胞株中LAPTM4β-35的表达水平,结果耐药细胞株HT-29/L-OHP中LAPTM4β基因的表达高于亲本细胞,LAPTM4β-35的表达也明显高于亲本细胞,其基因和蛋白的表达呈一致性。说明在奥沙利铂长期作用下,LAPTM4β基因和LAPTM4β-35的表达水平增加,这可能是结直肠癌细胞的多药耐药一个耐药机制。

图4 Western blot检测LAPTM4β-35表达水平柱形图;图5 HT-29/L-OHP细胞(a)和HT-29细胞(b)中LAPTM4β-35的表达情况电泳图
在前期实验中,我们证明了CRC奥沙利铂耐药细胞株HT-29/L-OHP中LAPTM4β上调,其可以增加肿瘤细胞对奥沙利铂的外排,成为结直肠癌细胞对奥沙利铂耐药的一个原因。然而,未见LAPTM4β-35结合在ATP的相关信息[23-24]。而Li等[25]通过RNAi敲除宫颈癌HeLa细胞LAPTM4β-35,可减少阿霉素、紫杉醇和顺铂药物外排,提高药物的保留率,可以逆转MDR现象。另一种机制对MDR涉及与PI3K/AKT信号传导相关的凋亡反应的改变。很多实验证实,PI3K/AKT信号传导途径的激活可调节或增强多药耐药性[26-28]。这一信号通路在宫颈癌细胞活化和PI3K/AKT信号传导抑制剂LY294002可以有效地抑制耐药性和细胞生长,并诱导HeLa细胞的凋亡[29]。相反,发现通过RNAi敲除LAPTM4β-35可以显着抑制PI3K/AKT信号。说明LAPTM4β-35与PI3K/AKT信号传导可能有重要关联,并由此促进肿瘤生长和转移,在MDR关键作用通过P-糖蛋白(P-gp)增加药物外排减少细胞质进入细胞核的药物浓度,减少药物引起的DNA损伤和药物诱导的细胞凋亡[30]。Tan等[31]通过研究发现非激活型EGFR能够通过与癌蛋白LAPTM4β相互作用参与自噬起始过程,EGFR信号能够通过激活PI3K/AKT/mTOR信号通路或者通过磷酸化抑制beclin1进而抑制自噬过程,这可能对于控制肿瘤代谢,在代谢应激情况下促进肿瘤细胞存活具有重要意义。Li等[32]研究LAPTM4β的过表达能引起原发乳腺癌对蒽环类药物的耐药,使药物胞浆滞留并降低药物引起的DNA损伤。CRC奥沙利铂耐药十分复杂,有多种通路信号参与,需要进一步研究。
本课题组成功构建了稳定的CRC奥沙利铂耐药细胞株,耐药细胞株HT-29/L-OHP中LAPTM4β基因和LAPTM4β-35的表达高于亲本细胞,提示LAPTM4β-35参与CRC多药耐药的过程,可能会成为结直肠癌耐药的一个敏感指标。但LAPTM4β-35调控MDR作用机制尚不清楚,除此之外,LAPTM4β-35与PI3K/AKT信号传导的关联在后续实验中还需要进行更多的研究。
参考文献
[1]Geryk E,Horváth T,Konecny M.The expected worldwide burden of oesophagus,stomach and colorectal cancers.Vnitrnilekarstvi,2011,57(12):1006-1011.
[2]Segal NH,Saltz LB.Evolving treatment of advanced colon cancer.Annual review of medicine,2009,60:207-219.
[3]Xia LZ,Yin ZH,Ren YW,et al.The relationship between LAPTM4B polymorphisms and cancer risk in Chinese Han population:a meta-analysis.Springer Plus,2015,4(1):179.
[4]Kang Y,Yin M,Jiang W,et al.Overexpression of LAPTM4B-35 is associated with poor prognosis in colorectal carcinoma.AJS,2012,204(5):677-683.
[5]Crea F,Nobili S,Paolicchi E,et al.Epigenetics and chemoresistance in colorectal cancer:an opportunity for treatment tailoring and novel therapeutic strategies.Drug Resistance Updates,2011,14(6):280-296.
[6]Pasquier E,Kavallaris M,André N.Metronomic chemotherapy:new rationale for new directions.Nature reviews Clinical oncology,2010,7(8):455-465.
[7]Omrane S,Sghyer H,Audéon C,et al.Fungicide efflux and the MgMFS1 transporter contribute to the multidrug resistance phenotype in Zymoseptoria tritici field isolates.Environmental microbiology,2015,17(8):2805-2823.
[8]Bhirde AA,Chikkaveeraiah BV,Srivatsan A,et al.Targeted therapeutic nanotubes influence the viscoelasticity of cancer cells to overcome drug resistance.ACS nano,2014,8(5):4177-4189.
[9]Pavan B,Paganetto G,Rossi D,et al.Multidrug resistance in cancer or inefficacy of neuroactive agents:innovative strategies to inhibit or circumvent the active efflux transporters selectively.Drug discovery today,2014,19(10):1563-1571.
[10]Kozovska Z,Gabrisova V,Kucerova L.Colon cancer:Cancer stem cells markers,drug resistance and treatment.Biomedicine & Pharmacotherapy,2014,68(8):911-916.
[11]Yan XJ,Gong LH,Zheng FY,et al.Triterpenoids as reversal agents for anticancer drug resistance treatment.Drug discovery today,2014,19(4):482-488.
[12]Ganoth A,Merimi KC,Peer D.Overcoming multidrug resistance with nanomedicines.Expert opinion on drug delivery,2015,12(2):223-238.
[13]Larsen AK,Escargueil AE,Skladanowski A.Resistance mechanisms associated with altered intracellular distribution of anticancer agents.Pharmacology & therapeutics,2000,85(3):217-229.
[14]Gottesman MM.Mechanisms of cancer drug resistance.Annual review of medicine,2002,53(1):615-627.
[15]Lee JT,Steelman LS,McCubrey JA.Phosphatidylinositol 3′-kinase activation leads to multidrug resistance protein-1 expression and subsequent chemoresistance in advanced prostate cancer cells.Cancer research,2004,64(22):8397-8404.
[16]Knuefermann C,Lu Y,Liu B,et al.HER2/PI-3K/Akt activation leads to a multidrug resistance in human breast adenocarcinoma cells.Oncogene,2003,22(21):3205-3212.
[17]Tazzari PL,Cappellini A,Ricci F,et al.Multidrug resistance-associated protein 1 expression is under the control of the phosphoinositide 3 kinase/Akt signal transduction network in human acute myelogenous leukemia blasts.Leukemia,2007,21(3):427-438.
[18]Abdul-Ghani R,Serra V,Györffy B,et al.The PI3K inhibitor LY294002 blocks drug export from resistant colon carcinoma cells overexpressing MRP1.Oncogene,2006,25(12):1743-1752.
[19]Baranĉík M,Boháĉová V,Sedlák J,et al.LY294,002,a specific inhibitor of PI3K/Akt kinase pathway,antagonizes P-glycoprotein-mediated multidrug resistance.European journal of pharmaceutical sciences,2006,29(5):426-434.
[20]Zhang X,Xiao W,Wang L,et al.Deactivation of signal transducer and activator of transcription 3 reverses chemotherapeutics resistance of leukemia cells via down-regulating p-gp.PLoS One,2011,6(6):e20965.
[21]Yun M,Lee D,Park MN,et al.Cinnamaldehyde Derivative(CB-PIC) Sensitizes Chemo-Resistant Cancer Cells to Drug-Induced Apoptosis via Suppression of MDR1 and its Upstream STAT3 and AKT Signalling.Cellular Physiology and Biochemistry,2015,35(5):1821-1830.
[22]Rad SMAH,Langroudi L,Kouhkan F,et al.Transcription factor decoy:a pre-transcriptional approach for gene downregulation purpose in cancer.Tumor Biology,2015,36(7):4871-4881.
[23]Cabrita MA,Hobman TC,Hogue DL,et al.Mouse transporter protein,a membrane protein that regulates cellular multidrug resistance,is localized to lysosomes.Cancer research,1999,59(19):4890-4897.
[24]Hogue DL,Kerby L,Ling V.A mammalian lysosomal membrane protein confers multidrug resistance upon expression in Saccharomyces cerevisiae.JBC,1999,274(18):12877-12882.
[25]Li L,Wei XH,Pan YP,et al.LAPTM4B:a novel cancer-associated gene motivates multidrug resistance through efflux and activating PI3K/AKT signaling.Oncogene,2010,29(43):5785-5795.
[26]Knuefermann C,Lu Y,Liu B,et al.HER2/PI-3K/Akt activation leads to a multidrug resistance in human breast adenocarcinoma cells.Oncogene,2003,22(21):3205-3212.
[27]Abdul-Ghani R,Serra V,Györffy B,et al.The PI3K inhibitor LY294002 blocks drug export from resistant colon carcinoma cells overexpressing MRP1.Oncogene,2006,25(12):1743-1752.
[28]Tazzari PL,Cappellini A,Ricci F,et al.Multidrug resistance-associated protein 1 expression is under the control of the phosphoinositide 3 kinase/Akt signal transduction network in human acute myelogenous leukemia blasts.Leukemia,2007,21(3):427-438.
[29]Baranĉík M,Boháĉová V,Sedlák J,et al.LY294,002,a specific inhibitor of PI3K/Akt kinase pathway,antagonizes P-glycoprotein-mediated multidrug resistance.European journal of pharmaceutical sciences,2006,29(5):426-434.
[30]Li Y,Zou L,Li Q,et al.Amplification of LAPTM4B and YWHAZ contributes to chemotherapy resistance and recurrence of breast cancer.Nature medicine,2010,16(2):214-218.
[31]Tan X,Thapa N,Sun Y,et al.A kinase-independent role for EGF receptor in autophagy initiation.Cell,2015,160(1):145-160.
[32]Li Y,Zhang Q,Tian R,et al.Lysosomal transmembrane protein LAPTM4B promotes autophagy and tolerance to metabolic stress in cancer cells.Cancer research,2011,71(24):7481-7489.
(本文编辑:马天翼)
黄跃南,宁丽,李云龙,等.LAPTM4β在人结直肠癌耐药细胞株中的表达及意义[J/CD].中华结直肠疾病电子杂志,2015,4(5):505-510.
·论著·
(收稿日期:2015-07-27)
通讯作者:刘家麒,Email:hljljq@qq.com
基金项目:黑龙江省教育厅科学技术项目(12541303)
DOI:10.3877/cma.j.issn.2095-3224.2015.05.12
