AMPK信号通路在调节小鼠骨髓巨噬细胞抗菌性自噬效应中的作用
2015-03-08范仕郡祝元锋杨永军第三军医大学西南医院中心实验室重庆400038
范仕郡,祝元锋,杨永军,刘 鑫 (第三军医大学西南医院中心实验室,重庆 400038)
·论著·
AMPK信号通路在调节小鼠骨髓巨噬细胞抗菌性自噬效应中的作用
范仕郡,祝元锋,杨永军,刘鑫(第三军医大学西南医院中心实验室,重庆 400038)
[摘要]目的观察AMP依赖的蛋白激酶(AMPK)对小鼠骨髓巨噬细胞自噬及杀菌活性的调节作用,并探讨其可能机制。方法分离和体外培养小鼠原代骨髓巨噬细胞(BMDM),观察大肠埃希菌刺激后对BMDM细胞自噬水平及AMPK活化状态的影响。使用AMPK激动剂和抑制剂干预其活化,进一步观察大肠埃希菌感染的BMDM细胞中AMPK活化、自噬水平以及杀菌能力的变化。结果大肠埃希菌感染后的小鼠BMDM细胞自噬相关分子LC3B和Beclin1的表达显著升高,同时LC3Ⅱ/Ⅰ比值也明显升高,且其AMPK的磷酸化水平也随之显著上调。AMPK活性增强后,能够进一步上调BMDM细胞的自噬水平以及对细菌的降解清除。而AMPK活性被抑制后,细胞自噬水平和杀菌活性均显著下降。结论AMPK分子及其相关信号通路可能在调节巨噬细胞自噬水平以及抗菌效应方面发挥重要作用。
[关键词]AMPK;小鼠骨髓巨噬细胞;抗菌性自噬
自噬(autophagy)是一种细胞内的“自食(self eating)”现象[1-2]。细胞通过形成双层膜结构的自噬体,包裹胞质和细胞器、蛋白质等物质并将其转运至溶酶体进行降解清除,以维持细胞的稳态[3]。近来研究发现,在天然免疫细胞中,自噬体还可包裹和清除入侵细胞内的病原体,这一作用也被称为抗菌性自噬作用(antibacterial autophagy)[4-5]。目前有关抗菌性自噬的调控机制尚未完全阐明。AMP依赖的蛋白激酶(5’ adenosine monophosphate activated protein kinase,AMPK)是一种丝氨酸/苏氨酸激酶分子,在机体生物能量代谢调节中发挥关键性作用[6-7]。近来研究发现,AMPK对于自噬和炎症的调节也至关重要[8-9]。然而该通路是否与免疫细胞中抗菌性自噬效应的调节有关,目前尚不清楚。本文以小鼠骨髓巨噬细胞为研究对象,观察AMPK通路对于细胞自噬功能及抗菌效应的影响,以期阐明调节免疫细胞抗菌性自噬作用的可能机制。
1材料与方法
1.1材料
1.1.1实验动物及主要试剂雄性BALB/c小鼠,体质量(20±2) g,由北京华阜康生物科技股份有限公司提供。大肠埃希菌标准菌株ATCC35218购自美国ATCC公司。胰蛋白胨、酵母提取物、巨噬细胞集落刺激因子(M-CSF)、saponin(细胞裂解液)、AICAR(AMPK激动剂)和Compound C(AMPK抑制剂)等购自美国Sigma公司。胎牛血清、DMEM培养基、胰酶购自美国GIBCO公司。反转录试剂盒和SYBR定量PCR试剂盒购自日本TOYOBO公司。LC3B、AMPK、pAMPK、F4/80、tubulin抗体购自美国CST公司。RIPA细胞裂解液、BCA蛋白浓度测定试剂盒、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、SDS-PAGE凝胶配制试剂盒、彩色预染蛋白marker、SDS-PAGE蛋白上样缓冲液、4%多聚甲醛溶液、DAPI(细胞核染液)及BSA等购自碧云天生物科技有限公司。Trizol 总RNA提取试剂盒购自天根生物科技有限公司,生理盐水购自西南药业股份有限公司。
1.1.2主要仪器设备恒温摇床、电泳仪、定量PCR仪、核酸蛋白仪、高灵敏度化学发光成像系统、细菌计数系统、普通孵箱、CO2孵箱、倒置显微镜、激光共聚焦显微镜等。
1.2方法
1.2.1小鼠骨髓巨噬细胞(bone marrow derived macrophage, BMDM)的分离及体外培养BALB/c小鼠颈椎脱臼处死,75%酒精浸泡1 min,取出沥干酒精放置于方盘,将小鼠后肢的皮毛剥至足部,剪下后肢并放置在盛有生理盐水的培养皿中,剔除肌肉,在关节处剪断股骨和胫骨,用1 mL注射器吸取生理盐水,注入骨髓腔并反复冲洗5次,将骨髓冲洗液转移至50 mL离心管。4 ℃条件下,1 000 rpm离心5 min,用10 mL含10%血清和50 ng/mL M-CSF的DMEM细胞培养基重悬细胞,转至T25细胞培养瓶中,置于37 ℃,5%的CO2培养箱中培养24 h,弃上清,换5 mL含MCSF(50 ng/mL)和DMEM细胞培养基继续培养3 d后备用。
1.2.2大肠埃希菌的体外培养及BMDM细胞刺激处理挑取接种于营养琼脂平板上的大肠埃希菌标准菌株的菌落,转移至5 mL LB培养基中,37 ℃,250转增菌培养至OD600值为0.5~0.8左右(换算所得菌液浓度为5×107/mL~8×107/mL),离心弃上清,PBS洗涤2次并重悬菌液。将菌液按照与细胞比例为10∶1加入BMDM细胞中,孵育1 h后PBS洗涤细胞3次,加入AMPK或SIRT1的激动剂或抑制剂,继续培养2 h后洗涤细胞3次,加入0.3% saponin裂解细胞,稀释后取100 μl涂布于营养琼脂平板。
1.2.3免疫荧光染色将小鼠BMDM细胞以4%多聚甲醛固定,1%BSA室温封闭1 h,加入F4/80的一抗(1∶400稀释)。
1.2.4荧光定量PCR检测自噬相关基因的mRNA表达将小鼠BMDM细胞加入1 mL Trizol裂解液,离心取上清按照试剂盒说明书提取总RNA。行反转录及realtime-PCR反应,通过2-ΔΔCt的方法计算LC3B和Beclin1基因对于内参基因β-actin的相对定量比值[10]。
1.2.5western blot检测自噬相关蛋白的表达将小鼠BMDM细胞加入RIPA培养基,离心取上清胞浆蛋白,蛋白定量后经SDS-PAGE电泳,转膜、封闭,一抗(1∶1 000)过夜孵育,加入二抗(1∶2 000)并进行化学发光曝光处理。
1.3统计学处理

2结果
2.1小鼠BMDM细胞的形态及鉴定
小鼠骨髓细胞经分离培养后,在M-CSF的刺激下逐步增殖分化为BMDM细胞,培养24 h后,在倒置显微镜下可观察到细胞呈椭圆形、多角形或不规则形,部分贴壁。培养48 h后可以观察到细胞贴满培养瓶,大部分出现伪足。部分细胞伸展开并牢固黏附在培养瓶表面,细胞呈现明显的梭形,贴壁良好。通过免疫荧光结合激光共聚焦显微镜方法检测巨噬细胞标志物F4/80(红色),发现细胞几乎均为阳性着色,提示分化细胞的纯度较好(图1~2)。
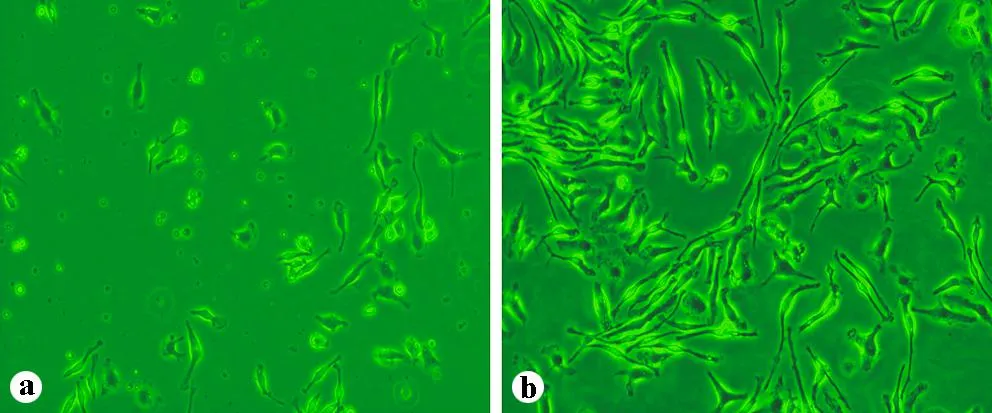
a:小鼠BMDM细胞24 h形态;b:小鼠BMDM细胞48 h形态
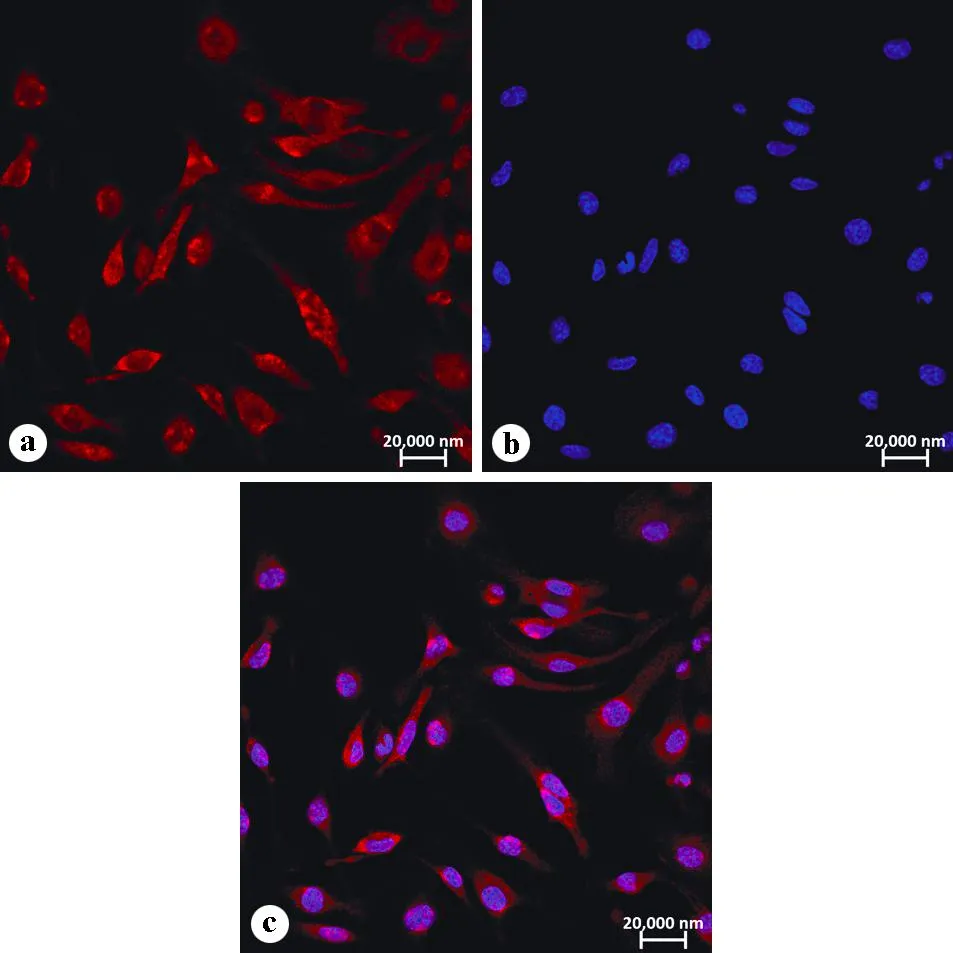
a:F4/80(红色);b:DAPI(蓝色);c:合并
2.2大肠埃希菌对BMDM细胞胞内自噬水平和AMPK的磷酸化水平的影响
大肠埃希菌作用于小鼠BMDM细胞后,自噬相关蛋白LC3B和Beclin1的mRNA表达较未处理组细胞显著上调(P<0.01)。同时经western blot检测发现,大肠埃希菌也可上调LC3Ⅱ/Ⅰ比值,表明大肠埃希菌能够上调BMDM细胞的自噬水平。进一步研究发现,大肠埃希菌还可促进AMPK的磷酸化,提示其诱发的自噬可能与上调AMPK的活化水平有关(图3)。
2.3AMPK对小鼠骨髓巨噬细胞的自噬水平和大肠埃希菌胞内降解的影响
为明确AMPK通路是否对小鼠巨噬细胞的抗菌性自噬效应具有调控作用,我们采用AMPK激动剂AICAR(1 mM)和抑制剂Compound C(10 μM)处理大肠埃希菌感染的BMDM细胞,观察到AICAR作用后可进一步上调LC3B的表达以及LC3Ⅱ/Ⅰ的比值,同时胞内活菌数目较单独大肠埃希菌感染组细胞显著降低(P<0.01),而Compound C则可下调LC3B的表达以及LC3Ⅱ/Ⅰ的比值(P<0.05),同时胞内活菌数目较单独大肠埃希菌感染组细胞显著升高(P<0.01),见图4~5。

*:与medium组比较,P<0.01
图3大肠埃希菌(EC)对BMDM细胞自噬水平以及AMPK活化的影响

*:与EC组比较,P<0.05;#:与EC组比较,P<0.01
图4AMPK激动剂(AICAR)和抑制剂(Compound C)对大肠埃希菌(EC)感染BMDM细胞自噬水平的影响
3讨论
自噬的激活对于胞内细菌的清除具有重要意义,然而引发细胞抗菌性自噬的调控机制尚未阐明[11-12]。
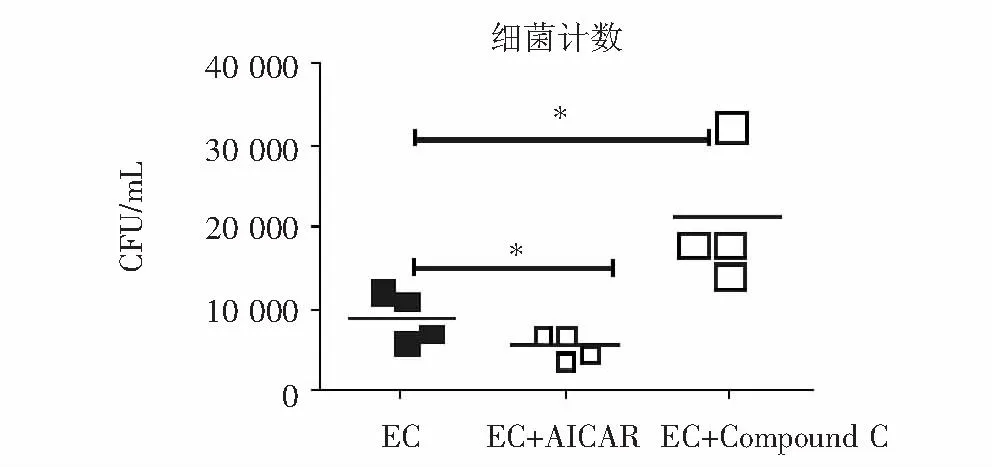
*:与EC组比较,P<0.01
图5AMPK激动剂(AICAR)和抑制剂(Compound C)对BMDM胞内大肠埃希菌(EC)降解的影响
在本研究中,我们发现大肠埃希菌感染后的小鼠BMDM细胞,其自噬水平显著升高,同时AMPK的磷酸化水平也显著上调。而通过化学抑制剂的方法增加或抑制AMPK的活性,能够影响BMDM细胞的自噬水平以及对细菌的降解清除,提示AMPK分子及其相关信号通路可能在调节细胞自噬水平以及抗菌免疫反应方面发挥重要作用。
为对吞噬细胞中抗菌性自噬效应进行研究,我们参考文献报道,对小鼠骨髓巨噬细胞(BMDM)的分离和分化方法进行了摸索[13],并通过活细胞染色和细胞表面标志物检测的方法对获得的BMDM细胞进行了活力和纯度分析,最终建立满足后续研究需求的细胞分离和体外培养方法。
近来发现,天然免疫细胞的自噬水平与其介导的炎症反应和杀菌活性密切相关[14]。吞噬细胞自噬水平的上调,可增强对结合分支杆菌和沙门氏菌等胞内寄生菌的降解清除[15]。大肠埃希菌虽不是特有的胞内寄生菌,但其也可侵入吞噬细胞中,引发细胞凋亡,影响对细菌的吞噬和杀伤。免疫功能低下的患者注射免疫球蛋白后,其外周血中心粒细胞的自噬水平显著提高,进而对多重耐药的大肠埃希菌杀伤能力也明显增强[16]。我们在前期研究中发现,使用荧光标记的大肠埃希菌与小鼠骨髓巨噬细胞共孵育后,可在胞内观察到吞噬入胞的大肠埃希菌,且与自噬体发生了明确的共定位现象。在本研究中,我们进一步证实,大肠埃希菌可上调自噬相关分子LC3B和Beclin1的表达,且能够增加LC3Ⅱ/Ⅰ的比值。该结果提示,大肠埃希菌能够直接诱导巨噬细胞自噬的发生。
AMPK是细胞能量代谢的核心调控分子。近来发现,AMPK分子也直接参与了对细胞自噬的调控。AMPK可抑制哺乳动物雷帕霉素靶蛋白(mammalian Targer of Rapamycin, mTOR)的活性,同时激活Beclin1/PI3KⅢ复合物,激活细胞自噬效应[8]。大量研究显示,AMPK分子在能量代谢和肿瘤相关的自噬调控中具有重要作用[17]。但其是否参与了对细菌介导的自噬效应的调控,目前尚不明确。因此我们首先检测了小鼠BMDM细胞中AMPK分子的活化水平。结果显示,大肠埃希菌处理的小鼠BMDM细胞中,AMPK分子的磷酸化水平明显增加。上述结果提示,AMPK分子可能对大肠埃希菌介导的巨噬细胞自噬反应具有调控作用。为明确该设想,我们使用AMPK的激动剂AICAR和抑制剂Compound C改变其活性,观察对细胞自噬和细菌降解作用的影响[18-19]。结果显示,AMPK激动剂能够增加其磷酸化水平,同时进一步上调自噬分子LC3B的mRNA表达和LC3Ⅱ/Ⅰ的比值(相对于单独的细菌处理组)。与此相反的是,AMPK的抑制剂Compound C可下调LC3B的表达和LC3Ⅱ/Ⅰ的比值。在细菌计数实验中,我们进一步发现,AMPK激活后,BMDM胞内活菌数量显著降低,而AMPK受抑制后,胞内活菌数量显著升高。该结果表明,AMPK对小鼠巨噬细胞的杀菌作用具有正调控效应。该结果与AMPK对自噬的调节作用一致,提示AMPK可能通过上调细胞自噬水平,进而增强杀菌活性。
综上,本研究对引发细胞抗菌性自噬的调控机制进行了初步研究,发现了大肠埃希菌对小鼠巨噬细胞自噬水平的上调效应,并证实该作用与其激活AMPK分子,进而上调自噬相关分子的表达和活化有关。我们同时也发现,AMPK分子的活化,还能够直接影响巨噬细胞细胞对细菌的降解清除,提示AMPK分子及其相关信号通路可能在调节细胞自噬水平以及抗菌免疫反应方面发挥重要作用,并有可能是机体抗感染免疫应答的重要信号机制之一。
[参考文献]
[1] Chen P,Cescon M,Bonaldo P.Autophagy-mediated regulation of macrophages and its applications for cancer[J].Autophagy,2014,10(2):192-200.
[2] Rubinsztein DC,Bento CF,Deretic V.Therapeutic targeting of autophagy in neurodegenerative and infectious diseases[J].J Exp Med,2015,212(7):979-990.
[3] Rubinsztein DC,Codogno P,Levine B.Autophagy modulation as a potential therapeutic target for diverse diseases[J].Nat Rev Drug Discov,2012,11(9):709-730.
[4] Huang J,Canadien V,Lam GY,et al.Activation of antibacterial autophagy by NADPH oxidases[J].Proc Natl Acad Sci USA,2009,106(15):6226-6231.
[5] Homer CR,Richmond AL,Rebert NA,et al.ATG16L1 and NOD2 interact in an autophagy-dependent antibacterial pathway implicated in Crohn’s disease pathogenesis[J].Gastroenterology,2010,139(5):1630-1641.
[6] Oakhill JS,Steel R,Chen ZP,et al.AMPK is a direct adenylate charge-regulated protein kinase[J].Science,2011,332(6036):1433-1435.
[7] Towler MC,Hardie DG.AMP-activated protein kinase in metabolic control and insulin signaling[J].Circ Res,2007,100(3):328-341.
[8] Kim J,Kundu M,Viollet B,et al.AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J].Nat Cell Biol,2011,13(2):132-141.
[9] Egan D,Kim J,Shaw RJ,et al.The autophagy initiating kinase ULK1 is regulated via opposing phosphorylation by AMPK and mTOR[J].Autophagy,2011,7(6):643-644.
[10] Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T) method[J].Nat Protoc,2008,3(6):1101-1108.
[11] Lassen KG,Kuballa P,Conway KL,et al.Atg16L1 T300A variant decreases selective autophagy resulting in altered cytokine signaling and decreased antibacterial defense[J].Proc Natl Acad Sci USA,2014,111(21):7741-7746.
[12] von Muhlinen N,Akutsu M,Ravenhill BJ,et al.An essential role for the ATG8 ortholog LC3C in antibacterial autophagy[J].Autophagy,2013,9(5):784-786.
[13] 范世郡,刘鑫,黄敏,等.小鼠腹腔巨噬细胞的快速提取及培养[J].局解手术学杂志,2015,24(2):130-131.
[14] Deretic V,Saitoh T,Akira S.Autophagy in infection,inflammation and immunity[J].Nat Rev Immunol,2013,13(10):722-737.
[15] Wild P,Farhan H,McEwan DG,et al.Phosphorylation of the autophagy receptor optineurin restricts Salmonella growth[J].Science,2011,333(6039):228-233.
[16] Matsuo H,Itoh H,Kitamura N,et al.Intravenous immunoglobulin enhances the killing activity and autophagy of neutrophils isolated from immunocompromised patients against multidrug-resistant bacteria[J].Biochem Biophys Res Commun,2015,464(1):94-99.
[18] Nakamaru K,Matsumoto K,Taguchi T,et al.AICAR,an activator of AMP-activated protein kinase,down-regulates the insulin receptor expression in HepG2 cells[J].Biochem Biophys Res Commun,2005,328(2):449-454.doi:10.1155/2014/603980.
[19] Liu X,Chhipa RR,Nakano I.The AMPK inhibitor compound C is a potent AMPK-independent antiglioma agent[J].Mol Cancer Ther,2014,13(3):596-605.
(编辑:杨颖)
Role of AMPK signaling pathway in regulating antibacterial autophagy in murine bone marrow derived macrophages
FAN Shi-jun,ZHU Yuan-feng,YANG Yong-jun,LIU Xin
(Medical Research Center, Southwest Hospital,Third Military Medical University,Chongqing 400038,China)
Abstract:ObjectiveTo investigate the regulatory effects and possible mechanisms of autophagy induction and bactericidal activity in muring bone marrow derived macrophages (BMDMs). MethodsMurine BMDMs were isolated and cultured in vitro.Then standard strain of E.coli was used to infect BMDMs and cellular autophagy levels and AMPK activation were detected.We next modulated functions of AMPK by pretreating cells with the specific agonist or antagonist of AMPK.Then cellular AMPK activation, autophagy levels and bactericidal activity were observed after E.coli infection. ResultsIn E.coli infected BMDMs,autophagy related molecules like LC3B and Beclin1 were upregulated,accompanied with elevated LC3Ⅱ/Ⅰratio.Phosphorylation of AMPK was also upregulated by E.coli treatment.Enhanced AMPK activity by its agonist leads to increased cellular autophagy and bactericidal activity,whereas inhibition of AMPK by its suppressor downregulated autophagy and dampened bactericidal activity. ConclusionAMPK and its related signaling pathway is required for anti-bacterial response in macrophage,which is dependent on its function in upregulating autophagy related molecules and inducing autophagy.
[中图分类号]R446.63;Q813.1
[文献标识码]A
[文章编号]1672-5042(2015)06-0591-04
[收稿日期]2015-09-29[修回日期] 2015-10-10
[基金项目]国家自然科学基金(81202566)
doi:10.11659/jjssx.09E015136
Kewords: AMPK;murine bone marrow derived macrophages (BMDM);antibacterial autophagy
