黄渤海海水中丙烯酸的生成与降解*
2015-03-08刘欢欢刘春颖李培峰
刘欢欢 刘春颖 李培峰
(中国海洋大学海洋化学理论与工程技术教育部重点实验室 青岛 266100)
丙烯酸(acrylic acid, AA)分子式为 C3H4O2, 是海洋中主要含硫化合物 β-二甲基巯基丙酸内盐(dimethylsufoniopropionate, DMSP)的裂解产物之一,DMSP的另一裂解产物是广受关注的痕量活性气体二甲基硫(DMS)。DMSP通过裂解酶和去甲基化反应两种途径均可产生丙烯酸, 并满足生物体对碳和能量的需求(Bajt et al, 1997; 杨桂朋等, 2004)。在海洋中, 丙烯酸具有重要的生态学意义(Kiene, 1990)。研究表明,丙烯酸在棕囊藻的生长过程中表现出抗菌性, 从而影响藻类的初级生产力(Sieburth, 1961; Slezak et al,1994); DMSP降解反应是藻类被摄食时的一种激活化学防御系统的响应, 丙烯酸作为防御因子起主要作用,对浮游植物、浮游动物捕食产生影响等(Wolfe et al,1996, 1997; 王朝晖等, 2002)。本实验室对中国近海海域丙烯酸的浓度分布展开了一系列的研究工作, 并取得了一定的成果(王莉莉等, 2012; 刘春颖等, 2014)。丙烯酸可以经过光化学氧化和微生物过程被消耗掉(Bajt et al, 1997), 但是目前未见有现场研究的报道。
黄海和渤海均为中国近海, 有多条河流直接或间接注入, 受到人类活动影响较为严重, 陆地、海洋、大气各种过程相互作用较为剧烈。地处中纬地带, 具有温带海域的性质, 同时主要受到沿岸流和黄海暖流的影响。目前, 有关黄渤海DMSP、DMS和丙烯酸浓度分布的研究已有相关报道(焦念志等, 1999; 杨桂朋等,2007; 刘春颖等, 2014), 但该海域丙烯酸迁移转化的有关研究还未见报道。本文开展现场海水的观测对该海域丙烯酸的产生和降解规律进行分析, 并对其降解速率和其它环境因素对降解过程的影响进行了初步研究, 以期对丙烯酸的迁移转化过程有进一步的认识。
1 材料与方法
1.1 采样航次及站位介绍
于2013年6月搭载“东方红2”号, 在黄渤海选取F2(121.00°E, 35.00°N)、J5(123.18°E, 38.05°N)、E7(123.78°E, 34.00°N)和 P2(119.49°E, 37.97°N)站位(图1)进行丙烯酸的生成与降解现场实验。
1.2 样品的采集、保存与测定方法
DMSP降解实验中, 分别采取 800mL F2和 J5站位的表层海水后, 在“东方红 2”号甲板上, 于恒温水浴槽中水浴, 使水浴温度与现场水温保持一致, 并避光放置。每隔1h取样一次, 采集DMSP和丙烯酸水样各10mL, 连续采样6次。DMSP水样现场测定,丙烯酸水样经过滤冷藏保存, 带回陆地1个月内完成测定, 此期间丙烯酸浓度几乎无变化(刘春颖等, 2013)。
丙烯酸的降解实验中, 采集 E7和 P2站位的表层水, 水样分别用1L的锡纸包裹的玻璃瓶、1L的透光玻璃瓶和250mL的石英管盛装。在现场海水水浴,自然光照条件下, 每隔2h采集10mL水样, 经过滤冷藏保存, 带回陆地测定。
丙烯酸浓度采用高效液相色谱法测定。选用Agilent SB-AQ-C18柱(100mm×4.6mm, 填料粒径5μm)为分离柱, 以 90%浓度为 0.35%的磷酸溶液(pH=2.0)和 10%的甲醇为流动相, 流速为 0.5mL/min,测定时柱温设定为 40°C, 使用紫外检测器, 检测波长为210nm, 外标法用L-2000高效液相色谱仪(日立公司, 日本)定量测定。方法的检出限为0.004μmol/L,精密度为1.6%(刘春颖等, 2013)。
DMSP的测定是在 pH≥13强碱条件下按 1∶1的比例完全降解为DMS, 通过测定DMS含量间接得到DMSP的含量。DMS的测定过程为: 将10—20mL样品用玻璃注射器注入气提室, 用 40mL/min的高纯氮气吹扫20min, 经过有无水CaCl2的干燥管干燥后,经液氮冷阱捕集一段时间后, 再换热水浴加热解析,最后DMS被载气带入GC-14B气相色谱仪(岛津公司,日本)进行分析。所用方法和仪器的检出限为2.7pmol(10—12mol)硫, 精密度为 5%(Yang et al, 2006)。
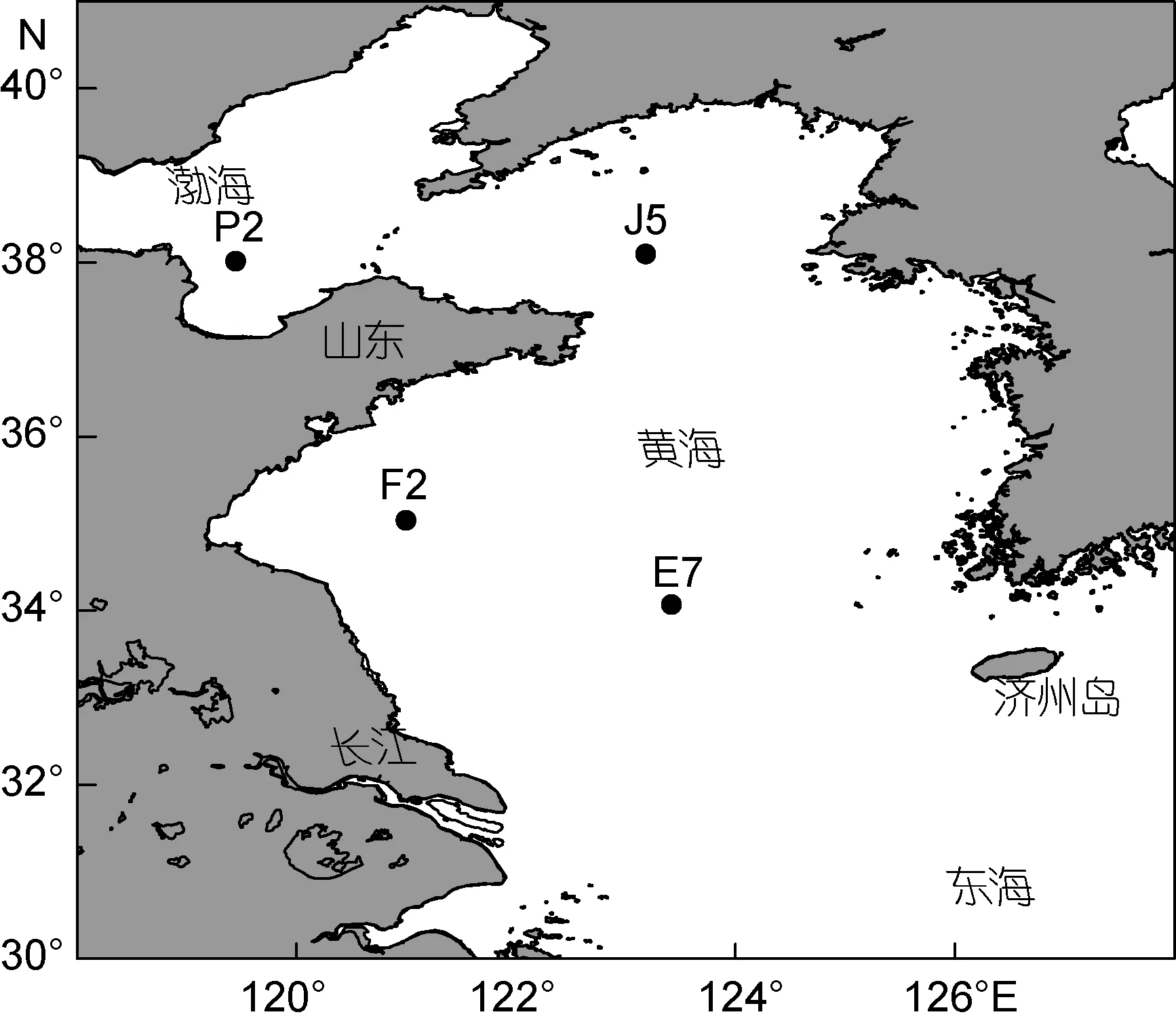
图1 黄渤海采样站位Fig.1 Sampling stations in the Yellow Sea and the Bohai Sea
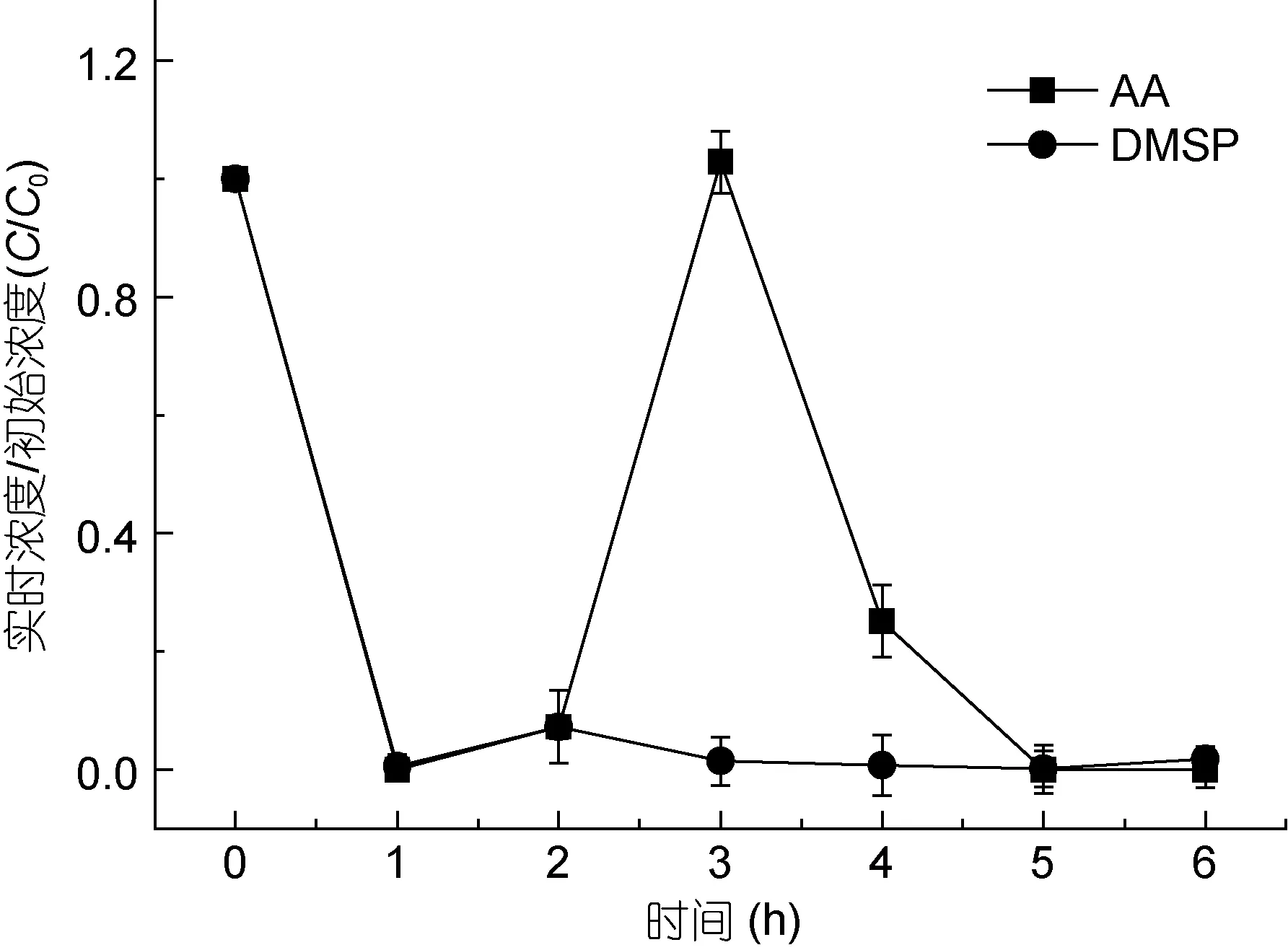
图2 南黄海F2站位DMSP和丙烯酸(AA)的浓度变化Fig.2 The concentration variations of DMSP and AA at station F2 in the South Yellow Sea
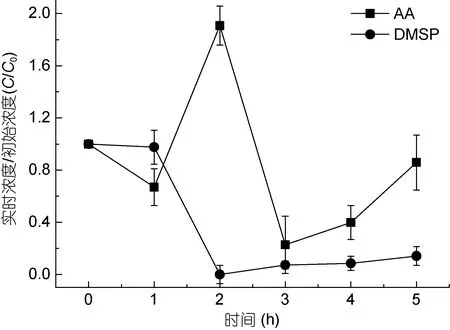
图3 北黄海J5站DMSP和丙烯酸(AA)的浓度变化Fig.3 The concentration variations of DMSP and AA at station J5 in the North Yellow Sea
2 结果与讨论
2.1 DMSP的降解实验
2.1.1 DMSP降解过程中 DMSP和丙烯酸的变化南黄海 F2站位 DMSP初始浓度(C0)为 0.045μmol/L,丙烯酸初始浓度为0.597μmol/L。由图2可以看到, 在最初的 1h中, DMSP和丙烯酸分别降解为原来的0.5%和0%, 随后丙烯酸在短暂的持衡之后迅速增多,达到一个最大值, 在 3h后浓度开始下降直至 0; 而DMSP则在略有增多后又保持在0左右, 这可能是避光后丙烯酸在微生物的活动下继续降解, 迅速减少,而 DMSP降解产生丙烯酸使得其自身含量下降, 丙烯酸增多, 最终丙烯酸通过微生物途径降解掉。
北黄海J5站位DMSP起始浓度为0.034μmol/L,丙烯酸起始浓度0.344μmol/L, 均低于F2站位。J5站位的降解与F2站位大致相似(图3)。DMSP在开始保持了一个短暂的持平, 1h后开始降解, 至2h达到最小值0, 随后略有增高。丙烯酸浓度在1h内降到了原来的66.9%, 然后开始增多, 在2h即达到最大值, 为初始浓度的 190.7%, 随后下降, 至 3h达到最低值22.7%, 其后又有增加的趋势。F2和J5站位的丙烯酸达到最低值和最大值的时间不相同, 虽然都在 1h内降到最低值, 但可能由于F2站位丙烯酸和DMSP初始浓度高, 产生的丙烯酸在 3h才达到最大值, 而 J5站位丙烯酸在2h即达到最大值。
在南黄海和北黄海都观测到了 DMSP的降解和丙烯酸的生成现象。但是由于影响 DMSP和丙烯酸的产生和去除途径很多, DMSP的降解和丙烯酸的生成表现出复杂性。
2.1.2 DMSP的降解实验中表观反应速率的估算在DMSP的降解实验中, 我们估算了0—5h内DMSP和丙烯酸的浓度变化速率, 由计算可知两者均表现出降解的趋势。表1为F2和J5站位DMSP和丙烯酸的表观降解速率。在F2站位, DMSP和丙烯酸的表观降解速率分别为 0.009μmol/(L·h)和 0.119μmol/(L·h),在 J5站位两者的表观降解速率分别为0.006μmol/(L·h)和0.010μmol/(L·h), 丙烯酸的表观降解速率总是大于DMSP的表观降解速率, 这可能是因为暗反应中DMSP降解生成丙烯酸的酶的活性降低, 而微生物降解不受光照的影响。比较F2和J5站位发现, 不管是DMSP还是丙烯酸, 起始浓度越高, 其表观降解速率则越大, 这是与化学反应浓度质量定律一致的。
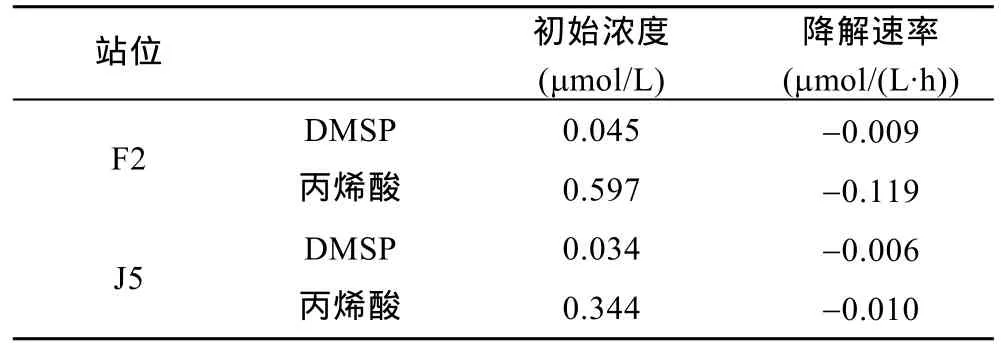
表1 黄海DMSP和丙烯酸的表观降解速率Tab.1 The degradation rates of DMSP and AA in the Yellow Sea
F2和J5站位中DMSP的最大表观降解速率分别为 0.045μmol/(L·h)和 0.033μmol/(L·h), 也与 DMSP 的起始浓度成正比; 而这两个站位丙烯酸的最大表观降解速率分别为 0.597μmol/(L·h)和 0.578μmol/(L·h),二者相差不大, 并未与丙烯酸的起始浓度表现出明显的相关性。F2和J5站位丙烯酸的最大生成速率分别为 0.571μmol/(L·h)和 0.426μmol/(L·h), 丙烯酸起始浓度越高, 则其最大生成速率越大。
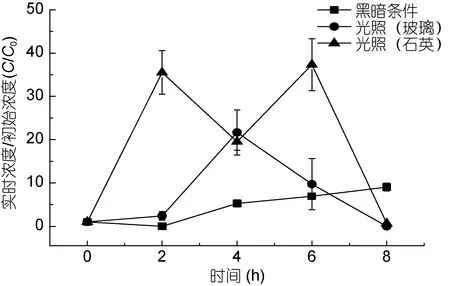
图4 南黄海E7站位丙烯酸的浓度变化Fig.4 Variation in concentration of AA at station E7 in the South Yellow Sea
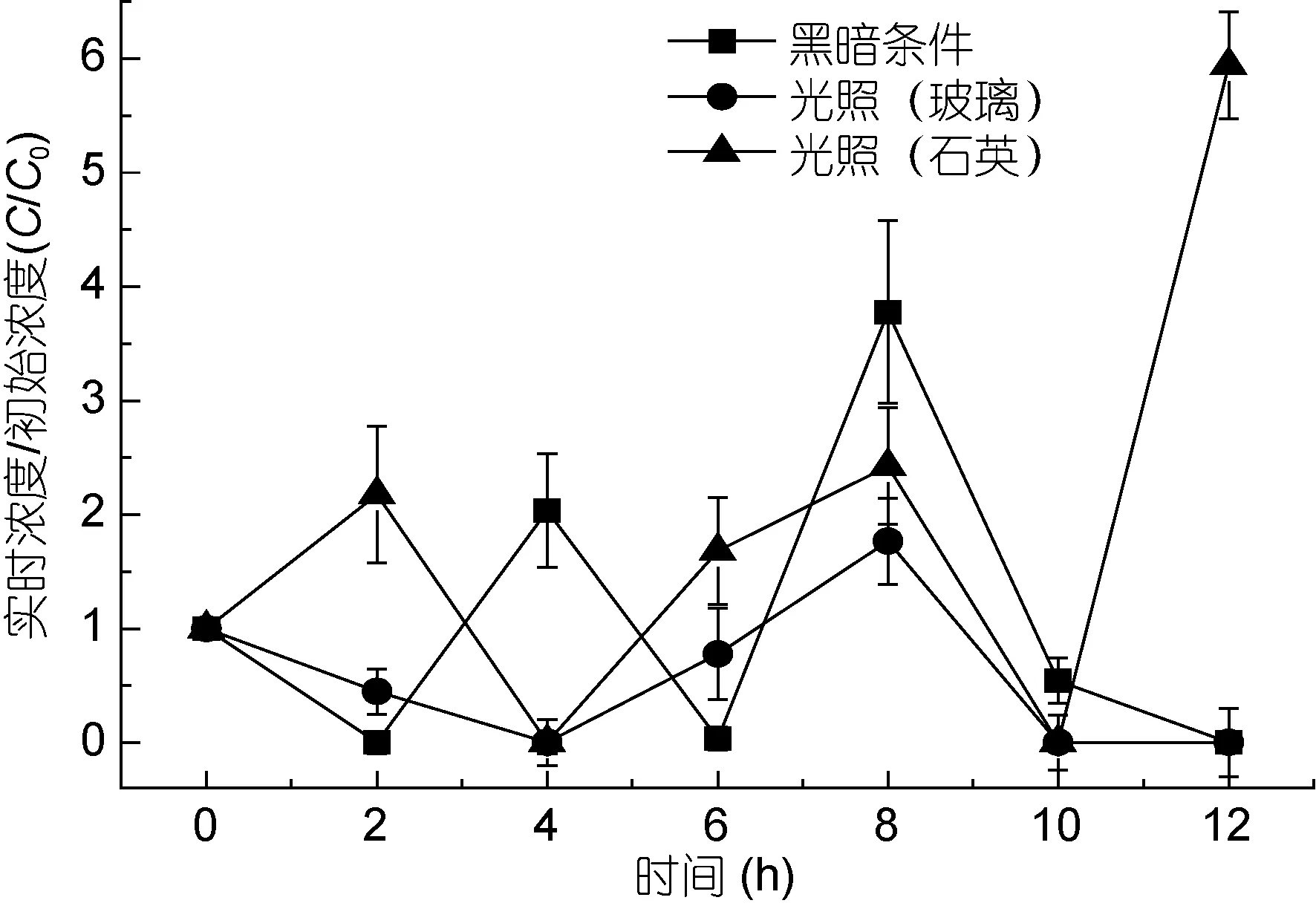
图5 渤海P2站位丙烯酸的浓度变化Fig.5 Variation in concentration of AA at station P2 in the Bohai Sea
2.2 丙烯酸的降解实验
2.2.1 丙烯酸的降解实验中不同容器中丙烯酸的浓度变化 南黄海 E7站位丙烯酸起始浓度为0.015μmol/L。由图4可以看到, 光照条件下丙烯酸含量迅速增加, 石英容器内丙烯酸浓度在 2h内达到了初始浓度的35倍左右, 之后下降, 在4h降至一个低值, 约为起始浓度的 20倍, 而此时恰好玻璃容器内丙烯酸的含量达到最大值, 此后石英光照丙烯酸浓度回升, 在 6h达到最大值后于 8h降至 66.7%左右,而玻璃容器内丙烯酸则直接降解, 在 8h同时达到 0左右。而黑暗条件下丙烯酸在2h降至0后逐渐增大,在8h后已达到起始浓度的9倍左右。
由图5可以看出, 渤海P2站位石英容器内丙烯酸的含量在初始 2h增加至起始浓度的2倍左右, 然后迅速下降, 至 4h时已基本完全降解, 这段时间的变化与南黄海E7站位一致, 不同的是之后浓度上升,至8h才达到最大值, 然后在10h下降至0, 比E7站位滞后了2h, 10h后丙烯酸浓度陡然上升, 12h已达到起始浓度的 6倍左右。玻璃容器内丙烯酸浓度在0—4h经历了一个下降的过程, 浓度低至0, 在4h到10h之间变化趋势与石英容器结果保持了一致, 同时在8h左右达到最大值, 10h之后到12h基本维持浓度为0。黑暗条件下丙烯酸浓度的变化比较复杂, 前2h下降至0左右, 随后的8h先后两次升降, 在4h和8h时达到极大值, 分别是起始浓度的 2倍和 4倍左右,至12h则彻底降至0。
对比南黄海和渤海的丙烯酸降解实验, 可以发现, 在石英容器中, 丙烯酸浓度均是连续两次先升后降, 产生两个最高浓度, 且这两个最高浓度相差不大。而玻璃容器中, 丙烯酸的浓度均有一个维持时间为6h左右的先升后降过程, E7站位最高浓度达到了起始浓度的20倍左右, 而P2站位只有起始浓度的2倍左右。黑暗条件下丙烯酸的浓度在最初2h均下降至0左右, 2h到4h则有上升的趋势, 其后的变化无相似之处。总体来看, E7站位丙烯酸浓度变化幅度远大于 P2站位, 这可能主要是两个站位起始浓度不同引起的, E7站位为 0.015μmol/L, 而 P2站位则高达0.085μmol/L。Bajt等(1997)研究发现, 在同一种介质中, 起始浓度越小, 丙烯酸的降解率和降解速率常数越大, 推测其原因为位于激发态的丙烯酸分子和位于基态的丙烯酸分子可以发生分子间反应, 且丙烯酸浓度越高分子间反应越显著。对比石英和玻璃容器的结果, 可以发现, 石英容器中丙烯酸浓度变化更为明显, 其原因可能是光源达到溶液表面时, 石英容器对光强和光能损耗均小于玻璃容器, 其对光的利用率高于玻璃材质。光强越大, 光能越大, 更能有效地激发并降解有机物。
2.2.2 丙烯酸的降解实验中表观反应速率的估算因丙烯酸降解实验中其浓度变化受到多种因素的影响, 包括了光产生, 光降解和微生物消耗。本文选取前4h计算其变化速率并进行分析讨论。
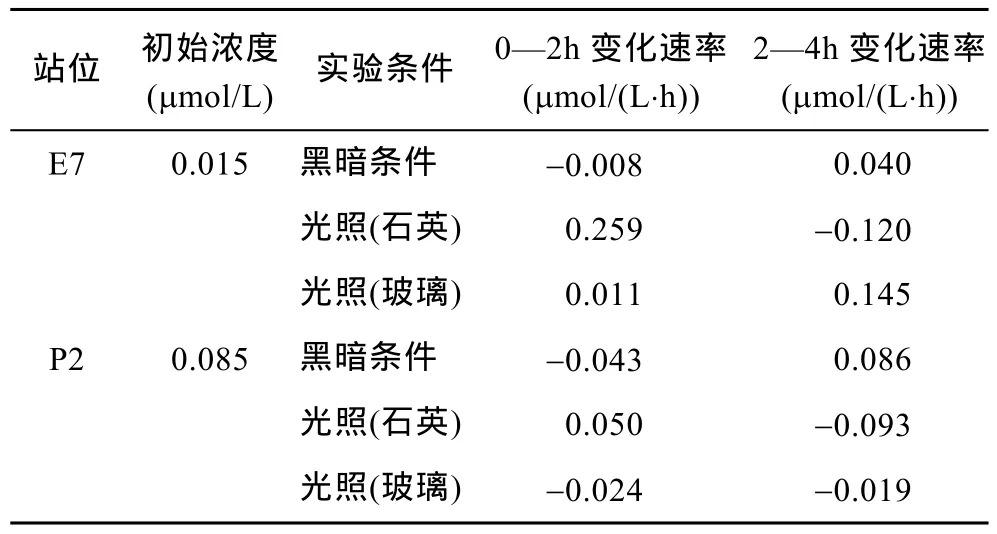
表2 黄渤海丙烯酸浓度变化速率Tab.2 The rate of variation in concentration of AA in the Yellow Sea and Bohai Sea
由表2可以看出, 在黑暗条件下, 0—2h丙烯酸的降解大于其生成, 表现为降解过程, 2—4h丙烯酸生成大于降解, 表现为生成过程。E7和 P2站位在0—2h 的 降 解 速 率 分 别 为 0.008μmol/(L·h)和0.043μmol/(L·h), 在后2h生成速率分别为0.040μmol/(L·h)和 0.086μmol/(L·h), 可以看到起始浓度越高, 其变化速率越大。石英容器内, 丙烯酸先为生成大于降解,后为降解大于生成, 且起始浓度越高, 变化速率越小,与黑暗反应表现相反。这可能是由于光化学反应的影响造成的, 在光照条件下, 浮游植物中酶的活性强,DMSP生成丙烯酸的速率大, 补充了由于微生物活动和光降解造成的丙烯酸的减少; 在黑暗条件下,DMSP生成丙烯酸的速率相对较弱, 而丙烯酸的降解主要依靠微生物活动, 而无光降解过程。运用黑暗条件下和光照条件下(石英容器内)的变化速率, 我们可以计算出丙烯酸的光化学表观反应速率。在0—2h丙烯酸光化学表观反应速率为 0.267μmol/(L·h)和0.093μmol/(L·h), 在 2—4h丙烯酸的光化学表观反应速率为-0.16μmol/(L·h)和-0.179μmol/(L·h), 这说明前 2h丙烯酸的光化学反应表现为丙烯酸的生成, 后2h表现为丙烯酸的光降解。使用玻璃容器的光照条件下E7站位表现出丙烯酸增加的过程, 而P2站位表现出丙烯酸降解的过程, 两者截然相反, 与使用石英容器的结果也不相同, 由于该过程受到的影响因素很多, 造成这种结果的原因需进一步研究。
3 结语
研究表明, 黄渤海海水中存在着 DMSP的降解和丙烯酸的生成现象。在DMSP降解过程中, 丙烯酸的表观降解速率一直大于 DMSP, 起始浓度越高, 降解速率越大。在 AA降解过程中, 前 2h表现为丙烯酸的光化学生成, 而后 2h表现为光化学降解。由于丙烯酸的生成和降解受到多种因素的影响, 故表现出复杂的特征。
王莉莉, 刘春颖, 杨桂朋等, 2012. 海洋中丙烯酸的研究进展.海洋环境科学, 31(2): 295—299
王朝晖, 尹伊伟, 陈善文等, 2002. 丙烯酸及丙烯酯对水生生物的急性毒性. 暨南大学学报(自然科学版), 23(5):76—80
刘春颖, 王莉莉, 杨桂朋等, 2013. 海水中丙烯酸的高效液相色谱法建立及应用. 海洋学报, 35(1): 172—176
刘春颖, 刘欢欢, 杨桂朋等, 2014. 夏季黄海冷水团海域的丙烯酸分布与海洋环境因子和叶绿素a变化之间的关系. 地球科学进展, 29(3): 361—368
杨桂朋, 康志强, 景伟文等, 2007. 海水中痕量DMS和DMSP分析方法的研究. 海洋与湖沼, 38(4): 322—328
杨桂朋, 景伟文, 陆小兰, 2004. 海洋中 DMSP的研究进展.中国海洋大学学报, 34(5): 854—860
焦念志, 柳承璋, 陈念红, 1999. 东海二甲基硫丙酸的分布及其制约因素的初步研究. 海洋与湖沼, 30(5): 525—531
Bajt O, Šket B, Faganeli J, 1997. The aqueous photochemical transformation of acrylic acid. Marine Chemistry, 58(3—4):255—259
Kiene R P, 1990. Dimethyl sulfide production from dimethylsulfoniopropionate in coastal seawater samples and bacterial cultures. Application Environment Microbiology,56(11): 3292—3297
Sieburth J M, 1961. Antibiotic properties of acrylic acid, a factor in the gastrointestinal antibiosis of polar marine animals.Journal of Bacteriology, 82(1): 72—79
Slezak D M, Puskaric S, Herndl G J, 1994. Potential role of acrylic acid in bacterioplankton communities in the sea.Marine Ecology Progress Series, 105: 191—197
Wolfe G V, Steinke M, 1996. Grazing-activated production of dimethyl sulfide (DMS) by two clones of Emiliania huxleyi.Limnology and Oceanography, 41(6): 1151—1160
Wolfe G V, Steinke M, Kirst G O, 1997. Grazing-activated chemical defence in a unicellular marine alga. Nature,387(6636): 894—897
Yang G P, Jing W W, Li L et al, 2006. Distribution of dimethylsulfide and dimethylsulfoniopropionate in the surface microlayer and subsurface water of the Yellow Sea,China during spring. Journal of Marine Systems, 62(1—2):22—34
