湛江湾浮游动物群落结构特征及其周年变化
2015-03-07龚玉艳张才学陈作志叶丽娣陈伟杰王伟荣孙省利
龚玉艳, 张才学, 陈作志 叶丽娣, 陈伟杰, 王伟荣, 孙省利
(1. 中国水产科学研究院南海水产研究所, 农业部南海渔业资源开发利用重点实验室, 广东 广州 510300; 2. 广东海洋大学海洋资源与环境监测中心, 广东 湛江 524088)
湛江湾浮游动物群落结构特征及其周年变化
龚玉艳1,2, 张才学2, 陈作志1, 叶丽娣2, 陈伟杰2, 王伟荣2, 孙省利2
(1. 中国水产科学研究院南海水产研究所, 农业部南海渔业资源开发利用重点实验室, 广东 广州 510300; 2. 广东海洋大学海洋资源与环境监测中心, 广东 湛江 524088)
2010年10月至2011年9月对湛江湾浮游动物进行了周年调查, 研究了其群落结构的周年变化及影响因素。结果共检出浮游动物87种和29类浮游幼虫, 隶属于16大类群, 群落结构主要由桡足类(30种)、浮游幼虫(29类)和原生动物(23种)所组成, 分别占总种类数的25.86%、25.00%和19.83%。浮游动物种类数以4月最多, 2月和3月最少, 4~9月的总种类数均高于其他月份。湛江湾浮游幼虫以底栖动物幼虫为主, 在4月种类最多, 5月丰度最高, 4~7月为湛江湾海洋动物的繁盛时期。浮游动物优势种共有22种(类), 其中浮游幼虫9类, 原生动物7种, 桡足类3种, 水母类、毛颚类、被囊类各1种, 以12月、4月和5月优势种最多(8种), 2月最少(2种), 无全年优势种, 群落结构明显趋于小型化。各相邻月份的共有种类数在18~33种, 物种更替率R的范围为37.25%~73.61%, 多样性指数H'、均匀度J及丰富度d的年均值较低, 分别为2.64、0.54和3.32。在调查期间, 湛江湾浮游动物丰度出现了3个高峰, 且分别由不同的浮游动物类群组成, 其中12月份的高峰主要由原生动物组成, 2月份的高峰主要由桡足类组成, 而 5月份的高峰则主要由浮游幼虫组成, 3大类群共同主导湛江湾浮游动物群落结构;浮游动物生物量仅在2月和9月出现高峰, 呈现月份双峰型变化。湛江湾浮游动物的周年变化主要受水温、食物及摄食压力的影响。
浮游动物; 群落结构; 桡足类; 原生动物; 浮游幼虫; 湛江湾
湛江港湾位于广东省雷州半岛的东北部, 湾内自然岸线长241km, 湾域面积264.9km2, 纵深60km,是集商港、军港、渔港和油港于一身的深水良港。港湾内及周边的交通运输业、养殖业、石油加工业及旅游业等较为发达, 而各行业的发展也给港湾生态环境带来了各种环境污染问题, 这可直接影响港湾水体环境的变化, 并可能引起海洋生物类群和数量的变化, 进而影响到海洋生态系统的结构与功能。浮游动物是海洋次级生产力的主要组成者, 在海洋物质循环中起着承上启下的作用, 是对能量、物质循环起调控作用的关键功能群, 其群落结构动态变化制约着浮游植物的群落结构和丰度, 也对鱼、虾、贝类等海洋生物资源产生直接或间接影响[1-2]。
对湛江湾浮游动物的研究最早始于沈嘉瑞 1963年和 1966年的报道, 近几年, 张才学及王学锋也有对湛江湾浮游动物进行过研究, 但想要深入了解湛江湾海洋生物健康状况, 基于几次的调查数据是远远不够的, 必须进行长期、系统的深入研究。作者在2010年10月至2011年9月对湛江湾浮游动物及其他生态因子进行了逐月的跟踪调查, 旨在深入研究浮游动物群落结构、丰度、生物量的周年动态变化及其影响因素, 并为进一步了解湛江湾浮游动物积累基础资料, 也为港湾生态环境的保护提供依据。
1 材料与方法
1.1 样品采集与分析
2010年10月至2011年9月对湛江湾生态环境因子进行了逐月调查, 根据湛江湾的地形地貌共布设了6个测站(图1), 调查的内容有浮游动物、浮游植物、叶绿素 a和理化环境因子等。浮游动物为用装有网口流量计的浅水Ⅰ型浮游生物网自底至表垂直拖网采集再用显微计数和湿质量生物量法分析,浮游植物定量样品为采集表层水样1L于聚乙烯瓶加入5%福尔马林溶液固定用显微计数法分析, 叶绿素a为采集表层水样用 90%丙酮萃取分光光度法分析,水温和盐度分别采用温度计和 Orion130A盐度计现场测定, 氨氮用靛酚蓝分光光度法、亚硝酸盐用萘乙二胺分光光度法、硝酸盐用紫外分光光度法、活性硅酸盐用硅钼蓝分光光度法、活性磷酸盐用磷钼蓝分光光度法分析[3]。

图1 湛江湾采样站位的分布Fig.1 Distribution of sampling stations in Zhanjiang Bay
1.2 统计方法
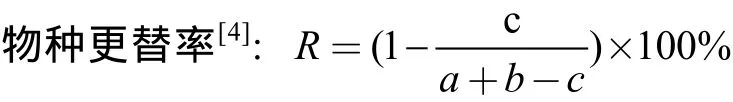
式中,a、b分别为相邻月份的物种数,c为相邻月份共同的物种数。

式中,ni为第i种的总个体数,N为所有物种的总个体数,fi为第i种在各站位出现的频率, 以Y>0.02作为优势种;S为样品中总种类数,Pi为第i种在全部采样中的比例(Pi=ni/N)。
2 结果
2.1 浮游动物种类组成及周年变化
此次调查共鉴定出浮游动物87种和29类浮游幼虫(图2), 共隶属于16大类群, 其中以桡足类(30种)、浮游幼虫和原生动物(23种)居多, 各占总种类数的25.86%、25.00%和 19.83%, 其他类群如糠虾类、十足类、毛颚类和水母类的种类数为4~9, 轮虫动物、枝角类、介形类、等足类、磷虾类、被囊类、线虫动物、涟虫类和端足类的种类数为1~2。浮游动物种类数以4月最多, 2、3月最少, 4~9月的总种类数均高于其他月份。浮游动物各类群的种数周年变化因类群不同而有差异。浮游幼虫的种类数以 4~9月居多, 10~12月和1~3月较少; 原生动物的种类数在12月及4~7月较多, 其他月份相对较少; 桡足类的种类数以1月最多, 2月和3月最少, 其他月份差别不大;水母类在6月份未有发现, 在4月和5月份也仅发现1种, 其他月份的种类数为 3~5; 十足类、糠虾类、毛颚类等大多数类群的种类数周年变化差异不大。
在整个调查期间均有出现的种类有4种(类), 分别为刺尾纺锤水蚤(Acartia spinicauda)、亨生莹虾(Lucifer hanseniv)、百陶箭虫(Sagitta bedloti)和桡足类无节幼虫(Copepodanauplii)。各相邻月份的共有种数为 18~33种, 物种更替率R为 37.25%~73.61%, 10~11月的物种更替率最低, 而3~4月的物种更替率最高, 1~2月的物种更替率也相对较高(68.42%, 表 1)。3月水温仍较低, 浮游动物种类及数量处于最低水平; 4月水温迅速升高, 海洋动物开始繁殖,浮游幼体类群达到全年最多, 并在5月其丰度达到最大, 这说明湛江湾海洋动物在4月和5月开始大量繁殖。

图2 浮游动物种类组成的周年变化Fig.2 Annual variation of species composition of zooplankton
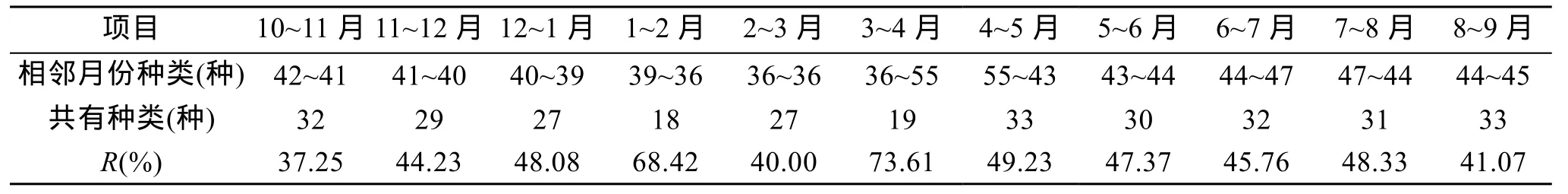
表1 月间浮游动物物种更替率Tab.1 Alternating rate of zooplankton species between two adjacent months
2.2 浮游动物主要类群及周年变化
2.2.1 浮游幼虫
年均丰度为220.51个/m3, 占浮游动物年均总丰度的36.24%, 居首位。浮游幼虫丰度在4~7月明显较高, 丰度为344.62~647.52个/m3, 其中以5月份最高,主要密集分布于 S1(1666.67个/m3)和 S2(833.33个/m3),该月浮游幼虫优势种较多, 有鱼卵、桡足类无节幼虫、桡足幼体和短尾类 溞状幼虫; 4月份浮游幼虫类群最多, 达20类, 丰度也仅次于5月, 为498.56个/m3,主要密集分布于S5(1203.70个/m3), S2浮游幼虫较少,其丰度仅有 73.53个/m3, 此月份的浮游幼虫优势种有 4种, 仅鱼卵优势种就占了该月浮游幼虫丰度的44.82%。浮游幼虫丰度低值期主要出现在1~3月, 丰度均不超过40.00个/m3, 其中 2月份无浮游幼虫优势种, 1月份仅桡足类无节幼虫为优势种, 3月份有桡足类无节幼虫和鱼卵 2种优势种。浮游幼虫在调查期间均有出现, 并在暖水季节(4~9月)种类多、数量大, 成为浮游动物群落的优势类群。总体上, 浮游幼虫丰度周年变化呈现单周期性, 以5月最高, 2月最低。
2.2.2 桡足类
年均丰度为 177.84个/m3, 占浮游动物年均总丰度的29.22%, 仅次于浮游幼虫。桡足类丰度以2月份最高, 达997.86个/m3, 主要密集分布于S2(2385.19个/m3)和S3(1225.00个/m3), 其中以近岸暖水类群的太平洋纺锤水蚤和河口低盐类群的瘦尾胸刺水蚤为主, 占该月桡足类丰度的75.21%和21.05%; 次高出现在12月份, 桡足类丰度为 213.75个/m3, 主要分布在S5(572.92个/m3)和S1、S2, 优势种为河口低盐类群的刺尾纺锤水蚤; 此外, 桡足类丰度超过100个/m3的月份还有10月、3月、5~6月及9月, 各月份优势种均为近岸暖水种和河口低盐种; 桡足类丰度的最低值出现在8月, 为27.93个/m3, 7~8月均无桡足类优势种。显然, 桡足类丰度周年变化大体呈现单周期性,以2月最高, 8月最低。本次调查结果表明, 湛江湾浮游桡足类主要以近岸暖水种为主, 河口低盐种也不少, 且全年均有出现; 此外, 湛江湾桡足类还出现少量近岸暖温种和外海暖水种, 群落结构较复杂,属于亚热带沿岸群落。
2.2.3 原生动物
年均丰度为158.31个/m3, 占浮游动物年均总丰度的26.23%, 是本海域浮游动物群落的重要类群。原生动物丰度最高峰出现在 12月份, 达 834.97个/m3,主要密集分布于S1(1060.61个/m3)、S2(2107.84个/m3)和 S5(937.50个/m3), 优势种有钟虫、圆形类铃虫、根状拟铃虫和妥肯丁拟铃虫, 仅钟虫就占了该月原生动物丰度的59.90%。5月和6月原生动物再次出现小高峰, 丰度分别为281.49个/m3和339.98个/m3,主要密集分布于S3和S4, 诺氏麻铃虫、根状拟铃虫、妥肯丁拟铃虫和钟虫再度成为优势种。原生动物丰度在其他月份较低, 均不超过80个/m3, 尤其在9月,仅为14.88个/m3, 且只分布在S3和S6。此外, 原生动物在1月和8月也分布不均匀, 1月份只分布在S4、S5和S6, 8月份只分布在S3、S4和S6。总之, 原生动物丰度周年变化大体呈现双周期性, 出现一大(12月)、一小(6月)两高峰期。
在调查期间, 湛江湾浮游动物丰度出现了3个高峰, 且分别由不同的浮游动物类群组成, 其中12月份的高峰主要由原生动物组成, 2月份的高峰主要由桡足类组成, 而5月份的高峰则主要由浮游幼虫组成, 3大类群共同主导湛江湾浮游动物群落结构(图3a)。站位浮游动物及主要类群丰度的时空分布见图3b。
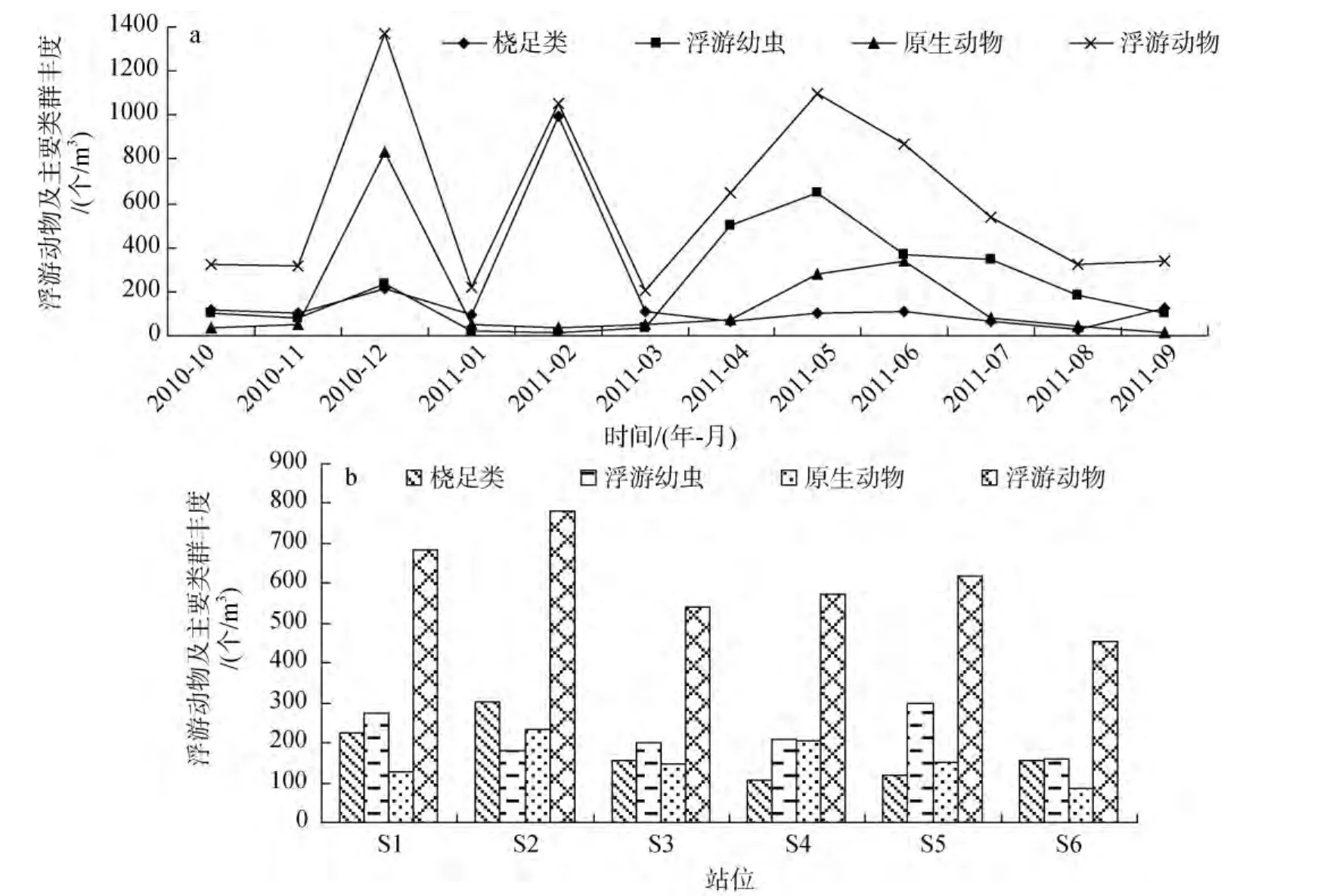
图3 浮游动物及主要类群丰度的时空分布Fig.3 Spatial and temporal distributions of primary groupabundance of zooplankton
2.3 浮游动物优势种的周年变化
浮游动物优势种共有22种(类), 其中浮游幼虫9类, 原生动物7种, 桡足类3种, 水母类、毛颚类、被囊类各1种。12月和4、5月优势种最多(8种), 2月最少, 仅2种。10~11月优势种均有原生动物、桡足类和浮游幼虫, 各类群优势度相差不大; 12月原生动物优势种类增多(4种), 尤以钟虫数量最大, 毛颚类的百陶箭虫数量也逐渐增多成为优势种, 并持续到1月; 1月桡足类的刺尾纺锤水蚤和瘦尾胸刺水蚤数量也继续增多, 成为优势度相对较高的优势种,而原生动物优势种类则急剧减少, 仅诺氏麻铃虫 1种; 2月太平洋纺锤水蚤和瘦尾胸刺水蚤大量繁殖,月均丰度达750.45个/m3和210.07个/m3, 优势度高达0.712和0.199, 桡足类是此月唯一的优势类群; 3月桡足类的数量有所减少, 但在浮游动物群落中依然占有主导地位, 而浮游幼虫类的鱼卵开始增多并成为优势种, 一直持续到6月并在5月数量达到最大; 4~6月桡足类的数量一再减少, 原生动物数量有所回升, 随着水温的升高, 阶段性浮游幼虫种类增多,数量增大, 并在 5月数量达到最大, 成为该时期浮游动物群落的一大重要类群; 7~9月浮游幼虫依然占有优势地位, 桡足类和原生动物优势种的种类和数量均较少, 而异体住囊虫、百陶箭虫和球型侧腕水母等大中型浮游动物数量激增, 成为该时期的优势种(表2)。
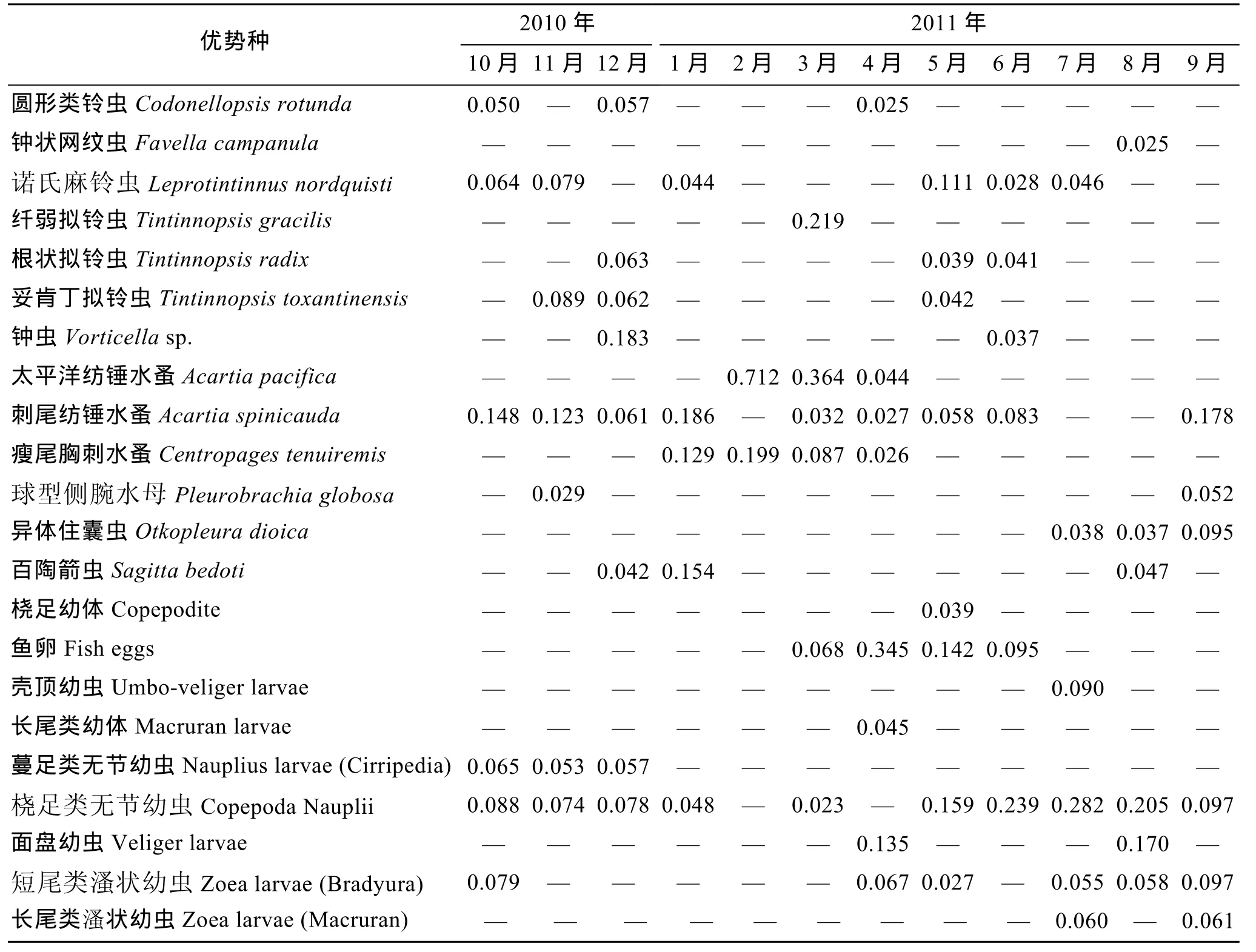
表2 浮游动物优势类群Tab.2 Dominant zooplankton species
2.4 浮游动物生物量的时空分布
湛江湾浮游动物湿质量生物量为 19.69~572.70 mg/m3, 年均值为146.14 mg/m3, 具有明显的月变化。2月浮游动物生物量最高, 达302.76 mg/m3,其次是8月和9月, 生物量分别为209.13 mg/m3和224.06 mg/m3, 10~12月、1月和4~5月的生物量差别不大, 为120.00~160.00 mg/m3, 6月和7月的生物量相对较低, 分别为82.66 mg/m3和88.43 mg/m3, 生物量最低是在3月, 仅为27.33 mg/m3(图4)。显然, 湛江湾浮游动物生物量的周年变化呈现一大一小高峰。各测站浮游动物生物量的平面分布也具有较大差异,年均值最低出现在S3, 仅为72.82 mg/m3; 次低是S4,年均值为123.31 mg/m3; S1和S2的年均值相差不大,分别为144.01 mg/m3和157.40 mg/m3; S5的年均值较高, 为171.71 mg/m3; 浮游动物生物量年均值最高出现在S6, 为207.61 mg/m3, S6各月的生物量均相对较高, 并在2月、4月、6月和7月中达到最大。不难看出, 该调查海域浮游动物生物量湾中部站位低于靠近湾内及湾外的站位。
2.5 浮游动物生物多样性分析
浮游动物物种多样性指数H'、均匀度J及丰富度d的年均值较低, 分别为2.64、0.54和3.32, 其中最低值明显出现在 2月, 各生物多样性指数分别低至 1.41、0.31和 2.29; 物种多样性指数H'在 5月最高(2.97), 均匀度J在 8、9月最高(0.60), 而丰富度d在4月最高(3.78)。除2月外, 其他月份的物种多样性指数H'、均匀度J及丰富度d都相差不大(图5)。
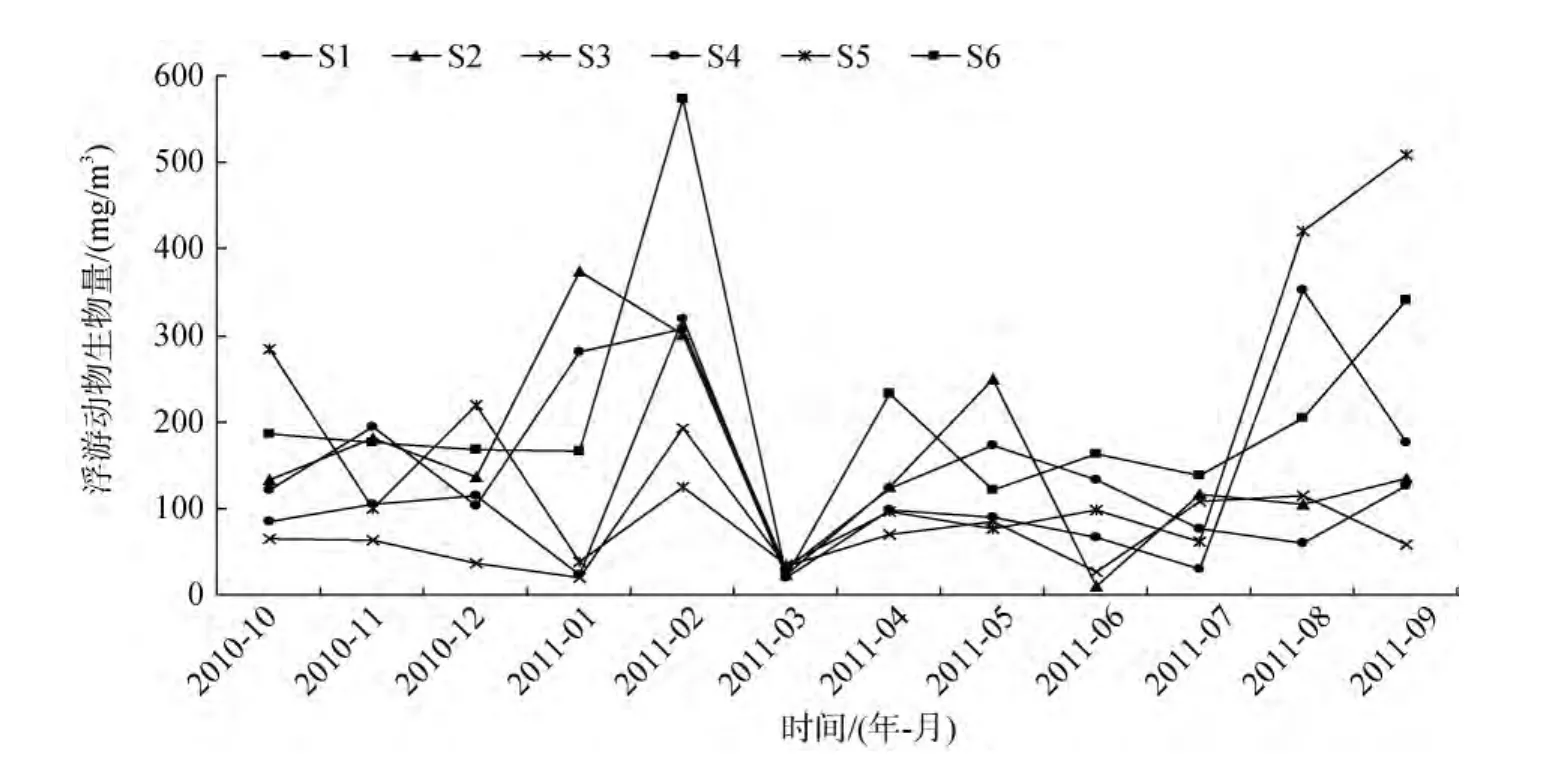
图4 浮游动物生物量的时空分布Fig.4 Spatial and temporal distributions of zooplankton biomasses

图5 湛江湾浮游动物生物多样性指数Fig.5 Diversityindexof zooplankton in Zhanjiang Bay
3 讨论
3.1 湛江湾浮游动物群落结构特征及与历史资料的比较
3.1.1 湛江湾浮游动物群落结构特征
本次调查检出的浮游动物种类较少, 所属类群较多, 达 16大类, 但浮游动物种类及数量主要集中在原生动物、桡足类和浮游幼虫3大类群里。12月原生动物丰度达到最大, 2月桡足类种类少但丰度最高, 4月浮游幼虫类群最多并在 5月丰度达到最大,在整个调查期间, 湛江湾浮游动物群落结构发生了较大变化, 1~2月及3~4月的物种更替率明显较高。
原生动物个体大部分小于200 μm, 属于微型浮游动物, 在海洋生态系统中是浮游植物的主要摄食者, 同时本身作为大中型浮游动物的食物, 在微食物环和后生动物之间起着重要的营养连接作用[6-7]。本次调查共发现原生动物23种, 全年均有分布, 其中种类较多的有拟铃虫属(11种)和类铃虫属(4种), 其丰度在12月占该月浮游动物丰度百分比的 61.00%, 明显在湛江湾浮游动物群落中占有重要地位。但由于在以往调查中常使用网眼孔径较大的浅水Ⅰ型浮游生物网,个体较小的微型浮游动物常常被过滤出网, 丰度被严重低估, 目前对湛江湾微型浮游动物的研究也尚未见有报道。本次调查所使用的也是浅水Ⅰ型浮游生物网,但原生动物种类和数量均不低, 而其实际值应远比本次监测值高, 可见在湛江湾海洋生态系统中微型浮游动物是个不可忽视的群体。
浮游幼虫种类和数量在1~3月很低, 而到4月开始迅速增多, 5月丰度最高, 6月和7月有所下降, 但丰度仍然较高, 4~7月明显为湛江湾海洋动物的繁盛时期。湛江湾浮游幼虫在整个调查期间均有出现, 并主要以底栖动物幼虫为主, 属阶段性浮游幼虫, 如多毛类幼虫、面盘幼虫、短尾类幼虫、长尾类幼虫、阿利马幼虫、异尾类幼虫、才女虫幼虫等, 反映了湛江湾底栖动物的生殖期很长, 这与湛江湾地处亚热带、终年水温较高的自然条件有关[8]。桡足类无节幼虫在调查初期丰度较低, 12月丰度明显回升, 1~3月丰度达到全年最低, 4月开始增长, 但丰度仍很低, 5月和6月繁殖迅速, 丰度达到全年最高, 7月丰度开始下降, 到9月时其丰度降至调查初期水平, 总体出现一大一小高峰, 呈月份双峰型变化。与 2009年[9]桡足类幼体丰度最高值出现在8月, 最低值出现在11月的结果不同, 而与多数亚热带海湾桡足类繁殖季节的变化趋势相似, 只是桡足类幼体丰度达到最大值的时间由夏季提前至春季, 丰度最低值依然是在冬季。
湛江湾浮游桡足类群落结构趋于小型化[9],此次调查的浮游桡足类优势种均为小型浮游动物,而其他浮游动物除球型侧腕水母、异体住囊虫和百陶箭虫为大中型浮游动物外, 大部分优势种如圆形类铃虫、诺氏麻铃虫、根状拟铃虫、妥肯丁拟铃虫、钟虫、短尾类 溞状幼虫、桡足类无节幼虫、蔓足类无节幼虫、面盘幼虫等均为微型或小型浮游动物,湛江湾浮游动物群落结构整体也趋于小型化。这种小型化趋势可能与浮游植物群落结构也趋于小型化有关[9]。已有研究表明, 水体富营养化的加重和营养盐结构的变化已使得近岸海域浮游植物群落构成趋于小型化[10-11]并通过食物链的传递效应, 进一步引起主要摄食者浮游动物的小型化。因此, 湛江湾浮游植物群落结构趋于小型化可能是引起浮游动物群落结构也趋于小型化的一个重要因素。也有研究表明, 当食浮游动物的鱼类的丰度较大时, 捕食作用增强, 大型浮游动物被首先捕食, 从而导致浮游动物小型化[12]。浮游动物小型化也会驱使鱼类的小型化, 而现代湛江湾渔业资源结构也确实趋于小型化[9], 当然, 渔业资源结构的小型化还与人类过度捕捞有重大关系。
3.1.2 湛江湾浮游动物群落与历史资料的比较
本次调查与Wang等[13]、张才学等[9]的调查结果有一定差异, 本次调查发现浮游动物种类数相对较少, 尤其是桡足类, 但浮游幼体和原生动物种类有所增加。这可能与调查站位设置不同有关, Wang等共布设了11个调查站位且相对靠近湾口, 张才学等布设的调查站位达28个, 从湾口外直至狭窄内湾深处均有分布, 靠近湾口处水体交换能力大, 浮游动物种类多, 群落多样性较高。而本次调查只布设了6个站位且偏向狭窄的内湾, 靠近工业区与生活区,水体受污染程度较湾口严重, 更适合耐污种类(如钟虫)的生长, 且内湾大片的网箱养殖和牡蛎养殖也会影响浮游动物的生长[14]。此外, 本次采样时间为傍晚过后, 湛江湾浮游动物是否发生昼夜垂直迁移, 且其结果是否与桡足类种数减少及原生动物种数增多有关, 目前均无定论, 其结果有待进一步研究。
与众多海湾相比, 湛江湾浮游桡足类依然为种类最多的一大类群, 但其比例明显下降, 而原生动物和浮游幼体比例上升, 总种类数略偏小。湛江湾浮游动物丰度和生物量均比柘林湾和珠江口低而比三亚湾高, 但其丰度比大亚湾和深圳湾高而生物量低,这主要是因为大亚湾和深圳湾的优势种出现了较多大型浮游动物(水母类、毛颚动物、被囊动物), 而湛江湾浮游动物优势种则以微型及小型浮游动物为主;湛江湾浮游动物生物量仅高于纬度最低的三亚湾, 而低于其他海湾, 总体符合生物量从高纬度往低纬度递减的一般规律。相比之下, 湛江湾浮游动物物种多样性指数及均匀度均低于Wang等[13]的调查结果, 群落结构变化明显, 群落稳定性相对较差(表3)。
3.2 湛江湾环境因子对浮游动物周年变化的影响
湛江湾浮游动物丰度在12月、2月和5月出现了3个高峰, 而浮游动物生物量仅在2月和9月出现高峰, 这种高丰度而低生物量或高生物量而低丰度的现象与种类组成密切相关。个体较小的原生动物和浮游幼虫在12月和5月均占有绝对优势, 分别占各总丰度的73.42%和67.85%, 而2月则以个体相对较大的桡足类为主(占92.87%), 9月份更是以较大个体的球型侧腕水母、异体住囊虫及刺尾纺锤水蚤为优势种, 共占总丰度的37.96%, 所以浮游动物在12月和5月有丰度高而生物量低、9月有生物量高而丰度低的现象出现。
浮游动物的生长繁殖与水温、盐度、食物、摄食压力、水系、海流等影响因子密切相关, 但在不同时期, 这些影响因子的作用也不尽相同。10~11月水温适宜, 食物也相对充足, 浮游动物丰度和生物量较高; 12月降雨量减少, 湾内外水体交换量小, 湾内营养盐居全年较高水平, 污染物质积累严重, 耐污种类明显大量繁殖, 导致湛江湾浮游动物丰度出现一个高峰; 1月主要受水温(15.6℃)及食物(浮游植物及叶绿素 a均处全年最低水平)限制, 浮游动物丰度很低, 但群落以个体较大的刺尾纺锤水蚤、瘦尾胸刺水蚤及百陶箭虫为主要优势种, 所以生物量较高; 2月浮游动物群落结构发生了巨大变化, 浮游动物种类降至最少, 但数量剧增, 生物量一度达到全年最高, 以太平洋纺锤水蚤和瘦尾胸刺水蚤为绝对优势种, 丰度高达 960.51个/m3, 占浮游动物总丰度的91.19%。在水温较低及浮游植物匮乏的情况下, 浮游动物还能拥有如此高的数量, 究其原因主要有(1)太平洋纺锤水蚤和瘦尾胸刺水蚤为广布种, 从渤海到南海均可采到, 也是渤、黄海沿岸的常见优势种[18],能适应较低温度, 在厦门港[19-20]及本次调查也主要出现在冬春季节; (2)太平洋纺锤水蚤和瘦尾胸刺水蚤在春末夏初会产生大量的滞育卵, 待冬季环境条件适宜时, 滞育卵逐渐孵化发育成成体并能大量产生能马上孵化的正常卵, 此外, 冬季浮游动物种类数急剧下降, 使得海区浮游植物相对丰富起来, 太平洋纺锤水蚤和瘦尾胸刺水蚤在该海区占据了绝对的优势得以充分利用饵料扩大种群数量, 也就形成了产卵的最高峰, 正常卵产卵率达到最大值, 因而在冬春季这两种群能迅速繁衍[19-20], 这正解析了太平洋纺锤水蚤在1月仅出现在S6(丰度仅4.73个/m3),而到 2月时整个调查海域均有分布, 其丰度平均高达750.45个/m3; (3)太平洋纺锤水蚤和瘦尾胸刺水蚤均是以滤食性为主的杂食性桡足类, 当浮游植物贫乏时, 它们可以通过对动物性食物的摄食来维持其生存所需的代谢消耗, 如丰年虫无节幼虫、桡足类幼体、碎屑、鱼卵和仔鱼等[21]。虽 2月浮游幼虫丰度的调查值仅为 13.51个/m3, 但因采集网具网眼孔径较大, 其实际值应远高于此值。浮游动物的剧增会大量摄取饵料生物, 并在低温条件下饵料生物很难在短时间内得到补充, 所以在 3月太平洋纺锤水蚤和瘦尾胸刺水蚤数量大大减少, 浮游动物丰度和生物量降至全年最低。随着水温的升高, 4月海洋动物开始繁殖, 各种阶段性幼虫不断出现, 浮游动物种类急剧增多; 5月浮游植物出现爆发式繁殖并最终形成局部角毛藻赤潮, 给浮游幼体及其他浮游动物提供了丰富饵料, 使浮游动物丰度再次出现高峰, 其中浮游幼体丰度占浮游动物丰度的58.84%。显然, 水温是湛江湾海洋动物发育的主导因子, 而食物供应则是其存活的主导因子。除环境变化影响外, 浮游动物强大的摄食压力也会加速浮游植物赤潮的消亡, 而浮游植物的减少反过来也会限制浮游动物的大量繁殖, 6、7月正属于此种情况, 浮游植物和浮游动物数量均不断减少。8、9月水温仍继续升高, 暖水性的大中型肉食性浮游动物(水母类、毛颚类及有尾类等)数量增多, 对小型浮游动物的摄食压力增大, 从而降低了小型浮游动物的种群密度。湛江湾2月份的盐度最高, 10月份最低, 但各月份间盐度变化不明显(图 6)。这与湛江港湾水较深海域较宽阔有关, 广大水体能保持盐度终年较稳定, 故其对浮游动物周年变化影响不显著。浮游植物丰度、叶绿素 a浓度、浮游动物丰度及生物量的月均值的周年变化见图7。

表3 湛江湾浮游动物群落与历史资料的比较Tab.3 Comparison of community structure of zooplankton between Zhanjiang Bay and that of other bays
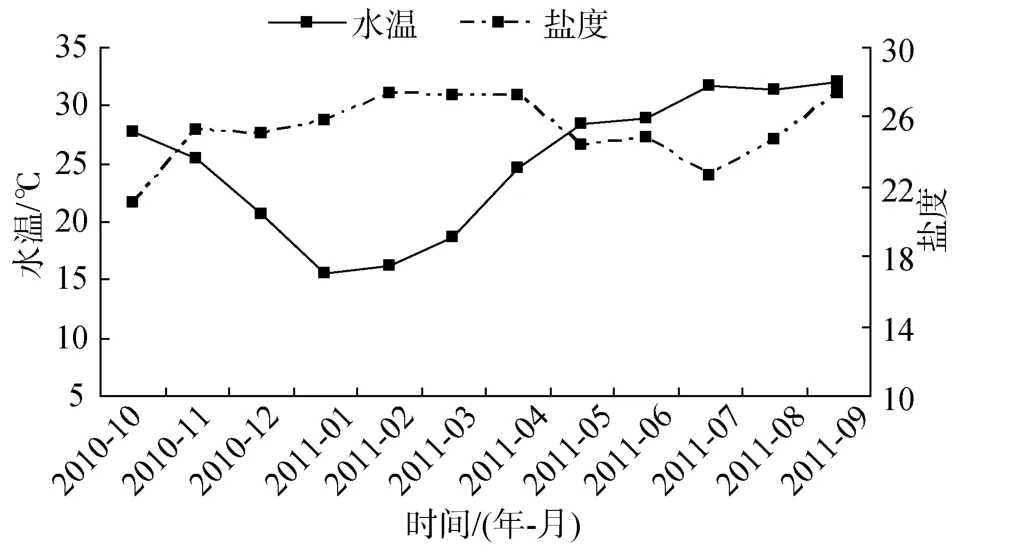
图6 水温和盐度各站月均值的周年变化Fig.6 Annual variation of monthly averages of water temperature and salinity

图7 浮游植物丰度、叶绿素a浓度、浮游动物丰度及生物量的月均值的周年变化Fig.7 Annual variation of monthly averages of phytoplankton richness, chlorophyll a, and richness and biomass of zooplankton
[1] 张才学, 周凯, 孙省利, 等. 深圳湾浮游动物的群落结构及季节变化[J]. 生态环境学报, 2010, 19(11): 2686-2692.
[2] 罗鸣, 苗素英, 于红兵, 等. 春末海南万宁海域浮游动物群落结构研究[J]. 海洋科学, 2013, 37(11): 79-84.
[3] 国家海洋局. 海洋监测规范. 第4部分: 海水分析[s].北京: 中国标准出版社, 2007: 57-121.
[4] 徐佳奕, 徐兆礼. 三沙湾浮游动物生态类群演替特征[J]. 生态学报, 2013, 33(5): 1413-1424.
[5] 沈国英, 黄凌风, 郭丰, 等. 海洋生态学[M]. 第三版.北京: 科学出版社, 2010: 89-104.
[6] 张武昌, 王荣. 渤海微型浮游动物及其对浮游植物的摄食压力[J]. 海洋与湖沼, 2000, 34(3): 252-258.
[7] 郑丽平, 相卫国, 黄邦钦. 冬季南海北部海域微型浮游动物及其对浮游植物摄食压力研究[J]. 台湾海峡, 2012, 31(1): 72-78.
[8] 尹健强, 张谷贤, 谭烨辉, 等. 三亚湾浮游动物的种类组成与数量分布[J]. 热带海洋学报, 2004, 23(5): 1-9.
[9] 张才学, 龚玉艳, 王学锋, 等. 湛江港湾浮游桡足类群落结构的季节变化和影响因素[J]. 生态学报, 2011, 31(23): 7086-7096.
[10] Pan Y L, Rao D V S.Impacts of domestic sewage effluent on Phytoplankton from Bedford Basin, eastern Canada[J].Marine Pollution Bulletin, 1997, 34(12): 1001-1005.
[11] Dippner J W.Competition between different groups of phytoplankton for nutrients in the Southern North Sea[J]. Journal of Marine Systems, 1998, 14(1/2): 181-198.
[12] Arcifa M S, Northcote T G, Frochlich O. Fish-zooplankton interactions and their effects on water quality of a tropical Brazilian reservoir[J]. Hydrobiologia, 1986, 139: 49-58.
[13] Wang X F, Zhang C X, Gong Y Y, et al. Zooplankton community structure and seasonal patterns in the Zhanjiang harbor waters, China[J]. ISWREP 2011(2011 International Symposium on Water Resource and Environmental protection): 1943-1946.
[14] 刘中华. 大亚湾澳头养殖海域浮游动物群落结构特征[D].广州: 暨南大学, 2006: 7-49.
[15] 黄长江, 陈善文, 何歆, 等. 2001—2002年粤东柘林湾浮游动物的生态学研究[J]. 海洋与湖沼, 2003, 34(2): 117-130.
[16] 李开枝, 尹健强, 黄良民, 等. 珠江口浮游动物的群落动态及数量变化[J]. 热带海洋学报, 2005, 24(5): 60-68.
[17] 方良, 李纯厚, 杜飞雁, 等. 大亚湾海域浮游动物生态特征[J]. 生态学报, 2010, 30(11): 2981-2991.
[18] 郑重, 李松, 李少菁. 我国海洋浮游桡足类的种类组成和地理分布[J]. 厦门大学学报, 1978, 2: 51-62.
[19] 王桂忠, 李少菁, 陈峰, 等. 厦门港海区两种常见纺锤水蚤卵的生物学和季节演替[J]. 厦门大学学报, 1994, 33(增刊): 135-140.
[20] 吴荔生. 厦门海区瘦尾胸刺水蚤卵滞育的生理生态学研究[D]. 厦门: 厦门大学, 2003: 32-71.
[21] 高亚辉, 李松. 瘦尾胸刺水蚤摄食率的观察实验[J]. 热带海洋, 1990, 9(3): 59-65.
(本文编辑: 梁德海)
Structural characteristics of zooplankton populations and their annual changes in Zhanjiang Bay
GONG Yu-yan1,2, ZHANG Cai-xue2, CHEN Zuo-zhi1, YE Li-di2, CHEN Wei-jie2, WANG Wei-rong2, SUN Xing-li2
(1. Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 2. Monitoring Center of Ocean Resource and Environment, Guangdong Ocean University, Zhanjiang 524088, China)
Mar., 18, 2015
zooplankton; community structure; annual change; copepoda; protozoa; pelagic larva; ZhanjiangBay
Zooplankton populationsin Zhanjiang Bay were surveyed from October 2010 to September 2011 to investigate theirannual population changes and the influencing factors. A total of 87 species of zooplanktons and 29 varieties of planktonic larvae, belonging to 16 large groups, were detected. The population structures primarily consisted of copepods (30 species), pelagic larvae (29 groups, including fish larvae), and protozoa (23 species), which accounted for 25.86%, 25.00%, and 19.83% of the total population, respectively. The number of zooplankton species was highest in April and lowest in February and March. Zooplankton species richness during April–September washigher than that in other months. Planktonic larva population primarily consisted of zoobenthos. The species richnesswashighest in April, and the highest abundance was observed in May. April–July was the flourishing period for marine animals in Zhanjiang Bay. A total of 22 predominant zooplankton species, , consisting of 9 species of larvae, 7 species of Protozoa, 3 species of Copepoda, and 1 species of Medusa, Chaetognatha, and-Tunicata, were identified. The numbers of predominant species were highest in December, April, and May (8 species) and lowest in February (2 species). There were no full-year predominant species. The population structures obviously exhibited a tendency toward miniaturization. There were 18–33 species during various contiguous months. The species replacement rates (R) were in the range of 37.25%–73.61%. The annual mean values of Shannon–Wiener indexH', Pielou indexJ, and Margalef indexdwere, 2.64, 0.54, and 3.32, respectively, all of which were relatively low. During the surveyed period, three peaks of zooplankton abundances occurred, each of which consisted of different groups of zooplanktons. Among these abundance peaks, the peak that occurred in December primarily consisted of Protozoa, the peak that occurred in February primarily consisted of Copepoda, and the abundance peak that occurred in May primarily consisted of larvae. These three groups of species together dominated the zooplankton population structures in ZhanjiangBay. Thezooplankton biomass in February and September was much higher than thatin other months, resulting in twopeaks in the annual changes of zooplankton biomass. The annual changes of zooplankton populations in Zhanjiang Bay were influenced by water temperature, food structure, and feeding pressure.
Q178.53
A
1000-3096(2015)12-0046-010
10.11759/hykx20141027001
2015-05-16;
2015-08-09
国家海洋公益性行业科研专项(200905005-05, 201105008-E);公益性行业(农业)科研专项(201403008)和农业部财政重大专项(NFZX2013)
龚玉艳(1985-)女, 研究实习员, 硕士, 主要从事海洋浮游生物及生态研究, E-mail: yuyangong@163.com; 孙省利, 通信作者,教授, E-mail: xinglsun@126.com
