运用热带爪蟾胚胎检测杭州稻田的生态毒性
2015-03-07应梦娇李星翰瞿巧文钱姣娟祝彩丽林苏杰王学漫陶珊珊尹晓辉
应梦娇,李星翰,瞿巧文,钱姣娟,祝彩丽,林苏杰,王学漫,陶珊珊,尹晓辉∗
(1.浙江农林大学农业与食品科学学院,浙江杭州 310011;2.庆元县农业局,浙江庆元 323000)
运用热带爪蟾胚胎检测杭州稻田的生态毒性
应梦娇1,李星翰1,瞿巧文2,钱姣娟1,祝彩丽1,林苏杰1,王学漫1,陶珊珊1,尹晓辉1∗
(1.浙江农林大学农业与食品科学学院,浙江杭州 310011;2.庆元县农业局,浙江庆元 323000)
浙江省是农化产品生产大省,其带来一定经济利益的同时,也带来了许多负面影响。稻田底泥对农药等大多数污染物有很强的吸附作用,会严重影响稻田生态系统的生物多样性。检测和分析水稻田底泥农药等污染物的生态毒性对稻田生态评价十分重要。2014年3月下旬到4月下旬,在杭州余杭南湖区、临安官塘、余杭瓶窑、萧山浦阳先后采集底泥样品和水样,将热带爪蟾胚胎(NF10⁃NF11)暴露于1∶4底泥提取液和水样中48 h,观测其发育状况。不同采样点对热带爪蟾胚胎均有不同程度的致畸作用,包括尾部弯曲、肠道突出和腹部水肿等。其中,萧山浦阳地区X1采样点底泥提取液处理下热带爪蟾的畸形率最高达19.3%(P<0.05),X3采样点水样处理下热带爪蟾的畸形率最高达30.6%(P<0.05)。由此可见,萧山浦阳地区稻田的底泥和水样的毒性高于临安官塘、余杭南湖区、余杭瓶窑。研究表明,杭州稻田底泥对热带爪蟾胚胎的发育均有不同程度的影响,具有明显的生态毒性。
生态毒性;热带爪蟾胚胎;稻田底泥
水稻是中国的重要粮食作物,尤其是南方地区。浙江省的主要粮食作物是水稻,种植历史悠久。且浙江省是农药生产大省,长期以来产量居全国第二[1]。据统计,2011年浙江省农药总产量为42.9 t,其中除草剂占70.8%,杀虫剂占18.8%,杀菌剂占9.5%。近年来,随着工农业的逐渐发展,越来越多的污染物进入水稻田。在污染的条件下,稻田中水生生物生存适应性降低,稻田生态系统结构和功能严重退化甚至丧失[2]。而稻田底泥的生态环境好坏对水稻的生长、发育有着十分重要的作用。
两栖动物是农田、湿地和林业生态系统中的一个重要组成部分,各种污染物不仅毒害两栖动物,而且造成其种群严重衰退,这已是不争的事实[3-6]。两栖动物胚胎和幼年时期是动物发育的一个重要敏感期,该时期对外源性污染物的吸收和积累可能会严重影响到胚胎发育和器官形成,导致身体畸形甚至死亡等不可逆转的伤害[7]。热带爪蟾是两栖动物中新的模式生物,其产卵量大,体外受精、体外发育生长迅速、性成熟周期短,而且有整个胚胎发育过程均可观察,生命力强等特点,已经广泛应用于胚胎发育、功能基因组学和人类遗传疾病研究和动物疾病模型的建立[8-9]。爪蟾胚胎致畸(FETAX)是一种运用爪蟾胚胎检测化合物发育毒性的标准方法,通过存活率、畸形率和生长抑制率等指标来表征化合物的毒性强弱[10]。
余杭、萧山、临安位于杭州市周边,是杭州地区重要的水稻种植基地。该地区的水稻田大量施用农药和化肥,化肥包括氮肥、磷肥,农药以除草剂骠马、乙草胺和草甘膦等为主,杀菌剂有多菌灵和稻瘟净等。因此,水稻田底泥中残留的各种农药,具有杭州水稻田的典型特征。除常规理化指标外,对水稻底泥进行生态毒性检测尤为重要,本研究运用热带爪蟾胚胎检测稻田底泥的生态毒性,为保护生物多样性和水稻适宜生长的环境提供科学依据。
1 材料和方法
1.1 材料
热带爪蟾,由实验室自养,取NF10⁃11阶段且发育正常的胚胎用于试验[11]。
稻田共采样2次,采样时间为2014年4-10月,利用TATO天泰正合MM9手持GPS定位仪定位,遵循Z字形5点采样法的原则,在杭州地区水稻种植基地共设置采样地4个,采样点20个,进行底泥和水样的采集,然后用棕色瓶分装并贴好标签,-80℃保存待用。采集过程中对采样点的常规理化数据(温度、pH值、溶解氧、氨、电导率)进行测量。
具体采样地点,余杭南湖区水稻田地理坐标为30°15′51″N,119°56′11″E;余杭瓶窑水稻田地理坐标30°22′08″N,119°58′48″E;临安官塘水稻田地理坐标30°15′46″N,119°43′26″E;萧山浦阳水稻田地理坐标29°59′23″N,120°15′04″E。
1.2 方法
热带爪蟾胚胎致畸试验,挑选实验室养殖的性成熟热带爪蟾15对,采用人工注射绒毛膜促性腺激素(HCG)的方法诱导产卵。每对热带爪蟾各注射2次HCG,待成蛙抱对产卵结束后收集受精卵,挑选出达到NF10⁃11阶段且发育正常的胚胎进行试验。
底泥的处理采用水溶剂提取法,将采集到的底泥与蒸馏水按照1∶4的体积比混合后装入250 mL的塑料瓶中,密封于振荡机上振荡24 h,条件控制为100 r·min-1,22℃,然后静置24 h,提取上清液待用[12]。
对照组和各试验组均设3个平行组,对照组为曝过气的自来水,试验组为稻田水样和底泥提取液。每个平行组放20只正常胚胎,并在25℃多功能培养箱内进行暴露试验,24 h对照组和各试验组重新换溶液,记录孵化个数,并将未孵化的胚胎挑出。统计48 h内胚胎畸形率,并对畸形胚胎进行显微拍照,有研究显示外源化合物对热带爪蟾胚胎48 h后畸形率较高[13]。
将存活胚胎用100 mg·L-1 MS⁃222麻醉处理后固定于4%的甲醛溶液中,取出经固定的胚胎,在Nikon解剖镜下观察胚胎的发育状况。用NikonDS⁃SM型显微照相系统进行拍照,并计算孵化率、存活率、体长和畸形率。孵化率为24 h后孵化胚胎个数所占最初放入受精卵个数百分比;存活率为48 h后存活胚胎个数所占孵化出的个数百分比;体长为胚胎头部至尾部的水平距离;畸形率为48 h后胚胎畸形个数所占存活个数百分比。通过胚胎暴露试验观测和分析热带爪蟾胚胎的表观畸形类型及表型特征变化,综合评价稻田底泥和水样的被农药污染程度。
1.3 数据统计
用SPSS 16.0进行数据的统计分析。以每孔中的胚胎为一个平行样,数据以平均值±标准差(SD)表示,n=3。用Tukey⁃test进行分析。
2 结果和分析
2.1 畸形现象
畸形现象如图1所示,主要为脊索弯曲、泄殖腔突出、腹部水肿、色素减少和尾巴变短,其中以尾巴缩短和泄殖腔突出最为普遍。
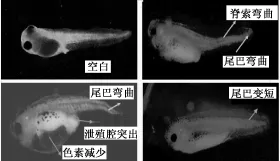
图1 稻田底泥提取液对热带爪蟾胚胎的致畸效应
2.2 同一地区不同地点的样品
2.2.1 临安官塘
如表1所示,底泥提取液的孵化率和存活率在各个采样点差异不显著,G1点的畸形率与其他采样点差异显著;G4,G5采样点的水样存活率与其他样点差异显著。与清水对照相比,G4点底泥样品处理组孵化率略低,为73.3%,但差异不显著;G5点的水样的检测存活率只有51.0%,差异显著,孵化率为98.3%,差异不显著;G4点的底泥提取液的检测畸形率高达11.9%,差异显著;G2点和G3点的水样的检测畸形率分别达到7.4%和6.7%,差异显著。
2.2.2 余杭南湖
如表2所示,除Y5点底泥提取液和水样的存活率与其他样点的存活率差异显著,其他各采样点之间的孵化率、存活率和畸形率的差异不显著。与清水对照相比较,Y4点的底泥提取液和水样的检测孵化率分别为49.3%和68.5%,差异均不显著;Y3点的底泥提取液的检测存活率为39.7%,差异显著,水样的检测存活率为65.6%,差异不显著;Y4点的底泥提取液的检测畸形率为9.7%,差异显著,水样的检测畸形率为4.2%,差异不显著(表2)。
2.2.3 余杭瓶窑
如表3所示,各个采样点的底泥提取液和水样的孵化率和存活率差异不显著,各采样点之间水样的畸形率差异显著。L2和L4点底泥提取液的畸形率分别为12.9%和14.0%,与清水对照比较差异显著;L2和L5点的水样的检测畸形率分别为11.8%和17.6%,与清水对照比较差异显著。

表1 临安官塘5个样品对热带爪蟾胚胎的影响
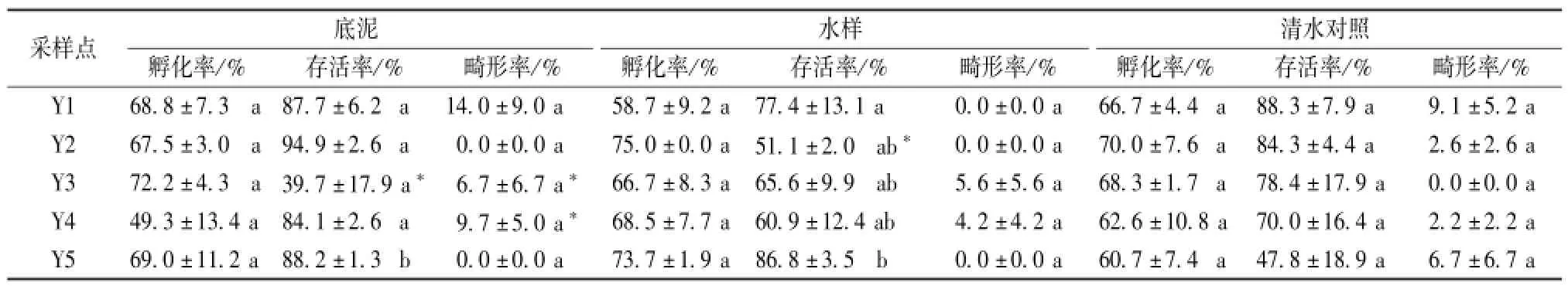
表2 余杭南湖区5个样品对热带爪蟾胚胎的影响
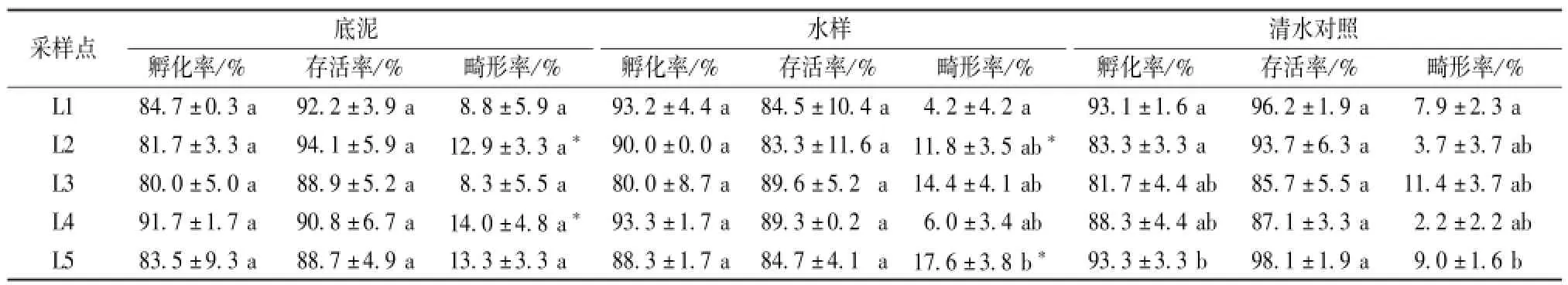
表3 余杭瓶窑5个样品对热带爪蟾胚胎的影响
2.2.4 萧山浦阳
如表4所示,从孵化率分析,X1点的水样的检测孵化率有66.7%,与清水对照比较差异显著。从畸形率分析,X1,X2,X4和X5点的底泥检测畸形率分别为19.3%,18.7%,4.2%和10.0%,与清水对照比较差异显著。X3点的水样的检测畸形率高达30.6%,与清水对照比较差异显著。
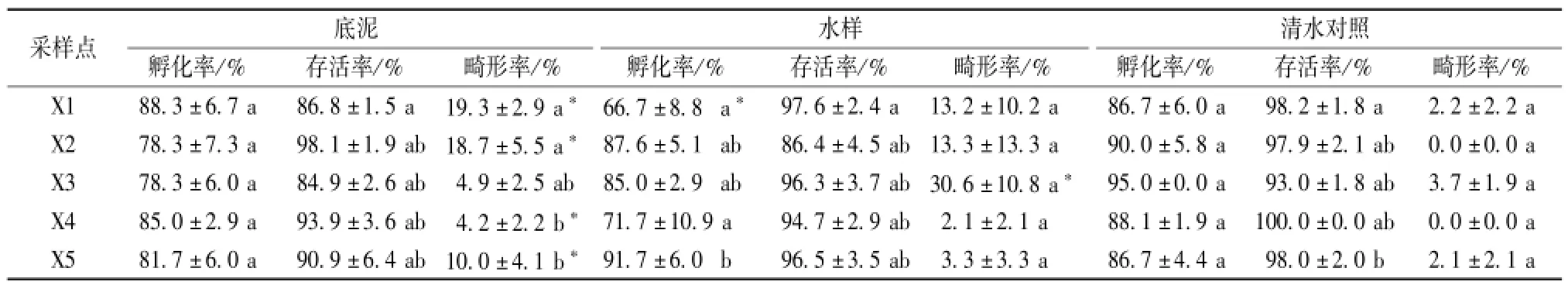
表4 萧山浦阳5个样品对热带爪蟾胚胎的影响
2.3 不同地点底泥、水样和清水的比较
2.3.1 胚胎孵化率
由图2可知,临安官塘、余杭南湖区、余杭瓶窑、萧山浦阳4个地区的底泥、水样对热带爪蟾的孵化率均无显著影响。
2.3.2 胚胎存活率
由图3可知,临安官塘、余杭南湖、余杭瓶窑、萧山浦阳4个地区,除了余杭南湖区的底泥样品、水样与清水对照无显著差异,其他3个地区的底泥、水样与清水对照相比,对热带爪蟾的存活率均有显著的影响。
水样处理的热带爪蟾胚胎的存活率均显著低于底泥提取液的胚胎存活率(除了萧山浦阳地区略有差异)。

图2 对热带爪蟾胚胎孵化率的影响

图3 对热带爪蟾胚胎存活率的影响
2.3.3 胚胎畸形率
由图4可知,临安官塘、余杭南湖区、余杭瓶窑、萧山浦阳4个地区之间相比,各采样点的底泥和水样均对热带爪蟾胚胎致畸作用有显著差异,整体底泥提取液处理的热带爪蟾胚胎的畸形率高于水样处理的(临安官塘和萧山浦阳地区的样品除外)。其中,萧山浦阳地区的底泥和水样对热带爪蟾的畸形率与对照相比差异显著。

图4 对热带爪蟾胚胎畸形率的影响
3 讨论
文献表明斑马鱼、两栖类动物的早期胚胎对农药有很强的敏感度,并已广泛应用于致畸研究[14-15]。热带爪蟾作为一种新的模式生物,应用于水质的监测尚在起步阶段。但其经济成本低,效果明显,已逐渐成为评价环境样品毒性的生物[16]。稻田底泥和水样中,由于常年积累的农药和其他污染物,对热带爪蟾胚胎有明显的致死、致畸效果,其畸形表型可作为研究人类先天畸形的重要指标[17]。本研究4个地区的底泥提取液和水样对热带爪蟾胚胎的孵化率均无显著影响。原因可能有:(1)样品不含有影响孵化的因子;(2)对于热带爪蟾整个生命史来说,暴露时间相对较短,显示不出损伤效应;(3)胚胎受精卵膜比较坚韧,稻田残留农药或其他有毒物质不能进入卵壳内[18-19]。因此,热带爪蟾胚胎的孵化率在本研究中不适合作为检测稻田污染物的生态毒性指标。
本研究采样时间在3-4月,正值大量使用的农药为除草剂。杭州地区稻田除草剂主要使用乙草胺、精恶唑禾草灵和丁草胺等。有研究显示,稻田除草剂乙草胺和丁草胺从地表水、地下水,甚至饮用水中频繁地被检测出来[20-21]。本研究杭州地区的不同采样点对热带爪蟾胚胎均有不同程度的致畸,其中萧山浦阳地区X1采样点的底泥提取液的致畸率最高达19.3%(P<0.05),X3采样点的水样致畸率最高达30.6%(P<0.05)。也有研究显示,乙草胺可以加速两栖动物甲状腺激素(TH)的T3表达以及增加TRβ的mRNA水平上的表达,诱导前肢及尾部出现畸形等形态学上的改变[22-23]。另有研究表明,精恶唑禾草灵对土壤蚯蚓为微毒[24],但低剂量可诱导鲦红细胞微核及核异常的发生[25],影响脊椎动物的卵母细胞活力和生殖细胞的成熟[26]。此外,已有研究表明,不同的污染物导致热带爪蟾胚胎畸形现象也不一样,且某些污染物能导致爪蟾胚胎产生独特的畸形表型,如用环境浓度三丁基氯化锡(50~400 ng·L-1 TBTCL)对热带爪蟾胚胎进行24 h、36 h和48 h暴露处理能够导致胚胎眼睛异常、泄殖腔突出和鳍变窄等多种畸形现象[17]。随着对不同污染物致畸机制的深入研究,热带爪蟾胚胎的畸形表型可为污染物识别提供帮助[27]。因此,热带爪蟾胚胎的致畸率可以作为稻田水样和底泥污染物的生态毒性指标。
部分采样点的水样毒性明显高于底泥提取液,如萧山浦阳地区X3采样点的水样畸形率明显高于底泥提取液的畸形率,其分别为4.2%和30.6%。主要原因是该点施药时间短,还未沉积入稻田底泥,该药水溶性好,不易被底泥吸附。而萧山浦阳地区稻田样品的毒性显著高于其他地区,主要原因是稻田水样或者底泥被其他工业污染物污染。萧山农村地区不仅农药污染严重,而且工业污染严重。但总体来说,4个采样点的底泥提取液均可导致胚胎死亡或产生畸形现象,生长发育受到抑制,稻田底泥均有较强的毒性。与其他三地比较,萧山浦阳地区稻田底泥表现出较强的毒性,而且在检测中相对比较稳定,因此,萧山浦阳地区稻田底泥及水样对热带爪蟾胚胎毒性较大,且可能会影响到稻田生物的多样性,这有待于进一步研究。
4 小结
运用热带爪蟾胚胎检测杭州地区稻田底泥的生态毒性,结果表明杭州地区的水稻田底泥和水样对热带爪蟾胚胎的发育均有不同程度的毒性影响,与清水对照相比表现出畸形率显著增加。其中,萧山浦阳地区采样点的底泥和水样污染物整体毒性高于临安官塘、余杭瓶窑、余杭南湖区的水稻田样品的毒性。该研究为监测农田生态环境污染的生态毒性提供依据,为保护生物多样性和水稻适宜生长的环境奠定科学基础。
[1] 姜书凯.浙江省农药出产量又上新台阶[J].农药,1999,38(4):39.
[2] 钱嫦萍,陈振楼,王东启.城市河流黑臭的原因分析及生态危害[J].城市环境,2002,16(3):21-23.
[3] 李昕馨,宋玉芳,周启星,等.低剂量混合污染生态毒理与风险评价研究进展[J].应用生态学报,2006,17(7):1326-1333.
[4] Cassee F R,Groten J P,Bladeren P J,et al.Toxicological evaluation and risk assessment of chemical mixtures[J]. Critical Reviews in Toxicology,1998,28:73-101.
[5] 刘维屏,张颖.手性农药毒性评价进展[J].浙江大学学报:农业与生命科学版,2012,38(1):63-70.
[6] Lockhart D J,W inzeler E A.Genomics,gene expression and DNA arrays[J].Nature,2000,405:827-836.
[7] JofréM B,Antón R I,Caviedes⁃Vidal E.Lead and cadmium accumulation in anuran amphibians of a permanent water body in arid Midwestern Argentina[J].Environmental Science and Pollution Research,2012,19(7):2889-2897.
[8] Hellsten U,Harland R M,GilchristM J,et al.The genome of theWestern clawed frog Xenopus tropicalis[J].Science,2010,328(5978):633-636.
[9] Parker JM,Mikaelian I,Hahn N,etal.Clinical diagnosis and treatment of epidermal chytridiomycosis in African clawed frogs(Xenopus tropicalis)[J].Comparative Medicine,2002,52(3):265-268.
[10] Beiras R.Comparison of methods to obtain a liquid phase in marine sediment toxicity bioassayswith Paracentrotus lividus sea urchin embryos[J].Archives of Environmental Contamination and Toxicology,2002,42(1):23-28.
[11] American Society for Testing and Materials(ASTM).Standard guide for conducting the frog embryo teratogenesis assay⁃Xenopus(FETAX),E1439⁃91[G]//Annual Book of ASTM Standards.Philadelphia:ASTM,1998:826-836.
[12] Salamance M J,Fernandez N,Cesar A,et al.Improved sea⁃urchin embryo bioassay for in situ evaluation of dredged material[J].Ecotoxicology,2009,18(8):1051-1057.
[13] Schuytema G S,Nebeker A V,GriffisusW L,et al.Effects of freezing on toxicity of sediments contaminated with DDT and endrin[J].Environmental Toxicology and Chemistry,1989,8(10):883-891.
[14] Zhu J M,Shi H H,Zhu P,et al.Effects of antagonist of retinoid X receptor(UVI3003)on morphology and gene profi le of Xenopus tropicalis embryos[J].Environmental Toxicology and Pharmacology,2014,38:153-162.
[15] Nagel R,Dar T.The embryo testwith the zebrafish Danio rerio⁃a,generalmodel in ecotoxicology and toxicology[J].ALTEX,2002,19(Suppl.1):38-48.
[16] Berga C,Gyllenhammara I,Kvarnryda M.Xenopus tropicalis as a test system for developmental and reproductive toxicity[J]. Journal of Toxicology and Environmental Health,2009,72(3/4):219-225.
[17] Kluth D.Embryology of anorectal malformations[J]. Seminars in Pediatric Surgery,2010,19(3):201-208.
[18] Guo SZ,Qian L J,ShiH H,etal.Effectsof tributyhin(TBT)on Xenopus tropicalis embryos at enviromentally relevant concentrations[J].Chemosphere,2010,79(5):529-533.
[19] Edgintion A N,Rouleau C,Stephenson G R,et al.2,4⁃D butoxyethyl ester kinetics in embryos of Xenopus laevis:the role of the embryonic jelly coat in reducing chemical absorption[J].Archives of Environmental Contamination and Toxicology,2007,52:113-120.
[20] Gyllenhammar I,Holm L,Eklund R,et al.Reproductive toxicity in Xenopus tropicalis after developmental exposure to environmental concentrations of ethynylestradiol[J].Aquatic Toxicology,2009,91(2):171-178.
[21] 郑和辉,叶常明.环境样品中乙草胺和丁草胺的残留分析[J].中国环境科学,2001,21(3):217-220.
[22] 秦晓飞,秦占芬,徐晓白,等.除草剂乙草胺对非洲爪蟾性腺发育的影响[J].生态毒理学报,2006,51(2):135-138.
[23] Kerby J L,Storfer A.Combined effects of atrazine and chlorpyrifos on susceptibility of the tiger salamander to Ambystoma tigrinum virus[J].Ecohealth,2009(6):91-98.
[24] 王彦华,俞卫华,王强,等.22种常用除草剂对蚯蚓(Eisenia fetida)的急性毒性[J].生态毒理学报,2012(3):317-325.
[25] 张贵生.镧和精恶唑禾草灵对鲦红细胞微核及核异常的影响[J].水产科学,2007(7):408-410.
[26] Casas E,Bonilla E,Ducolomb Y,et al.Differential effects of herbicides atrazine and fenoxaprop⁃ethyl,and insecticides diazinon and malathion,on viability and maturation of porcine oocytes in vitro[J].Toxicology in Vitro,2010,24(1):224-230.
[27] Shi H H,Yang B,Huang M S,etal.The toxicity of sediments from the black⁃odors river ofWenzhou,China,to the embryos of Xenopus tropicalis[J].Fresenius Environment Bulletin,2012,21(12B):3952-3958.
(责任编辑:卢福庄)
S 481;X 592
A
0528⁃9017(2015)11⁃1872⁃05
文献著录格式:应梦娇,李星翰,瞿巧文,等.运用热带爪蟾胚胎检测杭州稻田的生态毒性[J].浙江农业科学,2015,56(11):1872-1876,1879.
DOI 10.16178/j.issn.0528⁃9017.20151152
2015⁃08⁃03
浙江省自然基金(LY14B070014);浙江省大学生科技创新活动计划(2014R412003)
应梦娇(1992-),女,研究方向为水生生物生态毒理学。
尹晓辉。E⁃mail:yinxiaohui1229@126.com。
