羊膜移植在眼科领域中的合理应用
2015-03-07徐建江姚静
徐建江 姚静
·专家笔谈·
羊膜移植在眼科领域中的合理应用
徐建江 姚静
随着对羊膜特性的深入认识,传统羊膜移植的适应证逐渐扩大,并且出现了各种新型羊膜制品。本文主要对目前羊膜移植在眼科的进展和合理应用做一概述。(中国眼耳鼻喉科杂志,2015,15:3-5)
羊膜;眼表重建;移植
羊膜最早被用于皮肤移植和烧伤贴敷。1940年,De Rotth首先将羊膜应用于眼科,治疗睑球粘连。1995年,Kim等[1]应用保存的人羊膜治疗眼表疾病取得成功。自此,国内外陆续有羊膜移植治疗眼表疾病的报道。随着对羊膜生物学特性认识的深入,羊膜移植在眼科领域的应用也更加广泛和深入,已成为眼表重建的重要手段。本文主要对近年来羊膜移植在眼科的应用进展做一综述。
1 羊膜的生物学特性
人羊膜是从细胞滋养层衍化而来,是2层胎膜的内层。正常羊膜薄而透明,无血管、淋巴管和神经,厚度为0.02~0.5 mm。光学显微镜下观察,羊膜分为上皮层、基底膜和基质层,基质层进一步分为致密层、成纤维细胞层和海绵层。
1.1 促进上皮化 羊膜的基底膜是全身最厚的基底膜,含Ⅳ型、Ⅴ型和Ⅶ型胶原,层粘连蛋白,纤连蛋白和硫酸肝素蛋白多糖等——与结膜、角膜和角膜缘的基底膜成分基本相同,成为眼表重建的理想材料,提供健康的上皮下环境,促进上皮黏附、迁移和分化,并能维持上皮细胞的形态和分化,阻止其凋亡,延长其寿命,维持干细胞的克隆性。羊膜基质分泌的生长因子也可促进上皮细胞的生长[2-3]。
1.2 抑制纤维化 羊膜的基质是由成纤维细胞、胶原、蛋白多糖、糖蛋白和透明质酸等组成的疏松网状结构。基质含有多种生长因子,如肝细胞生长因子(HGF)、表皮生长因子(EGF)、转化生长因子(transformation growth factor, TGF)、角质细胞生长因子(KGF),有助于减少瘢痕。基质通过抑制TGF-β的信号系统抑制结膜、角膜及角膜缘成纤维细胞的增生和向肌纤维母细胞分化,抑制纤维化,减少瘢痕形成[2, 4]。
1.3 抑制炎症和新生血管 羊膜作为屏障阻隔炎症细胞和炎症介质与眼表的接触[5]。基质可通过抑制一些炎症因子[如白细胞介素1α(interleukin 1α, IL-1α)、IL-2、IL-8、γ干扰素、肿瘤坏死因子β(tumor necrosis factor β, TNF-β)、TNF-α,碱性成纤维细胞生长因子和血小板衍生因子]的表达和活性,发挥其抗炎特性。强效的抗炎蛋白(如IL-10、IL-1受体拮抗剂)和多种蛋白酶(如基质金属蛋白酶2、基质金属蛋白酶9、一氧化氮合酶)抑制剂也参与抑制炎症的过程。基质也可释放抗血管生成因子(如色素上皮衍生因子、IL-1受体拮抗剂、IL-10、基质金属蛋白酶的组织抑制剂、胶原18、血小板反应素-1),减少血管内皮细胞的增生,抑制新生血管[2, 6]。
1.4 其他 近年来发现羊膜具有抵抗细菌和病毒感染,减轻疼痛,促进神经生长等作用,但具体的作用机制有待进一步研究。
2 羊膜移植的临床适应证
基于羊膜的这些生物学特性,目前在眼科主要应用于眼表重建,包括结膜表面和角膜表面重建(表1),其适应证正不断扩大中。除了上述提到的临床适应证,近年来羊膜也开始应用于青光眼手术、限制性斜视和干眼症中。
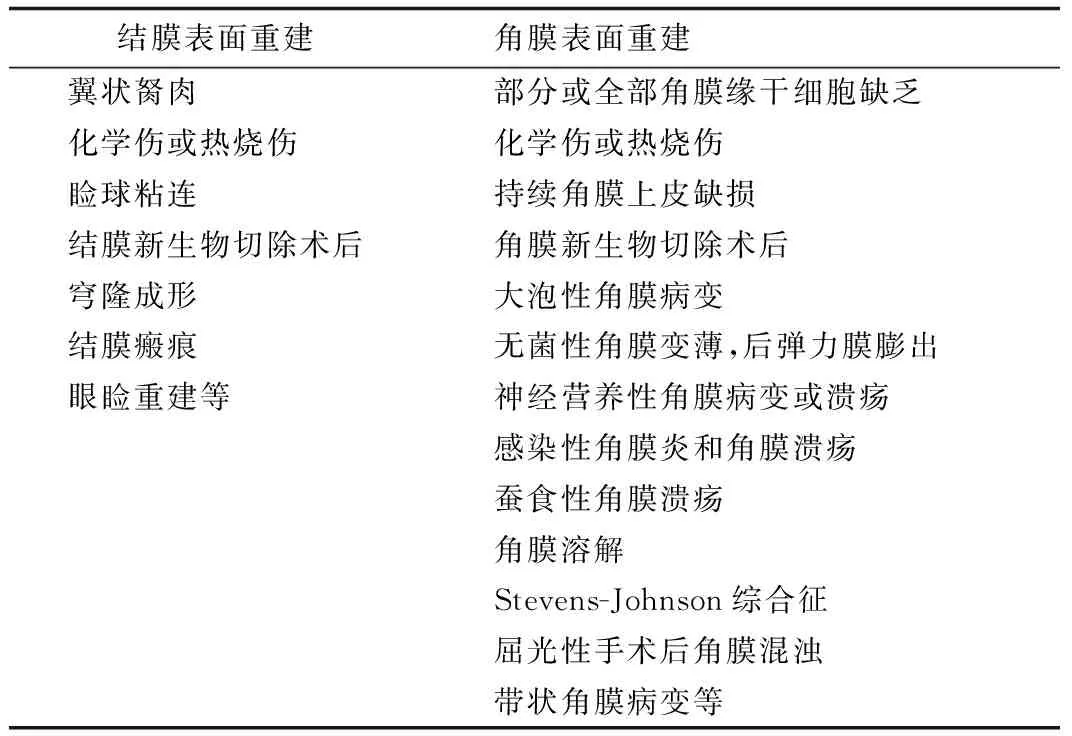
表1 羊膜移植的适应证
2.1 青光眼手术 青光眼滤过性手术最大的挑战是瘢痕化,尽管抗代谢药和生物胶的使用解决了一部分问题,但前者的毒性作用和后者的昂贵价格限制了其临床应用。由于羊膜具有抗纤维化和高度的水传导性[3],近年来尝试将单层或多层羊膜移植到巩膜瓣下或结膜瓣下,发现可以减少滤过泡瘢痕的形成,使眼压下降更理想[7]。滤过泡漏也可用羊膜修补,羊膜在修补滤过泡的同时保留了滤过泡的功能,但对于结膜失活和缺血导致的晚期滤过泡漏,羊膜的修补效果差[8- 9]。羊膜移植也可防止阀门管暴露。AmnioGuard是一种商品化的保存羊膜制品,约300 μm厚,用于阀门管植入手术中覆盖在阀门管表面。初步的研究[10]结果发现,其能在阀门管上方形成一层Tenon样结构,可有效防止阀门管的暴露。
2.2 限制性斜视 眼外肌、结膜、Tenon囊和巩膜之间瘢痕的形成可能导致斜视手术失败。羊膜移植可以减少因结膜瘢痕、脂肪粘连综合征和直肌收缩引起的粘连,提高手术成功率[11]。
2.3 干眼症 在干眼症中,羊膜可直接覆盖于泪小点处,达到闭塞泪小点的作用。近年有用羊膜制成的泪小点栓子来代替传统的栓子。由于羊膜的主要成分为多种胶原,植入泪道后在体液/泪液胶原酶作用下逐渐降解,质地柔软,不会对泪道壁造成损伤,留有的尖端不会给患者造成异物感,且可随时在裂隙灯下夹取尖端取出[12]。
3 羊膜移植的新进展
近年来,在传统羊膜移植的基础上,出现了各种新型羊膜制品,包括细胞培养载体、膜控缓释系统、羊膜提取液和羊膜活细胞制品等,开拓了羊膜移植在眼科应用的新领域。
3.1 细胞培养载体 多种细胞都能在羊膜上培养,常见的用于眼表重建的有角膜缘上皮细胞、角膜上皮细胞、结膜上皮细胞、角膜内皮细胞和口腔黏膜等[13],少见的有培养皮肤前体细胞向结膜上皮细胞分化[14],培养脐带干细胞或牙髓干细胞向角膜上皮细胞分化。由于羊膜特有的基底膜能促进细胞的移行与黏附,羊膜分泌的大量生长因子能促进细胞的生长与分化,具有常规载体无法比拟的优势。目前羊膜作为细胞培养载体在眼科主要用于各种疾病引起的严重角膜缘干细胞缺乏,解决了自体干细胞缺乏问题。但究竟使用完整的羊膜还是去上皮的羊膜作为载体目前还存在争议。有研究表明,完整羊膜更利于细胞表达角膜缘上皮细胞基因型,而去上皮羊膜则更有利于细胞表达角膜上皮细胞基因型。基于安全性考虑,目前多采用去上皮羊膜作为细胞培养载体。最近有文献[15]报道了一种三维微粒化羊膜作为悬浮培养的细胞载体。该细胞载体为白色半透明,直径300~600 mm,表面没有细胞成分,基底膜完整连续,基底膜下的胶原纤维互相交织,成孔洞状结构。这种新型载体在眼表组织工程中的作用有待进一步研究。
3.2 膜控缓释系统 羊膜基质层的网状结构使其可以通过生物学改良成为良好的药物载体,能容纳大量的药物分子,并随着羊膜的缓慢降解,在较长时间内逐步释放,维持局部有效药物浓度,成为良好的膜控半定量释药系统。而且羊膜的亲水性和透氧性远高于角膜接触镜,且具有减轻炎性反应、抑制瘢痕化、促进角膜创伤愈合与维持眼表稳定的优点,因此,羊膜作为潜在的控释给药系统在眼科具有极大的应用前景。有文献[16]报道,单层羊膜预先浸泡在氧氟沙星溶液中2 h吸收达到饱和,可缓慢释放至少7 h。浸泡阿昔洛韦的羊膜能明显抑制细胞内单纯疱疹病毒的复制[17]。目前研究的药物主要有,抗生素类、抗病毒类和抗真菌类用于感染性角膜溃疡,抗增殖类用于青光眼手术,生长因子促进上皮的再生。如何通过不同药物的联合达到协同作用,通过脂质体或壳聚糖纳米粒等生物材料与羊膜的结合来延长药物作用时间和提高药物释放的稳定性等将是今后研究的方向。
3.3 羊膜提取液 为了方便临床应用,羊膜提取液应运而生。2005年,意大利人首先在欧洲获得该项专利,目前已有商品化产品可以在欧洲购买。同年刘祖国教授在我国也获得羊膜提取液的专利。有研究[18-19]发现,羊膜提取液同样具有促进上皮化、减轻炎症和抑制新生血管的作用。将羊膜提取液局部应用于化学伤的患眼,发现可有效减轻炎症和促进上皮化,特别是对轻中度的急性化学伤[20],但对弥漫性角膜缘干细胞缺乏者无效,具体机制有待进一步研究。
3.4 羊膜活细胞制品 羊膜中可分离出间充质细胞和上皮细胞。间充质细胞具有扩增能力强、免疫原性低的干细胞性质,在适宜的条件下可分化为神经细胞、心肌细胞、软骨细胞等,是组织工程种子细胞的新来源。对上皮细胞的体外研究发现,它具有眼表重建的潜在应用价值,但目前尚无眼科应用的相关报道。近年来的许多研究表明,羊膜上皮细胞可合成和分泌多种神经递质及神经营养因子,可用来修复神经损伤。
3.5 其他 羊膜薄且易于卷曲,手术操作有一定的难度。Zakaria等[21]利用羊膜环和纤维蛋白胶将羊膜精确地移植到植床,提供了一种快速、标准化、无需缝线的羊膜移植方法。ProKera是一种食品药品管理局(FDA)批准的装置。双环PMMA底部黏附一层冷冻保存羊膜,类似一个巩膜接触镜,直径15 mm或16 mm,其配戴和取出都十分方便,而且单片包装,运送和保存方便,已被应用于多种眼表疾病,如持续性上皮缺损和化学伤等[10]。
随着对羊膜细胞和分子机制的阐明,组织工程的发展,手术技术的改进,羊膜移植的适应证必将不断扩大。尽管羊膜是目前眼表重建的金标准,具有无法比拟的优越性,但羊膜也有极少数并发症,如感染、肉芽肿反应等,而且羊膜本身不含活细胞,仍需要依靠宿主的正常状态,炎症和缺血都会影响羊膜移植的成功率。目前迫切需要多中心、前瞻性的随机对照研究来指导临床应用,真正使羊膜移植做到规范、高效和精确。
[ 1 ] Kim JC, Tseng SC. Transplantation of preserved human amniotic membrane for surface reconstruction in severely damaged rabbit corneas[J]. Cornea, 1995, 149(5): 473-484.
[ 2 ] Niknejad H, Peirovi H, Jorjani M, et al. Properties of amniotic membrane for potential use in tissue engineering[J]. Euro Cell Mater, 2008, 15: 88-99.
[ 3 ] Arya SK, Bhala S, Malik A, et al. Role of amniotic membrane transplantation in ocular surface disorders[J]. Nepal J Ophthalmol, 2010, 2(2): 145-153.
[ 4 ] Tseng SC, Li DQ, Ma X. Suppression of transforming growth factor-beta isoforms, TGF-beta receptor type II, and myofibroblast differentiation in cultured human corneal and limbal fibroblasts by amniotic membrane matrix[J]. J Cell Physiol, 1999, 179(3): 325-335.
[ 5 ] Chen HJ, Pires RT, Tseng SC. Amniotic membrane for severe neurotrophic ulcers[J]. Br J Ophthalmol, 2000, 84(8): 826-833.
[ 6 ] Kim JC, Tseng SC. The effects on inhibition of corneal neovascularization after human amniotic membrane transplantation in severely damaged rabbit corneas[J]. Korean J Ophthalmol, 1995, 9(1): 32-46.
[ 7 ] Sheha H, Kheirkhah A, Taha H. Amniotic membrane transplantation in trabeculectomy with mitomycin C for refractory glaucoma[J]. J Glaucoma, 2008, 17(4):303-307.
[ 8 ] Budenz DL, Barton K, Tseng SCG. Amniotic membrane transplantation for repair of leaking glaucoma filtering blebs[J]. Am J Ophthalmol, 2000, 130(5): 580-588.
[ 9 ] Rauscher FM, Barton K, Budenz DL, et al. Long-term outcomes of amniotic membrane transplantation for repair of leaking glaucoma filtering blebs[J]. Am J Ophthalmol, 2007, 143(6):1052-1054.
[10] Liu J, Sheha H, Fu Y, et al. Update on amniotic membrane transplantation[J]. Expert Rev Ophthalmol, 2010, 5(5): 645-661.
[11] Strube YN, Conte F, Faria C, et al. Amniotic membrane transplantation for restrictive strabismus[J]. Ophthalmology, 2011, 118(6): 1175-1179.
[12] 赵媛, 赵敏, 李晓丹, 等. 新型生物羊膜制品及其研究现状[J]. 中国实用眼科杂志, 2009, 27(10): 1065-1068.
[13] Grueterich M, Espana EM, Tseng SC. Ex vivo expansion of limbal epithelial stem cells: amniotic membrane serving as a stem cell niche[J]. Surv Ophthalmol, 2003, 48(6): 631-646.
[14] Lu R, Zhang X, Huang D. Conjunctival reconstruction with progenitor cell-derived autologous epidermal sheets in rhesus monkey[J]. PLoS One, 2011, 6(11): 25713.
[15] Ji SZ, Xiao SC, Luo PF, et al. An epidermal stem cells niche microenvironment created engineered human amniotic membrane[J]. Biomaterials, 2011, 32 (31): 7801-7811.
[16] Resch MD, Resch BE, Csizmazia E, et al. Drug reservoir function of human amniotic membrane[J]. J Ocul Pharmaco Ther, 2011, 27(4): 323-326.
[17] Mencucci R, Paladini I, Menchini U, et al. Inhibition of viral replication in vitro by antiviral-treated amniotic membrane. Possible use of amniotic membrane as drug-delivering tool[J]. Br J Ophthalmol, 2011, 95(1): 28-31.
[18] Shahriari HA, Tokhmehchi F, Reza M, et al. Comparison of the effect of amniotic membrane suspension and autologous serum on alkaline corneal epithelial wound healing in the rabbit model[J]. Cornea, 2008, 27(10): 1148-1150.
[19] Jiang A, Li C, Gao Y, et al. In vivo and in vitro inhibitory effect of amniotic extraction on neovascularization[J]. Cornea, 2006, 25(10 Suppl 1): 36-40.
[20] Liang L, Li W, Ling S, et al. Amniotic membrane extraction solution for ocular chemical burns[J]. Clin Experiment Ophthalmol, 2009, 37(9): 855-863.
[21] Zakaria N, Koppen C, Van Tendeloo V, et al. Standardized limbal epithelial stem cell graft generation and transplantation[J]. Tissue Eng Part C Methods, 2010, 16(5): 921-927.
(本文编辑 诸静英)
Rational application of amniotic membrane transplantation in ocular disorders
XUJian-jiang,YAOJing.
DepartmentofOphthalmology,EyeEarNoseandThroatHospitalofFudanUniversity,Shanghai200031,China
XU Jian-jiang, Email: jianjiangxu@126.com
With the deep realization of the properties of amniotic membrane, traditional indications of amniotic membrane transplantation are expanding. It has also prompted the advent of many novel amniotic membrane products. This article will focus on recent advances and rational application of amniotic membrance transplantation in ocular disorders. (Chin J Ophthalmol and Otorhinolaryngol,2015,15:3-5)
Amniotic membrane; Ocular surface reconstruction; Transplantation
复旦大学附属眼耳鼻喉科医院眼科 上海 200031
徐建江(Email: jianjiangxu@126.com)
10.14166/j.issn.1671-2420.2015.01.002
2012-09-26)
