贝伐单抗联合培美曲塞维持治疗对晚期非鳞状非小细胞肺癌患者循环microRNA-19以及白细胞介素-27表达的影响
2015-03-07宋维舒
鄢 文,靳 文,王 昂 ,宋维舒
(广东省第二人民医院1.肿瘤一科;2.心血管二科,广东 广州 510317)
◇药物与临床◇
贝伐单抗联合培美曲塞维持治疗对晚期非鳞状非小细胞肺癌患者循环microRNA-19以及白细胞介素-27表达的影响
鄢文1,靳文2,王昂1,宋维舒1
(广东省第二人民医院1.肿瘤一科;2.心血管二科,广东 广州510317)
摘要:目的探讨贝伐单抗联合培美曲塞维持治疗晚期非鳞状非小细胞肺癌疗效及对循环microRNA(miR)-19和白细胞介素(interleukin,IL)-27表达水平的影响。方法选择2013年3月至2014年3月入住该院的经一线含铂类方案化疗获得控制的晚期非鳞状非小细胞肺癌患者45例,遵循知情同意原则分为培美曲塞组(25例)和贝伐单抗联合培美曲塞组(20例);分别观察1年内两组疗效以及患者外周血miR-19、IL-27的表达。结果培美曲塞联合贝伐单抗组和培美曲塞组的疾病控制率分别为80%和48%,总有效率分别为45%和24%,两组间疾病控制率和总有效率比较均存在统计学差异(P<0.05);培美曲塞联合贝伐单抗组外周血miR-19表达约是培美曲塞组的0.57倍,两组间相比存在统计学差异(P<0.05)。与培美曲塞组相比,培美曲塞联合贝伐单抗组外周血IL-27表达升高,两组间相比存在统计学差异(P<0.05)。结论贝伐单抗联合培美曲赛维持治疗有助于改善晚期非鳞状非小细胞肺癌的治疗效果,降低外周血miR-19、升高IL-27的表达。
关键词:非小细胞肺癌;microRNA-19;白细胞介素-27;贝伐单抗;培美曲塞
肺癌是最常见的恶性肿瘤之一,发病率和死亡率均居我国恶性肿瘤的首位,其中以非小细胞肺癌(non-small cell lung cancer,NSCLC)最为多见[1]。由于多数肺癌获得有效诊治已处于晚期阶段,以铂类为基础的化疗方案是目前晚期NSCLC的一线治疗方案[2]。在一线化疗方案结束后对获得疾病控制的晚期NSCLC患者采用维持治疗方案能够有效延长晚期NSCLC患者的无进展生存期(progression free survival,PFS)和/或总生存期(overall survival,OS)[2]。外周血microRNA(miR)-19(包括miR-19a和miR-19b)、白细胞介素(interleukin,IL)-27与NSCLC的病情严重程度以及转移密切相关[3-5]。本研究旨在观察贝伐单抗联合培美曲塞维持治疗晚期非鳞状NSCLC的疗效以及对循环miR-19以及IL-27表达水平的影响,以进一步探讨miR-19、IL-27在晚期NSCLC患者诊治中的潜在应用价值。
1对象与方法
1.1研究对象选择2013年3月至2014年3月入住我院的经病理学和影像学明确诊断的晚期(ⅢB期和Ⅳ期,排除肺癌脑转移患者)非鳞状NSCLC患者。以上患者均经一线含铂类方案(具体:TP方案:紫杉醇175 mg·m-2d1,顺铂 75 mg·m-2d1,q21d;GP:吉西他滨 1 g·m-2d1、d8,顺铂 75 mg·m-2d1,q21d;NP方案:长春瑞滨 25 mg·m-2d1、d8,顺铂 75 mg·m-2d1,q21d,DP:多西他赛 75 mg·m-2d1,顺铂 75 mg·m-2d1,q21d)化疗4周期后,经影像学、肿瘤标志物、血常规、血生化等多项检查证实患者肿瘤缓解或者稳定后给予维持治疗。遵循知情同意原则,分为培美曲塞组(25例)和贝伐单抗联合培美曲塞组(20例);分别观察1年内两组疗效以及患者外周血miR-19、IL-27的表达。
1.2研究方案培美曲塞组:培美曲塞500 mg·m-2d1,q21d,持续至病情进展。在培美曲塞给药前1周开始口服叶酸400 μg·d-1,一直服用整个治疗周期,至最后1次给药后21 d;在培美曲塞给药前1周给予维生素B121 000 μg肌肉注射,以后每3个周期肌注一次;在培美曲塞给药前1 d、当天和第2天口服地塞米松片4 mg,每天2次。
贝伐单抗联合培美曲塞组在培美曲塞组治疗基础上予以贝伐单抗治疗。贝伐单抗15 mg·kg-1,d1,q21d,持续至病情进展。在维持化疗第2个周期后进行临床疗效评价。
1.3临床疗效评价依据新版实体瘤疗效评价标准:修订的实体瘤疗效评价标准(response evaluation criteria in solid tumours revised,RECIST)指南(1.1版本),将实体瘤疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progressive disease,PD);依据临床疗效评价,将CR+PR定义为总有效率(ORR),CR+PR+SD定义为疾病控制率(DCR)。
1.4循环miR-19检测所有入选患者于研究终点时采集空腹静脉血6 mL,以3 000 r·min-1离心10 min取血浆贮存于-80℃冰箱备存待检。采用miRNeasyTMMini Kit试剂盒,并依据试剂盒说明书提取血浆总RNA。对A260/A280在1.8~2.0之间的RNA样本进行逆转录后行cDNA的合成,参考荧光定量PCR试剂盒说明书对样本中miR-19表达进行检测。所有实验重复3次。miR-19的表达使用U6标准化后,以2-ΔΔCt表示。
1.5外周血IL-27表达水平的检测采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测非鳞状NSCLC患者外周血IL-27的表达水平(具体操作参考IL-27 ELISA试剂盒说明书)。
1.6统计学方法采用SPSS 16.0统计软件进行数据分析。计量数据以均数±标准差表示。组间比较采用独立样本t检验。疗效比较则采用两独立样本非参数检验。计数资料的组间比较则采用卡方检验。P< 0.05时为差异有统计学意义。
2结果
2.1患者一般临床资料本研究共入选ⅢB期、Ⅳ期非鳞状NSCLC患者45例,其中男性28,女性17例。两组患者在性别、年龄、吸烟史、贫血、病理类型、ⅢB期和Ⅳ期 NSCLC患者比例方面无差异(P>0.05)。见表1。
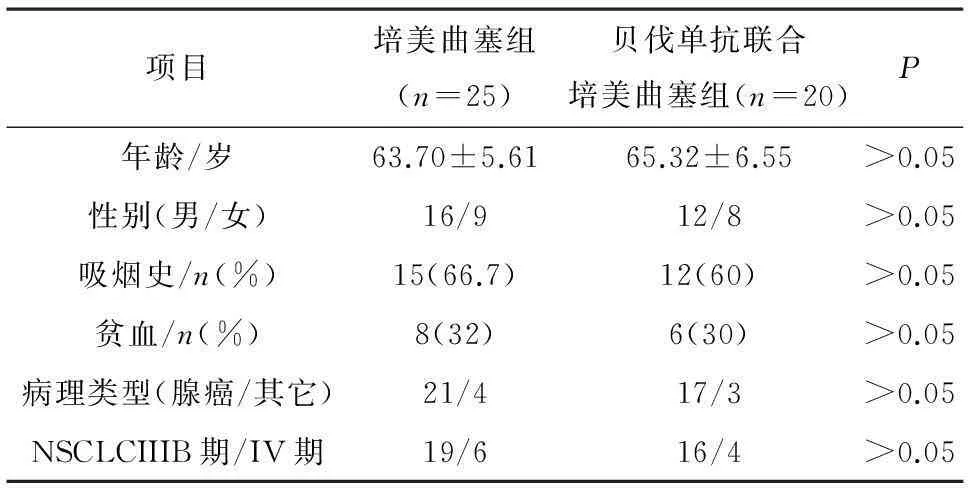
表1 患者一般临床资料
2.2贝伐单抗联合培美曲塞维持治疗对晚期非小细胞肺癌的临床疗效以及循环miR-19、IL-27表达的影响两组患者入选后均随访1年,培美曲塞组CR 0例,PR 6例,SD 6例,PD 13例,其中死亡4 例;贝伐单抗联合培美曲塞组CR 0例,PR 9例,SD 7例,PD 4例,死亡2例。1年内培美曲塞联合贝伐单抗组和培美曲塞组的疾病控制率分别为80%和48%,总有效率分别为45%和24%,两组患者的DCR、ORR相比,均存在统计学差异(P<0.05)。两组患者外周血miR-19表达水平相比,存在统计学差异(P<0.05);其中,miR-19在贝伐单抗联合培美曲塞组的表达约是培美曲塞组的0.57倍。与培美曲塞组相比,培美曲塞联合贝伐单抗组外周血IL-27表达升高,两组间相比存在统计学差异(P<0.05)。见表2。
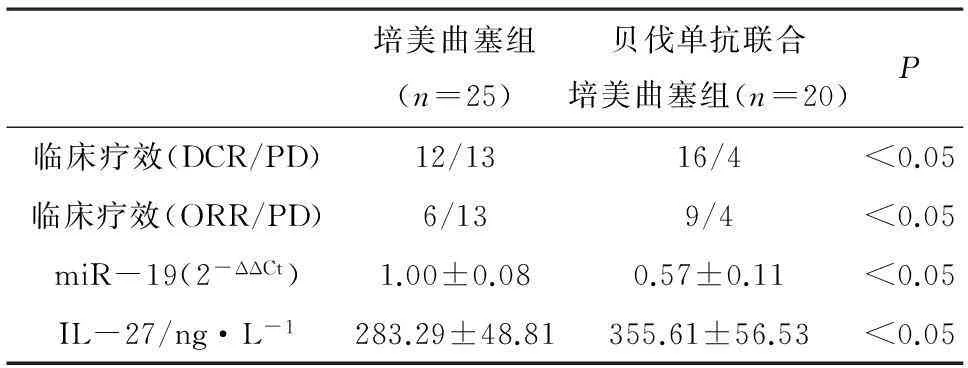
表2 贝伐单抗联合培美曲塞维持治疗对晚期非小细胞
3讨论
NSCLC维持治疗是针对完成以铂类为基础化疗并获得疾病控制的晚期NSCLC患者,在接受二线化疗前的“观察等待”阶段所进行的特定化疗,目的在于延长晚期NSCLC患者的PFS及OS[6]。根据维持治疗前后使用药物是否相同,维持治疗方案分为继续维持治疗(continuation maintenance therapy,CMT)和换药维持治疗(switch maintenance therapy,SMT)。CMT是在一线化疗结束后使用一线化疗方案中某种化疗药物或靶向治疗药物对患者继续化疗,SMT则是在一线化疗结束后,使用另一种无交叉耐药的药物继续化疗。临床研究证实维持治疗能够为病情好转或稳定的NSCLC患者带来进一步的临床获益,可延长PFS,以培美曲塞、厄罗替尼和贝伐单抗等药物为主的维持治疗方案甚至可延长OS,这些结果肯定了维持治疗在晚期NSCLC治疗中的作用[2,6]。鉴于上述药物在NSCLC维持治疗中的积极作用,临床研究进一步比较了联合上述药物是否能够为NSCLC治疗带来更大获益。
晚期非鳞状NSCLC在贝伐单抗、顺铂以及培美曲塞一线治疗后贝伐单抗是否联合培美曲塞的随机III期临床试验(AVAPERL试验)的目的在于检测贝伐单抗与培美曲塞联合维持治疗晚期NSCLC的效果是否优于贝伐单抗单药维持治疗。与贝伐单抗单药维持治疗(PFS 3.7月,OS 13.2月)相比,贝伐单抗+培美曲塞联合维持治疗(PFS 7.4月,OS 17.1月)可以明显延长非鳞状NSCLC患者的无进展生存期和总的生存期[7]。但是AVAPERL试验对于贝伐单抗与培美曲塞联合维持治疗晚期NSCLC是否优于培美曲塞单药维持治疗并没有做出研究。对于这一临床问题,国内张玉梅等[8]研究认为培美曲塞联合贝伐单抗较单用培美曲塞能够延长NSCLC患者PFS和OS。本研究初步表明非鳞状NSCLC患者1年内应用培美曲塞联合贝伐单抗较单用培美曲塞在DCR和ORR方面均获得明显改善,结合上述研究提示贝伐单抗与培美曲塞联合维持治疗晚期非鳞状NSCLC作用优于单用贝伐单抗或培美曲塞维持治疗。
microRNA是一类长度为18~24个核苷酸的非编码RNA,它通过完全或不完全互补结合作用于靶基因mRNA 3′非编码区域,发挥调节靶基因表达作用。以microRNA为重要组成部分的基因调控网络决定了细胞的生长、分化、发育、增殖、自噬以及凋亡等病理生理过程。microRNA在肿瘤的形成与发展中扮演重要角色,与肺癌的形成与发展、诊断、治疗以及预后密切相关[9-10]。其中,肿瘤远处转移是肺癌等肿瘤治疗失败和死亡的主要原因。特异microRNA的过度表达或表达不足与临床肿瘤转移密切相关。基础研究发现一些microRNA与肺癌转移相关,如miR-29c、miR-30a、miR-34a/b/c等具有抑制肺癌转移作用,miR-17-92、miR-135b、miR-143、miR-31等具有促进肺癌转移作用[11]。其中,miR-17-92家族是一个含有多顺反子的高度保守的miRNA,包括miR-17、miR-18a、miR-19a、miR-19b、miR-20a、miR-92a等6个microRNAs。miR-17-92基因簇在肺癌及其转移中作用受到肯定。临床研究发现与肺癌易感人群相比,NSCLC患者外周血中miR-17-92表达明显升高[12]。与NSCLC患者手术切除肿瘤前相比,术后7~10 d miR-19a、miR-19b等microRNAs表达进一步降低[13]。进一步研究认为miR-19(包括miR-19a和miR-19b)是miR-17-92家族成员中发挥致瘤作用的主要成分[14-15]。miR-19通过靶作用于抑癌基因PTEN,激活Akt-mTOR信号通路,抑制肿瘤细胞凋亡[14-15]。课题组前期研究证实miR-19具有促进肺腺癌细胞株A549-Luc细胞转移作用[12]。临床研究发现miR-19a和miR-19b在NSCLC患者血清中较正常人高表达,并且血清miR-19a和miR-19b表达水平与NSCLC患者TNM分期以及淋巴结转移正相关,与OS显著负相关[3-4];提示外周血miR-19表达水平与晚期NSCLC患者病情严重程度以及预后密切相关。本研究中,在贝伐单抗联合培美曲塞组晚期非鳞状NSCLC患者外周血miR-19表达水平较培美曲塞组明显降低,结合两组患者治疗效果,提示外周血miR-19表达水平可反映非鳞状NSCLC的治疗反应和预后。
目前认为肺癌患者体内存在的免疫失衡状态与肺癌预后明显相关。对肺癌患者的进行免疫调控治疗将有助于提高肺癌的治疗效果。机体免疫系统具有免疫监视功能,当体内出现细胞恶变时,免疫系统能够识别并通过免疫机制特异地清除这些“非己”细胞,抵御肿瘤的发生发展。然而,恶变细胞在某些情况下能通过多种机制逃避机体的免疫监视,在体内迅速增殖,形成肿瘤,这种肿瘤细胞通过多种机制逃避机体免疫系统识别和攻击,在体内生存和增殖的现象即为免疫逃逸[16]。肿瘤免疫逃逸机制的深入研究,为探讨肿瘤免疫治疗提供了新思路。树突状细胞(Dendritic cell,DC) 是体内功能最强的专职抗原递呈细胞,在抗原的捕获、加工、提呈和激活淋巴细胞产生免疫反应中起着相当重要的作用,在诱导抗肿瘤免疫反应中其作用为:(1)前体DC对肿瘤抗原分子的识别;(2)直接或由干扰素(interferon,IFN)-γ介导间接激活NK细胞对肿瘤进行杀伤;(3)捕获和交叉提呈肿瘤抗原;(4)活化肿瘤抗原特异性T细胞以及非特异性巨噬细胞和嗜酸性粒细胞;(5)诱导肿瘤抗原特异性T细胞向肿瘤趋化、识别并消灭肿瘤[17]。肿瘤免疫逃逸的机制与肿瘤对DC功能的影响有密切关系。肿瘤不但可以直接诱导DC凋亡,还可以通过干扰DC分化的多个环节,使肿瘤患者体内DC数量下降,成熟受限,功能发生障碍,从而下调或抑制DC的抗原提呈及其免疫起始功能。肿瘤细胞可以通过释放IL-10、VEGF 等细胞因子阻碍DC的分化和/或抗原提呈功能。大量资料表明,肿瘤组织中DC的数量和功能存在异常。肿瘤病人外周血中 DC 数量显著减少,且全身转移的病人相对于未转移的更低。此外,肿瘤病人体内DC存在功能缺陷,DC分化成熟障碍是其主要原因。DC 异常分化的结果是(1)有功能的成熟DC比例下降;(2)不成熟的DC大量积累;(3)未成熟的髓样细胞大量积聚,它们具有抑制抗原特异性T细胞的功能,通过细胞与细胞的相互作用,诱导肿瘤免疫耐受。同时发现在肿瘤早期去除树突状细胞会加速肿瘤的扩散,而如果在晚期除去树突状细胞则会延迟肿瘤的进展[18]。这些研究表明在肿瘤微环境中,树突状细胞发生了表型和功能的改变,进而导致了肿瘤免疫逃逸的发生。我们从已有的研究结果不难看出树突状细胞是肿瘤的免疫逃逸关键因素。肺癌的发生发展与DCs介导的免疫逃逸密切相关[18],主要表现为:(1)肺癌细胞通过释放 TGF-β、IL-4、血管内皮生长因子(vascular endothelial growth factor,VEGF)、IL-10、抑制性 E 受体、黏附因子、环氧合酶2(cyclooxygenase-2,COX-2)和前列腺素E2(prostaglandin E2,PGE2),抑制 DCs 的成熟和分化,促进Th1/Th2的平衡向Th2漂移,降低效应T细胞的活化和功能,逃脱免疫监视;(2)肺癌细胞大量表达肿瘤相关抗原GA733-2,影响肺癌浸润部位DCs表达主要组织相容性复合体(major histocompatibility complex,MHC)-II类分子和共刺激分子B7,从而影响T细胞活化;(3)肺癌细胞所分泌的一类糖磷脂神经节苷脂,可抑制单核细胞来源的DCs表达分化群(cluster of differentination,CD)54、CD40、CD80和CD1a等抗原,使其低表达IL-12而高表达IL-10,从而诱导DCs自身凋亡,使肺癌细胞逃避机体的免疫监视和免疫清除。此外,近来研究发现NSCLC组织中浸润的DCs数量较早期肺癌组织明显增加[19],并以高表达T细胞免疫球蛋白和粘蛋白分子3(T cell immunoglobulin mucin-3,Tim-3)的DCs为主[20]。此外研究发现Tim-3与NSCLC的不良预后密切相关[21]。更进一步研究发现高表达Tim-3的DCs分泌IL-12、IFN-β1较低表达Tim-3 的DCs明显减少;在免疫抑制因子VEGF、IL-10等刺激下DCs高表达Tim-3;以Tim-3单克隆抗体干预DCs,可使DCs分泌IL-12、INF-β1明显增加,并能够明显增强抗肿瘤药物的疗效,其机制与Tim-3结合高迁移率族蛋白B1(high mobility group box-1 protein,HMGB1),从而阻止HMGB1结合免疫激活作用的核酸被DCs内吞[20]。以上研究提示DCs介导NSCLC免疫逃逸的关键分子,是肺癌的免疫治疗重要切入点。
IL-27是IL-6/IL-12家族一员,由p28和epstein-barr(EB)病毒诱导基因3形成的异质二聚体,主要由抗原递呈细胞(DCs、巨噬细胞、单核细胞)产生。IL-27主要通过与靶细胞表面IL-27受体(IL-27 receptor,IL-27R)特异性结合来实现对靶细胞的调控作用[22]。IL-27R主要在T细胞、单核细胞及DCs中表达。 IL-27与IL-27R特异性结合后分别通过Janus激酶(Janus kinase,JAK)1、 JAK2介导的信号传导及转录激活因子(signal transducers and activators of transcription,STAT)1和STAT3通路,以及丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)通路对淋巴细胞分化、功能进行调控[22],主要通过(1)促进T细胞向Th1型细胞分化以及促炎症因子干扰素γ(interferon γ,INF-γ)、TNF-α、IL-12表达;(2)阻碍T细胞向Th2型细胞分化以及IL-10的分泌;(3)阻碍T细胞向Th17型细胞分化,抑制IL-17的分泌;而IL-17有促进非小细胞肺癌转移作用;(4)促进MHC-I 类链相关蛋白A表达,激活NK细胞和CD8+T细胞,发挥细胞毒作用;(5)限制调节性T细胞(regulatory T cell,Treg cell)的分化和功能;(6)减少COX-2和PGE2的表达达到抑制小鼠肺腺癌细胞株LLC-1的迁移、侵袭以及在活体内生长。已有研究证实IL-27不仅能够直接抑制NSCLC细胞增殖和转移,抑制NSCLC细胞发生内皮间充质细胞转化有关[23],还可促进DCs分化、成熟,促进DCs免疫应答[24],提示IL-27可能通过抑制DCs途径介导的NSCLC免疫逃逸,激活DCs免疫应答,促进Th1细胞及其炎症因子分化,激活NK细胞和CD8+T细胞,抑制Th2、Th17、调节性T细胞等细胞分化及其炎症因子分泌,抑制免疫抑制因子PGE2、COX-2活性等环节抑制NSCLC增殖和转移。课题组前期研究发现晚期NSCLC患者外周血IL-27、IL-12表达降低,IL-10表达增加[25],综合上述研究结果提示IL-27可能具有抑制NSCLC增殖作用。本研究发现在贝伐单抗联合培美曲塞组晚期非鳞状NSCLC患者外周血IL-27表达水平较培美曲塞组明显升高,提示贝伐单抗联合培美曲塞维持治疗的晚期非鳞状NSCLC的免疫状况优于单用培美曲塞维持治疗,这也与两种治疗方案的临床治疗效果相符。对于IL-27是如何参与贝伐单抗联合培美曲塞维持治疗晚期非鳞状NSCLC可能与miR-19关系密切。体外实验研究发现PGE2可以促进NSCLC细胞株原癌基因MYC、miR-17-92以及COX-2水平的表达,抑制抑癌基因PTEN表达,使NSCLC细胞株抗凋亡能力增强;NSCLC患者服用COX-2特异性抑制剂塞来昔布后循环miR-17-92表达水平降低。另外,由于miR-19是miR-17-92的主要致瘤成分,IL-27可以抑制PGE2和COX-2的表达,提示IL-27可能通过抑制PGE2和COX-2表达,进一步抑制miR-19的表达和NSCLC的增殖和转移。结合本研究结果我们推测贝伐单抗联合培美曲塞维持治疗改善晚期非鳞状NSCLC的治疗效果可能部分通过降低外周血miR-19表达、促进IL-27的表达以及改善机体免疫功能状态实现。
综上所述,贝伐单抗联合培美曲塞维持治疗有助于改善晚期非鳞状NSCLC的治疗效果,降低外周血miR-19表达,促进IL-27的表达。
参考文献:
[1]郝捷,陈万青. 2012中国肿瘤登记年报[M].北京:军事医学出版社,2012:1-300.
[2]Chan BA,Hughes BG. Targeted therapy for non-small cell lung cancer: current standards and the promise of the future[J]. Transl Lung Cancer Res,2015,4(1):36-54.
[3]Lin Q,Chen T,Lin Q,et al. Serum miR-19a expression correlates with worse prognosis of patients with non-small cell lung cancer[J]. J Surg Oncol,2013,107(7):767-771.
[4]吴朝辉. 血清miR-19b和miR-146a作为非小细胞肺癌判断预后的生物标志物[D].厦门:厦门大学,2014.
[5]Elinav E,Nowarski R,Thaiss CA,et al.Inflammation-induced cancer: crosstalk between tumours,immune cells and microorganisms[J]. Nat Rev Cancer,2013,13(11):759-771.
[6]叶重阳,谢家政. 晚期非小细胞肺癌维持治疗的进展[J].中国临床药理学和治疗学,2013,18(10):1192-1195.
[7]Barlesi F,Scherpereel A,Gorbunova V,et al. Maintenance bevacizumab- pemetrexed after first-line cisplatin-pemetrexed-bevacizumab for advanced nonsquamous nonsmall-cell lung cancer: updated survival analysis of the AVAPERL (MO22089) randomized phase III trial[J]. Ann Oncol,2014,25(5):1044-1052.
[8]张玉梅,李春姗,陈逸恒. 贝伐单抗联合培美曲塞治疗非小细胞肺癌临床观察[J]. 中华肿瘤防治杂志,2014,21(1):51-54.
[9]Molina-Pinelo S,Gutiérrez G,Pastor MD,et al. MicroRNA-dependent regulation of transcription in non-small cell lung cancer[J].PLoS One,2014,9(3):e90524.
[10] 刘莎,孙国平. miRNA145作为抑癌基因在胃癌中的表达及其功能研究[J].安徽医药,2014,18(10):1817-1820.
[11] 鄢文,靳文,王昂,等. miR-19对肺腺癌A549细胞株迁移功能的影响[J]. 实用医学杂志,2014,30(13):2031-2034.
[12] Krysan K,Kusko R,Grogan T,et al. PGE2-driven expression of c-Myc and oncomiR-17-92 contributes to apoptosis resistance in NSCLC[J]. Mol Cancer Res,2014,12(5):765-774.
[13] Rabinowits G,Gerçel-Taylor C,Day JM,et al.Exosomal microRNA:a diagnostic marker for lung cancer[J].Clin Lung Cancer,2009,10(1):42-46.
[14] Olive V,Bennett MJ,Walker JC,et al. miR-19 is a key oncogenic component of mir-17-92[J].Genes Dev,2009,23(24):2839-2849.
[15] Hong L,Lai M,Chen M,et al. The miR-17-92 cluster of microRNAs confers tumorigenicity by inhibiting oncogene-induced senescence[J].Cancer Res,2010,70(21):8547-8557.
[16] Kerkar SP,Restifo NP.Cellular constituents of immune escape within the tumormicroenvironment[J].Cancer Res,2012,72(13):3125-3130.
[17] Bhargava A,Mishra D,Banerjee S,et al.Dendritic cell engineering for tumor immunotherapy: from biology to clinical translation[J]. Immunotherapy,2012,4(7):703-718.
[18] Apetoh L,Locher C,Ghiringhelli F,et al. Harnessing dendritic cells in cancer[J]. Semin Immunol,2011,23(1):42-49.
[19] Hald SM,Bremnes RM,Al-Shibli K,et al. CD4/CD8 co-expression shows independent prognostic impact in resected non-small cell lung cancer patients treated with adjuvant radiotherapy[J]. Lung Cancer, 2013,80(2):209-215.
[20] Chiba S,Baghdadi M,Akiba H,et al. Tumor-infiltrating DCs suppress nucleic acid-mediated innate immune responses through interactions between the receptor TIM-3 and the alarmin HMGB1[J]. Nat Immunol,2012,13(9):832-842.
[21] Zhuang X,Zhang X,Xia X,et al. Ectopic expression of TIM-3 in lung cancers: a potential independent prognostic factor for patients with NSCLC[J]. Am J Clin Pathol,2012,137(6):978-985.
[22] Hunter CA,Kastelein R. Interleukin-27: balancing protective and pathological immunity[J]. Immunity,2012,37(6):960-969.
[23] Kachroo P,Lee MH,Zhang L,et al. IL-27 inhibits epithelial-mesenchymal transition and angiogenic factor production in a STAT1-dominant pathway in human non-small cell lung cancer[J]. J Exp Clin Cancer Res,2013,32(1):97.
[24] 张璁,田志辉,刘丽华,等. IL-27促进人单个核细胞来源树突状细胞的分化成熟及其作用机制[J]. 中国肿瘤生物治疗杂志,2012,19(1):11-16.
[25] 鄢文,靳文,王昂,等. IL-27在非小细胞肺癌患者外周血中的表达[J]. 现代医院,2014,14(7):7-9.
Effect of maintenance therapy with bevacizumab-pemetrexed for advanced non-squamous non-small cell lung cancer and on the levels of circulating miR-19 and interleukin-27 expression
YAN Wen1,JIN Wen2,WANG Ang1,et al
(1.DepartmentofOncology;2.DepartmentofCarodiovascular,GuangdongNo.2People’sHospital,Guangzhou510317,China)
Abstract:ObjectiveTo investigate the effect of maintenance therapy with bevacizumab-pemetrexed for advanced non-squamous non-small cell lung cancer and on the levels of circulating microRNA(miR)-19 and interleukin (IL)-27 expression.Methods45 patients with advanced no-squamous non-small cell lung cancer and gotten controlled after first-line containing cisplatin chemotherapy who enrolled into our hospital were randomized into pemetrexed group (n=25) and bevacizumab + pemetrexed group (n=20) accroding to the principle of informed consent. The curative effect of the two groups within 1 year and the expression of circulating miR-19 and IL-27 expression were observed.ResultsThe disease control rate was 80% in bevacizumab + pemetrexed group and was 48% in pemetrexed group,the overall response rate was 45% in bevacizumab + pemetrexed group and was 24% in pemetrexed group. There have significant difference between two groups in the disease control rate and the overall response rate (P<0.05). The levels of circulating miR-19 in bevacizumab + pemetrexed group was 0.57 fold the pemetrexed group. There has significant difference between two groups in the levels of circulating miR-19 (P<0.05). Compared with the pemetrexed group,the levels of circulating IL-27 were increased in bevacizumab + pemetrexed group (P<0.05).ConclusionMaintenance therapy with bevacizumab+pemetrexed for advanced non-squamous non-small cell lung cancer could improve the clinical therapy effect,reduce the levels of circulating miR-19 expression and increased circulating IL-27 expression .
Key words:non-small cell lung cancer;microRNA-19;interleukin-27;bevacizumab;pemetrexed
(收稿日期:2015-03-02,修回日期:2015-06-23)
通信作者:王昂,男,副主任医师,研究方向:肿瘤的免疫治疗,E-mail:48457742@qq.com
基金项目:广东省自然科学基金项目(No S2013040014341);广东省医学科研课题(No B2013061)
doi:10.3969/j.issn.1009-6469.2015.09.050
